七氟醚可能通过调控SIRT1-FOXO1介导的自噬对大鼠脑缺血再灌注损伤的影响
陈 健, 李成洁, 李 媛
(1.海南省儋州市海南西部中心医院麻醉科, 海南 儋州 571700 2.海南医学院第一附属医院麻醉科, 海南 海口 570102)
脑动脉栓塞引起的缺血性脑卒中可引起局部血供紊乱,导致高发病率和死亡率,占脑血管疾病的60%~80%。脑缺血再灌注(I/R)损伤是缺血性脑卒中的常见并发症之一,脑I/R损伤的细胞和分子机制涉及氧化应激、自噬、凋亡、炎症反应和坏死等多种病理过程,这些机制影响脑I/R损伤的预后[1]。因此,迫切需要一种有效的脑I/R损伤治疗方法。近年来,研究人员发现自噬在脑I/R损伤的这些病理过程中发挥了关键作用[2]。自噬是一个高度保守的动态过程,降解长寿命或错误折叠的蛋白质和受损的细胞器,其功能随着年龄的增长而下降。作为神经退行性疾病、癌症和心血管疾病等慢性疾病的独立危险因素,衰老是一个不可逆的生物学过程。研究表明,自噬调节衰老相关疾病,尤其是神经退行性疾病,包括阿尔茨海默病、帕金森病和缺血性卒中[3]。自噬可能因脑I/R损伤期间的缺血、缺氧和应激反应而加剧。七氟醚是一种挥发性麻醉剂,起效快,易于控制,对颅内压和脑氧代谢率影响极小。这些因素使其成为的神经外科手术可行的麻醉剂。研究表明,七氟醚后处理可改善缺血再灌注后的神经功能,并通过抑制氧自由基的产生来保护神经元,从而防止细胞内钙超载和兴奋性氨基酸的神经毒性作用[4]。尽管有研究报道七氟醚对缺血再灌注损伤具有神经保护作用,但尚不清楚七氟醚是否通过SIRT1-FOXO1信号通路调节自噬来改善脑I/R损伤。
1 材料与方法
1.1主要试剂仪器:七氟醚(江苏恩华药业有限公司);SIRT1抑制剂EX527化合物(Sigma-Aldrich公司);TUNEL染色试剂盒(罗氏公司);TTC染色试剂盒、BCA蛋白定量试剂盒(北京索莱宝科技有限公司);紫外分光光度计(NanoDrop Technologies公司);荧光显微镜(尼康仪器有限公司);石蜡切片机(Leica公司);透射电子显微镜(JEOL公司)。
1.2方 法
1.2.1实验动物及分组:60只雄性SD大鼠(240±20g)饲养温度为22±2℃,相对湿度为55~65%,光照/黑暗周期为12h,可自由获得食物和水的动物房中。将大鼠随机分为5组:假手术(Sham)组、缺血再灌注损伤(I/R)组、缺血再灌注损伤组+七氟醚(I/R+Sev)组、缺血再灌注损伤组+七氟醚组+EX527(I/R+Sev+EX527)组。所有实验动物已获得我院伦理委员会批准。
1.2.2构建大鼠脑缺血再灌注损伤模型:使用戊巴比妥钠(40mg/kg)腹腔注射麻醉大鼠,正中切口暴露右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。将单丝尼龙缝线从右侧CCA插入ICA,距Willis环约18~20mm,以阻断右侧大脑中动脉血流。MCAO诱导脑缺血90min后,缓慢拉出缝线,再灌注24h。整个手术过程中,大鼠直肠温度保持在37℃。将大鼠置于室温环境下,术后恢复正常饮食。Sham组仅分离动脉,但无栓动脉闭塞。I/R+Sev组大鼠再灌注后立即吸入2%七氟醚15min。I/R+Sev+EX527组大鼠在再灌注后立即吸入2%七氟醚15min和腹腔注射EX527(5mg/kg)。当大鼠吸入七氟醚时,将其放入呼吸箱内,入口孔通入含七氟醚的空气,将麻醉气体分析仪连接在出口孔处监测气体浓度,使七氟醚浓度调节为2%。所有大鼠均可保持自主呼吸。
1.2.3莫里斯水迷宫试验(Morris):Morris水迷宫由一个圆形水箱组成,水温保持在24±2℃。将一个黑色目标平台固定在东南象限中部水面以下2cm处,确保该平台对大鼠不可见。将大鼠从随机的位置放入水中自由游泳以寻找隐藏的平台,记录大鼠寻找平台的时间为逃避潜伏期。如果大鼠在120s内找不到平台,由研究将大鼠放置在平台上30s,记录逃逸潜伏期为120s。每只大鼠每天测试4次,每次间隔15~20min,连续5d。在第6天,撤除上述隐藏平台,将大鼠从第一象限放入水中,观察并记录大鼠在90s内穿越原始平台次数。
1.2.42,3,5-三苯基氯化四氮唑(TTC)染色:将大鼠麻醉后,快速解剖取脑,然后将其放入-20℃的冰箱中20min。将每个大脑切成6个连续2mm厚度的切片,立即浸入0.2% TTC溶液中,在37℃下避光染色30min,并置于含有4%多聚甲醛的溶液中24h。正常脑组织被染成红色,梗塞组织被染成白色。在显微镜下拍照,并使用Image J计算梗死面积。
1.2.5TUNEL染色:脑组织在4%甲醛溶液中室温固定24h,随后进行石蜡包埋,制作5μm厚度的组织切片。随后对切片进行二甲苯脱蜡,梯度酒精水合。根据TUNEL染色试剂盒说明书进行染色,最后在光镜下随机选取5个视野进行观察。正常细胞核呈蓝色,凋亡阳性细胞核呈棕黄色。
1.2.6电镜观察自噬体空泡形成:将固定在2.5%戊二醛溶液中的大脑皮质组织在PBS中漂洗,并在室温下用1%柠檬酸固定1h。用分级丙酮系列脱水后,在室温下用Pon812环氧树脂包埋12h,将大脑皮质组织切成1μm的切片。切片在室温下用乙酸铀酰染色30min,用双蒸水冲洗。然后,切片在室温下用柠檬酸铅染色10min,用双蒸水冲洗。通过电子显微镜观察自噬体中液泡的形成。室温下采用盲法统计自噬体数量,每个样本选取5个区域进行统计分析。
1.2.7Western blotting检测自噬和凋亡相关蛋白:使用RIPA裂解缓冲液从周围皮质组织中提取总蛋白。使用BCA蛋白定量试剂盒测定蛋白质浓度。蛋白质印迹分析通过10~12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离。从每个样品中取等量的总蛋白30g加入到凝胶中进行电泳。随后,将蛋白质转移到聚偏二氟乙烯(PVDF)膜上1.5h。接着在室温下用5%脱脂牛奶封闭膜1h,然后与一抗4℃过夜孵育。PVDF膜在TBST中洗涤3次,每次10min,然后与辣根过氧化物酶结合的山羊抗兔二抗(1∶3000)在室温下孵育1h,TBST洗涤3次。根据制造商的说明,使用增强化学发光试剂显示蛋白质条带,以β-actin作为内部对照,采用Image J软件对蛋白条带进行分析。
1.2.8统计学分析:采用SPSS21.0统计学软件对数据进行分析。所有数据均以平均数±标准差表示。多组之间比较分析采用单因素方差分析和LSD检验。P<0.05被认为具有显著性差异。
2 结 果
2.1七氟醚对脑缺血再灌注损伤小鼠神经功能的影响:Morris水迷宫实验结果显示,与Sham组比较,I/R组大鼠逃避潜伏期延长,穿越平台次数减少;与I/R组比较,I/R+Sev组大鼠逃避潜伏期减少,穿越平台次数增多;与I/R+Sev组比较,I/R+Sev+EX527组大鼠逃避潜伏期延长,穿越平台次数减少,差异均有统计学意义(P<0.05),见图1。
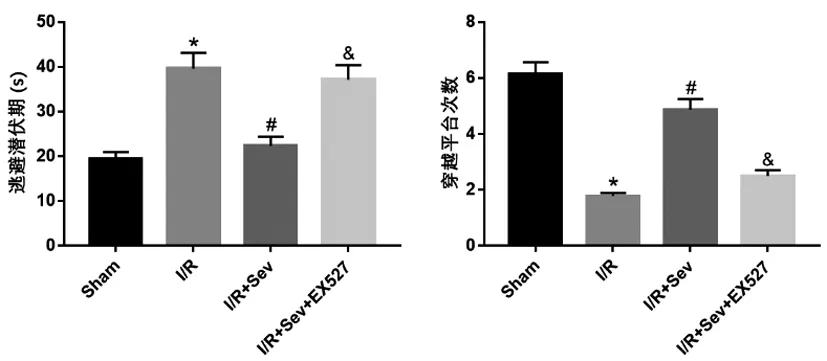
图1 七氟醚对脑缺血再灌注损伤小鼠神经功能的影响
2.2七氟醚处理后对脑梗死体积的影响:TTC染色结果显示,Sham组大鼠脑组织没有白色梗死灶,与Sham组比较,I/R组大鼠脑梗死体积显著增加;与I/R组比较,I/R+Sev组大鼠脑梗死体积减少;与I/R+Sev组比较,I/R+Sev+EX527组大鼠脑梗死体积增加,差异均有统计学意义(P<0.05),见图2。
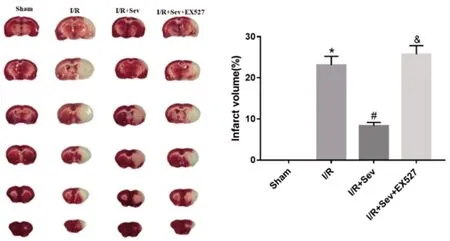
图2 七氟醚处理后对脑梗死面积的影响
2.3七氟醚处理后对神经细胞凋亡的影响:TUNEL染色结果显示,与Sham组比较,I/R组神经细胞凋亡率显著升高;与I/R组比较,I/R+Sev组神经细胞凋亡率降低;与I/R+Sev组比较,I/R+Sev+EX527组神经细胞凋亡率升高,差异均有统计学意义(P<0.05),见图3-1、图3-2。
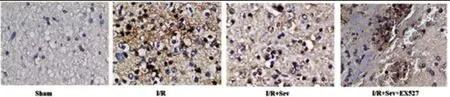
图3-1 七氟醚处理后对神经细胞凋亡的影响
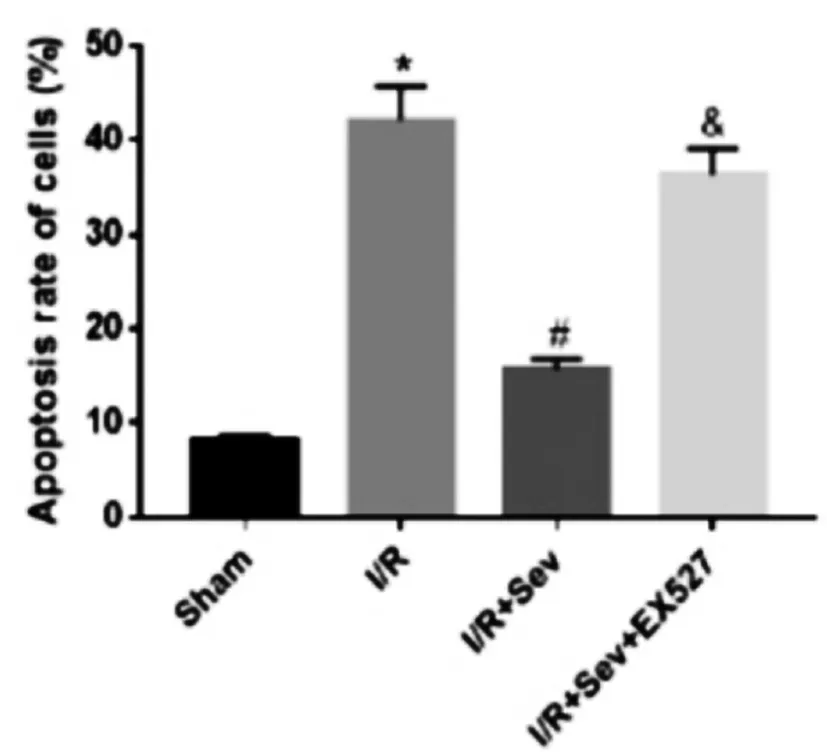
图3-2 七氟醚处理后对神经细胞凋亡的影响
2.4七氟醚处理后对自噬的影响:透射电镜结果显示,与Sham组比较,I/R组自噬空泡数量明显增加;与I/R组比较,I/R+Sev组自噬空泡数量显著减少;与I/R+Sev组比较,I/R+Sev+EX527组自噬空泡数量增多,差异均有统计学意义(P<0.05),见图4。
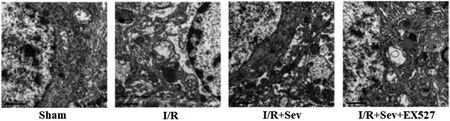
图4 七氟醚处理后对自噬的影响
2.5七氟醚处理后对自噬和凋亡相关蛋白表达的影响:Western blotting结果显示,与Sham组比较,I/R组的Bad,cleaved caspase-3,Beclin-1,LC3-Ⅱ/Ⅰ蛋白表达显著升高,Bcl-2蛋白表达显著降低;与I/R组比较,I/R+Sev组的Bad,cleaved caspase-3,LC3-Ⅱ/Ⅰ蛋白表达显著降低,Bcl-2、p62蛋白表达显著升高;与I/R+Sev组比较,I/R+Sev+EX527组的Bad,cleaved-caspase-3,LC3-Ⅱ/Ⅰ蛋白表达显著升高,p62、Bcl-2蛋白表达显著降低,差异均有统计学意义(P<0.05),见图5。
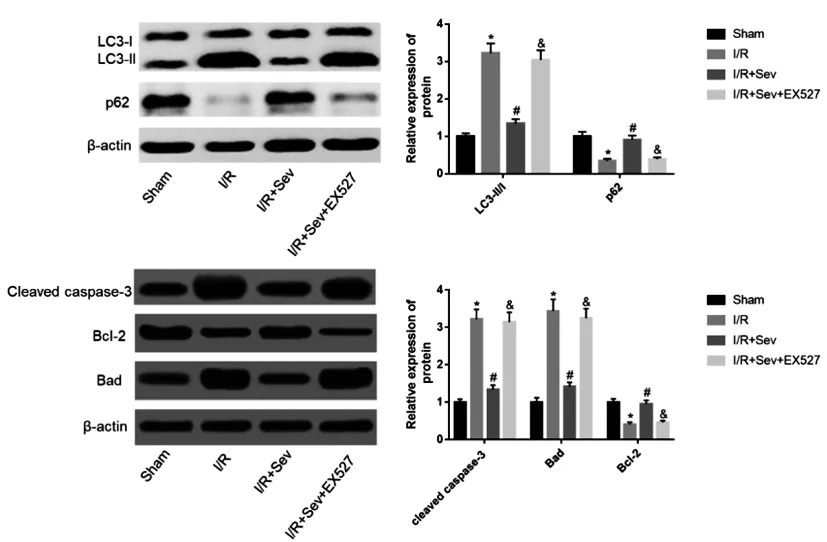
图5 七氟醚处理后对自噬和凋亡相关蛋白表达的影响
2.6七氟醚处理后对SIRT1-FOXO1信号通路相关蛋白表达的影响:Western blotting结果显示,与Sham组比较,I/R组的SIRT1、FOXO1蛋白表达显著降低;与I/R组比较,I/R+Sev组的SIRT1、FOXO1蛋白表达显著升高;与I/R+Sev组比较,I/R+Sev+EX527组的SIRT1、FOXO1蛋白表达显著降低,差异均有统计学意义(P<0.05),见图6。
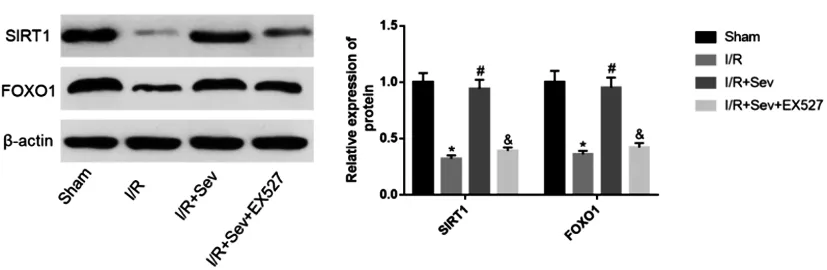
图6 七氟醚处理后对SIRT1-FOXO1信号通路相关蛋白表达的影响
3 讨 论
七氟醚是一种理想的神经外科麻醉药,具有血气分布系数低、苏醒诱导快、脑氧代谢率降低的特点。七氟醚后处理可抑制脑组织的过度氧化应激和炎症反应,减轻脑I/R损伤的严重程度。此外,七氟醚通过调控PI3K-AKT-mTOR信号通路,可降低神经元凋亡,抑制自噬,减轻脑I/R损伤。在本研究中,Morris水迷宫实验和TCC染色证实了七氟醚减轻神经功能缺损,并显著减少脑梗死体积,提示七氟醚在大鼠MCAO后再灌注期发挥神经保护作用。
脑I/R损伤是缺血性脑血管病溶栓治疗过程中加重的继发性损伤,主要涉及能量代谢紊乱、炎症介质释放、自由基损伤、兴奋性氨基酸释放、诱导凋亡。细胞凋亡是细胞程序性死亡的一种形式,是由基因调控的一种活跃的细胞死亡过程。在脑I/R损伤中,大量脑组织凋亡直接导致神经功能损害。抑制脑I/R损伤后caspase依赖的细胞凋亡可减少皮质组织损伤,促进神经修复,从而改善患者预后。在本研究中,TUNEL实验结果表明,七氟醚可通过抑制脑I/R损伤诱导的神经元凋亡来保护神经元,且七氟醚降低了促凋亡因子caspase-3和Bax的表达,并上调了抗凋亡因子Bcl-2的表达,从而改善神经功能。
自噬是一种在所有真核生物中高度保守的细胞降解和循环过程。动物实验研究表明,自噬在脑I/R损伤后的中枢神经系统,特别是神经元中起着双刃剑作用。在再灌注的最初几小时,自噬通过溶酶体系统降解受损的细胞器和错误折叠的蛋白质,在脑I/R损伤中发挥保护作用。在再灌注后期,过度的自噬会过度降解具有正常功能的细胞器和蛋白质,最终导致自噬细胞死亡和细胞组织的继发性损伤。已发表的数据显示,脑I/R损伤后通过激活自噬相关蛋白LC3诱导自噬体的形成[5]。自噬体是一种含有受损细胞器或蛋白质的双膜囊泡。自噬体与溶酶体融合后,进化为自噬溶酶体,即具有单层膜的囊泡。LC3诱导前自噬体结构的形成,促进自噬液泡的形成,使其成为自噬的标志物。已证实LC3以两种形式存在,即LC3I(可溶性形式)和LC3-Ⅱ(膜结合形式),并且LC3-Ⅱ富集于囊泡膜上,促进成熟自噬体的形成。此外,LC3-Ⅱ还通过与p62的C端结合参与自噬的降解。本研究表明,七氟醚处理后,自噬空泡的形成减少。此外,自噬相关蛋白LC3-Ⅱ的表达受到抑制,而p62蛋白水平升高,提示七氟醚的神经保护作用与抑制神经元自噬有关。
沉默信息调节因子1(SIRT1)是一种NAD依赖性脱乙酰酶,能够通过脱乙酰化组蛋白调节炎症反应、氧化应激、凋亡和自噬。之前研究表明,使用一种SIRT1抑制剂EX527对脑I/R损伤进行预处理,可以消除SIRT1的脑保护作用[6]。FOXO1是SIRT1的下游靶标,有报道称,FOXO1在维持自噬降解活性和发育中神经元的形态成熟方面起着至关重要的作用。研究表明,NAD+依赖性蛋白去乙酰化酶SIRT1在抑制自噬和抑制细胞凋亡以及FOXO1通路的下游信号传导中起关键作用[7]。在本研究中,七氟醚处理上调了SIRT1/FOXO1信号通路的活性,而EX527处理时,神经细胞凋亡和自噬水平增加。以上结果提示,SIRT1/FOXO1信号通路可能与七氟醚对海马神经元的抗凋亡能力和抑制自噬有关。
综上所述,本研究表明七氟醚可能通过抑制自噬对脑I/R损伤有神经保护作用,其机制与SIRT1/FOXO1信号通路有关。以上结果进一步揭示了七氟醚发挥神经保护作用的机制,并提示七氟醚治疗脑I/R损伤可能是一种潜在的治疗策略。

