肌肽对血管平滑肌细胞钙化的影响及机制研究
金朝霞, 徐成胜
(长江大学附属黄冈市中心医院心内科, 湖北 黄冈 438000)
血管钙化(vascular calcification)是慢性肾病和慢性心血管疾病共同的显著病理改变,也是这类疾病的致病基础之一。羟基磷灰石(又称羟磷灰石、碱式磷酸钙异位沉积于血管壁为其病理特征[1]。血管钙化是密切相关于心血管疾病发病率和死亡率增高的危险因素,发病于80%的血管损伤患者和90%的冠状动脉患者中[2]。血管平滑肌细胞(vascular smooth muscle cell,VSMCs)在生长因子、机械应激损伤下,从正常的收缩表型向成骨和软骨表型的分化在血管钙化中发挥关键作用[3]。由于血管钙化机制尚未明确,目前有关预防和治疗血管钙化的药物或方法未得到批准,研发和临床的血管钙化防治目标仍面临长期的探索。肌肽(β-丙酰胺-L-组氨酸)是一种内源性二肽,在体内发挥多种生物效应,包括抗炎、抗氧化、抗糖基化、螯合金属离子、促进伤口愈合等,而炎症、氧化应激、糖基化等病理过程都是血管钙化发生发展的诱导因素。然而,肌肽在血管内的生理角色尚不清楚,以及肌肽能否抑制血管钙化。本研究基于血管平滑肌细胞在体外由高磷诱导成骨向分化为基础,研究肌肽对血管钙化的影响。
1 资料与方法
1.1试剂与仪器:试剂:β-磷酸甘油(G9422)和肌肽(C9625)均购于Sigma;α-SMA抗体(博士德 BM0002);β-catenin(51067-2-AP)、BMP-2(18933-1-AP)和Runx2(20700-1-AP)均购于Proteintech;GSK3β(Phospho-Ser9)购于Signalway(货号11002-1);β-actin(Santa Cruz sc-47778);小鼠 IgM-SABC 免疫组化染色试剂盒(博士德 SA1026);碱性磷酸酶试剂盒(南京凯基);茜素红S(Sigma,A5533);BCA定量试剂盒(武汉启动子);Ⅱ型胶原酶和弹力蛋白酶均购于美国Worthington Biochemical Corporation;灭菌PBS、链霉素/青霉素、胎牛血清、DMEM均购于Hyclone公司。仪器:倒置显微镜(重庆光电仪器有限公司 XDS-1B);超净工作台(苏州安泰空气技术有限公司);CO2细胞培养箱(力新仪器有限公司 HF151UV);Sunrise A5082酶标仪(奥地利Tecan公司);NanoDrop ND-2000超微量核酸蛋白测定仪(德国Thermo 公司);Mini-PROTEAN Tetra Electrophoresis System电泳转膜系统和Power Pac Universal电泳仪均来自美国Bio-rad公司。
1.2实验动物:SPF级Wistar大鼠,6周龄,80~100克体重,购于华中科技大学同济医学院实验动物中心,动物使用符合伦理学标准。
1.3原代VSMCs分离培养和鉴定:注射1mL 3%的戊巴比妥用以麻醉大鼠,75%酒精清洁大鼠腹部后,剪开胸腔,小心剪下大鼠胸主动脉。无菌操作下,放入灭菌PBS中冲洗血污,在体式显微镜下小心去除周边脂肪和结缔组织,放置于1mg/mL Ⅱ型胶原酶中,37℃消化30 min后小心剥离血管外膜;然后用弯镊背侧小心刮去血管内膜,最终获得中层组织;将该组织用含10X双抗的灭菌PBS冲洗三次后,放置于含20%FBS的DMEM高糖培养液中,过夜孵育。次日,将中层组织剪成1mm3大小的组织块,加入消化液(1mg/mL Ⅱ型胶原酶、0.5mg/mL 弹力蛋白酶)酶解90min,每隔15min无菌吹打以利于细胞脱离;结束后加入等体积含20%FBS的DMEM高糖培养液,转移到15mL离心管中,800rpm离心10 min,细胞沉淀用含20%FBS的DMEM高糖培养液重悬后接种于T25培养瓶中,置于37℃,5% CO2细胞培养箱中。每隔3d换液,直至细胞长满瓶壁,常规传代,取3~6代细胞用于实验。
1.4VSMCs的平滑肌细胞鉴定:取第3代VSMCs接种于6cm培养皿中,待细胞长至80%左右密度,弃去培养基,PBS冲洗一遍后用4%多聚甲醛固定细胞,PBST冲洗三遍;经5% BSA室温封闭20min后,经抗α-SMA一抗(1∶200)4℃杂交过夜,PBST冲洗三遍后同生物素化山羊抗小鼠IgM室温杂交20min;最后用DAB显色。显微镜下随机选择5个视野,计数染色阳性的细胞数量和总数量,计算阳性率。
1.5实验分组及处理方法:取第3代VSMCs,按照1×105/孔接种于6孔板,待细胞贴壁后,更换为新鲜的培养液,并分为3组:对照组(无添加)、钙化组(10mM β-磷酸甘油诱导)、肌肽组(10mM β-磷酸甘油诱导和10mM 肌肽干预)。所有细胞均培养于含15%FBS的高糖DMEM培养液中,置于37℃,5% CO2细胞培养箱,每隔2d换液,连续10d。
1.6茜素红S染色:待钙化诱导和肌肽干预10d后,弃细胞上清,4%多聚甲醛固定,超纯水清洗2次后,加1%茜素红染液(pH4.1)室温染色10min。
1.7碱性磷酸酶活性测定:处理10d后,采用组织裂解液裂解细胞,取上清进行测定。按照说明书依次加入显色底物、显色剂,在酶标仪520nm处测定各组吸光值。
1.8Western blot:加入组织裂解液裂解各组细胞,提取总蛋白,用BCA定量试剂盒检测蛋白浓度,用以计算上样所需体积;用10%聚丙烯酰胺凝胶(SDS-PAGE)行蛋白电泳,主要参数为:恒压80V,溴酚蓝条带进入下层胶时恒压120V,蛋白Marker所需分子量处充分分开后,停止电泳;然后将蛋白转移至PVDF膜,200mA恒流转膜2h;经含5%脱脂奶粉的TBST封闭1h后,用一抗4℃杂交过夜,TBST清洗三遍后,放于二抗溶液中,室温孵育2h;TBST清洗三遍后,最后用ECL显影、定影。
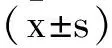
2 结 果
2.1原代大鼠VSMCs的生长状态和鉴定:由图1a所示,可见来源于大鼠胸主动脉的VSMCs经传代培养后,大部分形态为梭形的贴壁细胞。低密度接种后,细胞成簇状生长,中心区域细胞多层叠加生长,并有平滑肌细胞特有的“峰—谷”样生长特征(图1b)。用抗α-SMA抗体对第3代VSMCs进行平滑肌特征鉴定,免疫组化检测发现,细胞胞浆内有棕褐色染色颗粒,证明培养细胞为VSMCs,经显微镜下计数后证实,99%的细胞均为VSMCs,基本没有内膜内皮细胞和外膜成纤维细胞的污染(图2)。
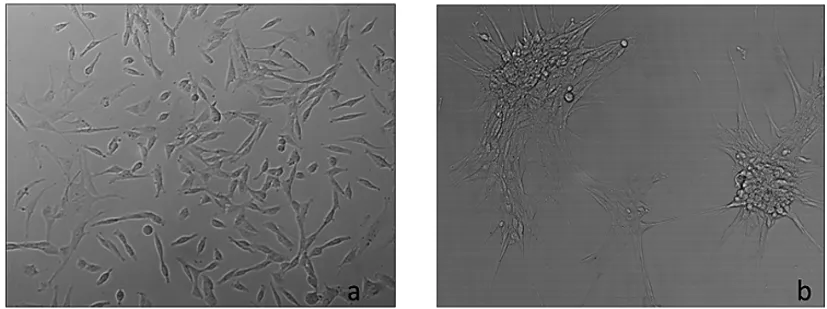
图1 光镜下VSMCs细胞形态
图2 免疫组化检测VSMCs细胞的α-SMA表达
2.2肌肽下调抑制VSMCs的成骨分化:茜素红染料可特异性的与钙发生显色反应,生成红色产物。经β-磷酸甘油的10d诱导,可见对照组VSMCs培养孔内无红色染色,为阴性反应(图3a);钙化组培养孔内呈显著阳性反应,细胞外弥漫着红色的钙沉积,说明VSMCs钙化模型成功建立(图3b);10mM肌肽干预组VSMCs的染色强度明显下调,仅可见少量的钙盐沉积(图3c)。
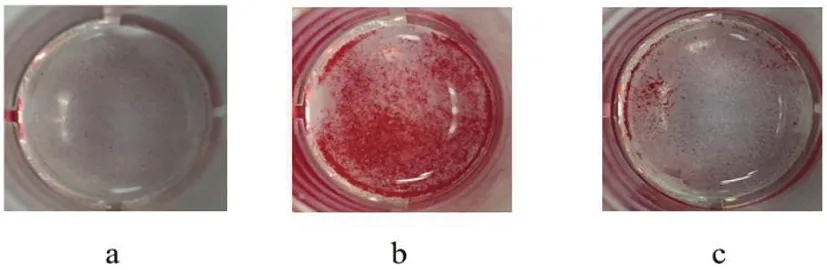
图3 茜素红染色检测各实验组的钙盐沉积
2.3肌肽对ALP活性的时间效应:如图4所示,各组ALP活性均随培养时间推移而上调,其中钙化组在β-磷酸甘油诱导下,ALP活性水平上调更加明显,在第8~10天之间,活性显著高于对照组(P<0.05);10mM肌肽干预后,同钙化组相比较,第4~8天时,ALP活性水平下调,但无显著统计学差异(P>0.05),第10天时,肌肽组ALP活性显著低于钙化组,差异有统计学意义(P<0.05)。
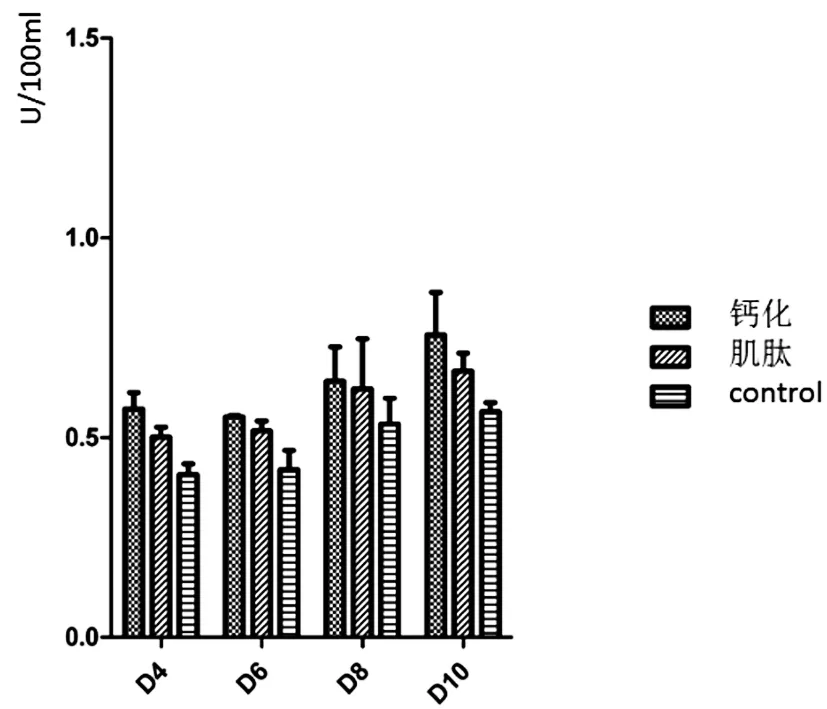
图4 生化实验检测培养不同时间各实验组的ALP活性
2.4肌肽对钙化VSMCs成骨细胞标志物表达的影响:与钙化组相比较,10mM肌肽干预后,BMP-2和Runx2的蛋白表达均显著下调,差异有统计学意义(P<0.05),提示肌肽可能在VSMCs向成骨细胞分化过程的后期发挥抑制作用(图5)。
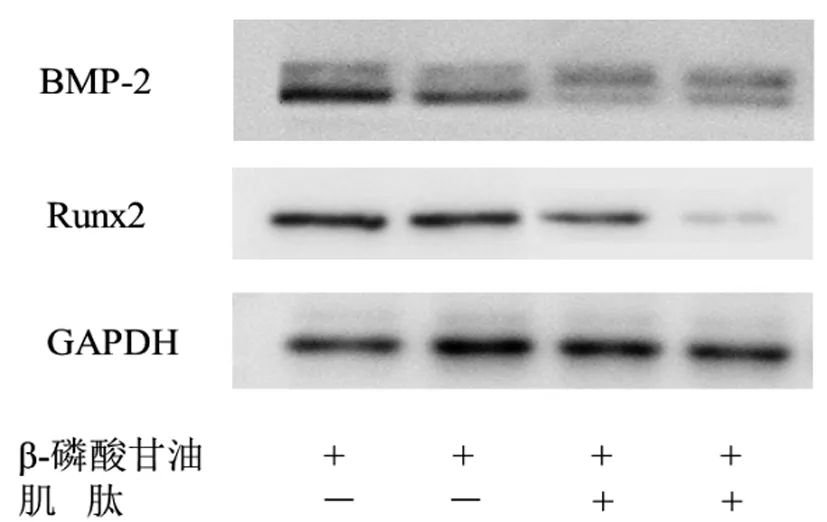
图5 Western blot检测各实验组BMP-2和Runx2的表达情况
2.5肌肽对VSMCs钙化进程中细胞凋亡的影响:Cleaved-caspase3是凋亡因子caspase3的激活状态,如图6所示,钙化组Cleaved-caspase3水平较对照组上调,差异有统计学意义(P<0.05),肌肽组Cleaved-caspase3水平下调,与对照组水平接近,低于钙化组蛋白水平,差异有统计学意义(P<0.05)。
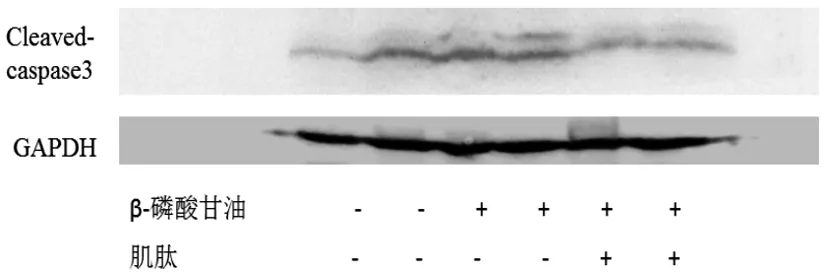
图6 Western blot检测各实验组Cleaved-caspase3的表达情况
2.6肌肽对VSMCs钙化进程中β-catenin信号通路的影响:如图7所示,与对照组相比较,钙化组GSK-3β(Ser9)表达下降,β-catenin水平显著上调(P<0.05);与钙化组相比较,肌肽组GSK-3β(Ser9)蛋白水平显著上调,β-catenin水平下调(P<0.05),差异有统计学意义(P<0.05)。
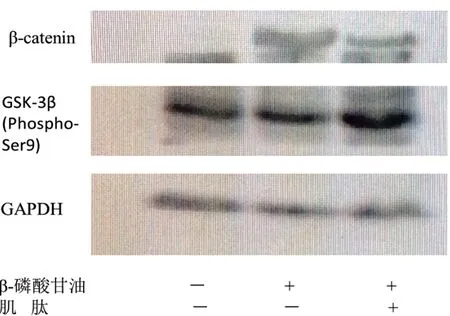
图7 Western blot检测各实验组GSK-3β(Ser9)和β-catenin的表达情况
3 讨 论
研究表明机体钙磷代谢失衡原因造成的钙盐沉积结果是血管钙化的主要病理表现,是机体冠状动脉钙化重要原因之一[4]。碱性磷酸酶由成骨细胞生成和分泌,是标志成骨细胞特异性成熟的标志物,而骨形态发生蛋白-2(Bone morphogenetic protein-2,BMP-2)和Runt相关转录因子2(Runt-related transcription factor-2,Runx2)是成骨分化过程重要标志蛋白,具有促进成骨细胞分化为骨细胞的作用,同时,二者还可以上调ALP表达[5,6]。β-磷酸甘油在细胞内碱性磷酸酶的作用下转变为无机磷酸盐,是平滑肌细胞钙化的主要诱因[7]。细胞凋亡在VSMCs的钙化进程中居于初始阶段的关键地位,而caspase 3是细胞凋亡的特异性标志物之一,在凋亡进程中居于核心地位,是一切凋亡信号传导的最终共同通路。Wnt信号通路可影响内皮细胞增殖、分化、迁移,调节血管的生成发育,与血管钙化密切相关[8]。
本研究发现,钙化组的红色钙沉积明显,呈显著阳性反应,在β-磷酸甘油刺激的4~10d内,钙化组的碱性磷酸酶活性水平随时间延长稳步升高,且均高于同期无处理对照组(P<0.05),表明血管平滑肌发生钙化,而经肌肽处理后,钙沉积明显减少,碱性磷酸酶活性下调,提示。同时钙化组BMP-2、Runx2水平显著上升,肌肽干预后显著降低(p<0.05),提示肌肽负调控高磷诱导的VSMCs体外骨向分化。钙化组cleaved-caspase 3(caspase 3活化形式)蛋白水平上调,肌肽干预显著下调cleaved-caspase 3的蛋白表达,提示肌肽下调的VSMCs凋亡可能参与了该细胞的成骨向表型转化。肌肽组GSK-3β(Ser9)蛋白水平显著上调,β-catenin水平下调(P<0.05),差异有统计学意义(P<0.05),提示肌肽抑制了Wnt信号通路。Ommati[9]等研究发现异环磷酰胺腹腔注射大鼠后,尿内碱性磷酸酶水平升高,500mg/kg肌肽的干预可显著下调过量激发的ALP,与本研究结果相似。这表明肌肽可体外抑制大鼠血管平滑肌钙化进程,在血管钙化过程中发挥重要作用,其机制可能是通过抑制细胞凋亡、成骨分化及Wnt信号通路。
综上所述,肌肽具有抑制VSMCs钙化的保护作用,表现为通过上调GSK3β磷酸化,抑制β-catenin信号通路,进而降低骨向分化标志物蛋白表达,下调碱性磷酸酶活性和成骨细胞成熟、减少钙沉积,同时可减少VSMCs的细胞凋亡水平。本研究为深入探讨VSMCs钙化及成骨向表型转化的分子机制提供了实验依据,并扩展了肌肽的新的生物效应,为其临床应用提供新的支持。

