人肝门部胆管癌细胞QBC939中Vimentin基因的siRNA构建研究
王 磊,贾剑超,宋双龙,戚晓辉,胡向赟,王 石
(1.内蒙古医科大学研究生学院,内蒙古 呼和浩特010110;2.内蒙古自治区人民医院 a.临床医学研究中心;b.肝胆胰脾外科,内蒙古 呼和浩特010110)
肝门部胆管癌(HCC)是最常见的胆道恶性肿瘤[1]。由于HCC解剖位置特殊导致手术难度较高且患者术后5年生存率仅为30%-40%[2]。波形蛋白(Vimentin,VIM)属于Ⅲ型中间丝(IF)蛋白的一种类型[3]。最初观察到VIM主要在增殖细胞和未分化细胞中表达,目前许多研究共同表明VIM在肺癌、乳腺癌、前列腺癌及胃癌的发生及发展过程中有重要的作用[4]。干扰短RNA(siRNA)的特异性及稳定性较好,目前被广泛应用于沉默特定靶基因表达的相关实验中[5]。本实验拟构建可抑制Vimentin基因表达的作用于不同位点的3种siRNA,并通过脂质体法将siRNA分别瞬时转染进入QBC939细胞,从而对抑制细胞内VIM基因的表达,为后续进一步研究VIM的生物学特性及探讨对肿瘤增殖、侵袭、迁移及凋亡的影响奠定了基础。
1 材料及方法
1.1 实验材料
1.1.1细胞 人肝门部胆管癌细胞QBC939(BFB公司),已采用短串联重复(STR) DNA检测并成功鉴定。
1.1.2试剂 胎牛血清及DMEM培养基均为BI公司生产;PBS、DMSO及青霉素-链霉素双抗购自碧云天;SiRNA序列(S1序列、S2序列及S3序列)及阴性对照序列由吉玛基因设计及合成(表1);VIM、GAPDH引物序列由生工生物公司设计及合成;逆转录试剂盒、实时荧光定量试剂盒(TaKaRa);乙醇及异丙醇(富宇试剂)。

表1 siRNA核酸序列
1.2 细胞培养
QBC939细胞株的培养使用含10%胎牛血清及1%青霉素-链霉素双抗的高糖DMEM培养基,置于恒温培养箱(37℃,5% CO2)中培养,当细胞融合度在85%左右时对QBC939细胞进行一次传代,并冻存一定量的细胞备用。
1.3 转染
将转染3种siRNA及阴性对照序列的四组分别命名为T1组(siVIM-1)、T2组(siVIM-2)、T3组(siVIM-3)及NC组(siCtrl)。首先溶解siRNA,根据说明书6孔板中siRNA的推荐量100 pmol,siRNA优化范围50-200 pmol,培养基最终体积为2 ml进行预实验,摸索siRNA的最佳转染浓度为100 pmol。配置Opti-MEM与siRNA的混合物即mix①,配置Opti-MEM与RNAi MAX的混合物即mix②,将mix②加入mix①中并室温孵育5 min,使用移液枪以300 μl/孔分别加入至6孔板中,6 h后更换完全培养基继续培养。
1.4 转染后提取总RNA制备cDNA
转染24小时后,根据实验情况收集细胞,向装有细胞的离心管内加Trizol裂解细胞,加入氯仿静置5 min。离心机设置为:4℃;13 000 rmp;15 min,离心后取上清,将上清转移至EP管中并加入异丙醇,室温静置10 min,离心(4℃;13 000 rmp;10 min),取出离心管并将上清弃去后加75%乙醇,在4℃,7 500 rmp,离心5 min,弃上清,晾干,测RNA浓度。取1 000 ng RNA,配置40 μl反应体系,按照Takara反转录两步法进行RT-PCR来制备cDNA。
1.5 荧光实时定量PCR检测QBC939细胞中VIM的mRNA表达水平
实验所需VIM、GAPDH引物序列如下:VIM引物序列正义链:5′-TCGTGAATACCAAGACCTGCTCAATG-3′,反义链:5′-AATCCTGCTCTCCTCGCCTTCC-3′,碱基数分别为26、22。GAPDH引物序列正义链:5′-CAGATGTGGATCAGCAAG-CAGGAG-3′,反义链:5′-GTCAAGAAAGGGTGT-AACGCAACTAAG-3′,碱基数分别为24、27。PCR的反应体系为:TB Green Premix Ex TaqⅡ 12.5 μl;PCR Forward Primer 1 μl;PCR Reverse Primer 1 μl;灭菌水8.5 μl;除此反应体系,还需准备DNA模板2 μl。依次加入DNA模板及上述反应体系并混匀。扩增条件:95℃,30 min;95℃,5 s,60℃,30 s,40个循环;95℃,10 min;65℃,5 min;95℃,5 min。
1.6 统计学处理

2 结果
2.1 细胞形态学观察
使用Leica荧光显微镜系统观察到培养皿内QBC939细胞贴壁生长,各细胞间排列紧密。转染siRNA前后的细胞生长状态如图1及图2所示。
2.2 siRNA对QBC939细胞中VIM的mRNA表达水平的影响
在使用siRNA对QBC939细胞干扰48 h后,分别提取实验组、NC组细胞中的mRNA,结果显示:实验组VIM的表达水平较均NC组显著降低;此外,实验组中T2组的抑制效果较T1及T3组更明显,差异有统计学意义。见图3。
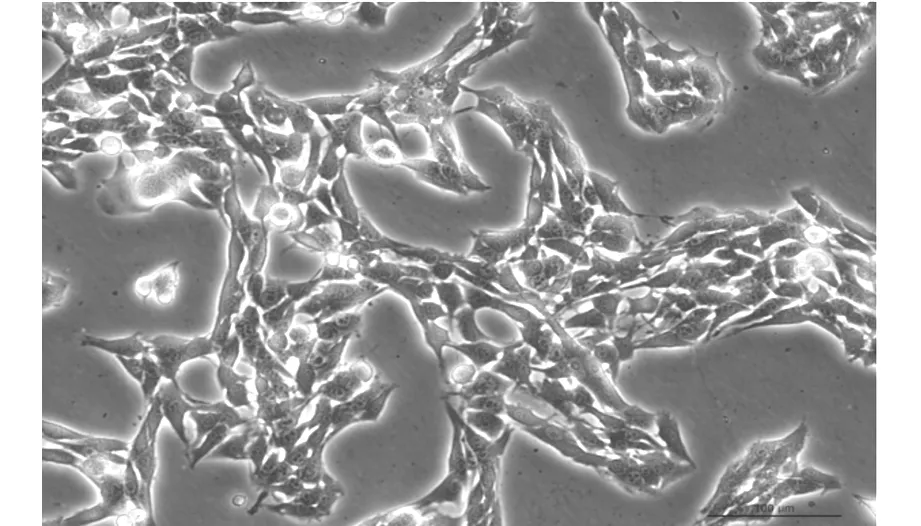
图1 光镜下(20×)QBC939生长状态
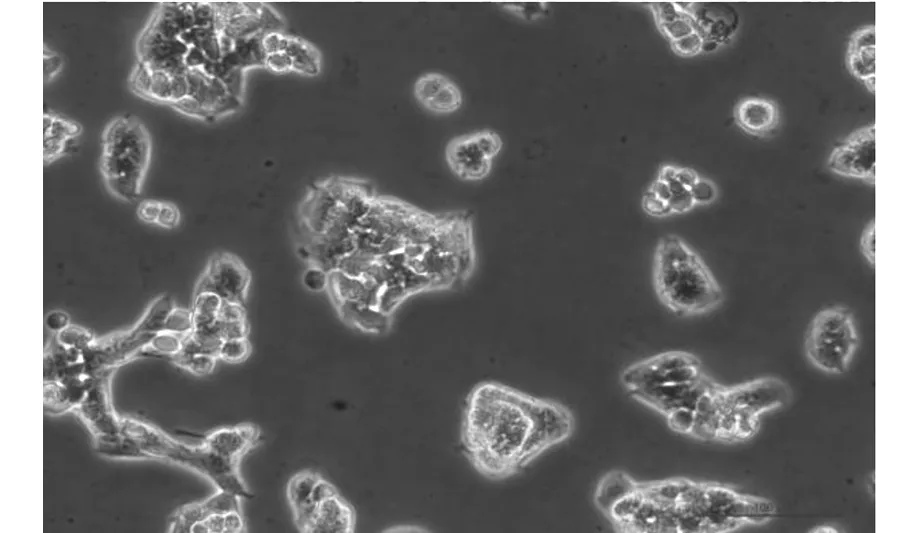
图2 光镜下(20×)转染siRNA 24 h后QBC939细胞生长状态

图3 VIM的mRNA表达量
3 讨论
VIM是一种分子量大小为57 kDa蛋白,在哺乳动物中,VIM是表达最广泛的IF之一,在人体脑、肺、肾、肝、胰腺、胃肠道等多种细胞表面表达[6]。在细胞水平上,VIM与细胞分化、黏附、迁移、侵袭及凋亡等多种生物学特性密切相关[7],使癌细胞具有更强的侵袭及转移能力[3]。在器官水平上,VIM敲除的细胞功能与伤口愈合能力下降、动脉及血管活动有关。在机体水平上,VIM敲除与白内障、多动、平衡和(或)协调受损、焦虑相关反应增加有关[4]。
VIM在多种上皮性肿瘤中呈现为过表达状态[8]。VIM可作为胰腺癌、胃癌预后、结肠癌及黑色素瘤的潜在生物学标志物[9-11]。本研究前期通过对内蒙古自治区人民医院肝胆胰脾外科收治的60例已行手术治疗的HCC患者的病理切片进行免疫组化研究,结果表明:VIM在癌组织中的表达水平高于癌旁组织[12]。使用RT-PCR及Q-PCR等技术对人肝门部胆管癌QBC939细胞及正常的胆管细胞HiBepic的mRNA表达情况进行分析,结果表明:QBC939细胞内VIM表达水高于HiBepic细胞内VIM表达水平,考虑抑制QBC939中VIM基因的表达水平可能为HCC的诊断及HCC的治疗带来新的帮助。
RNA干扰(RNA Interference,RNAi)又称基因沉默(gene silencing),是在某些疾病中阻止基因表达的一种生物学过程[13]。siRNA是RNAi过程中的重要产物[14],也是一种双链非编码RNA(non-coding RNA,ncRNA)[15]。siRNA被装载在RNA诱导沉默复合体上用于在基因翻译以前降解和切割mRNA[16]。siRNA因具有高度的特异性及级联放大等特点而被广泛应用于临床治疗及基因组学相关实验的研究。siRNA在临床给药中主要应用偶联介导以保证siRNA的化学稳定性,因为未经修饰的siRNA会被肾脏过滤快速降解并从循环中清除,导致组织中的生物利用度极低[17]。siRNA以各种细胞类型中的致病基因为靶点,在不破坏内源性miRNA的情况下实现对目的基因的沉默。siRNA具有高度序列特异性及治疗靶点上的广谱性,目前已被广泛应用于基因组学相关实验[18]。
siRNA的临床治疗及基因组学的实验应用中同时也受到siRNA本身固有的理化特性的严重阻碍,例如低电荷密度、高结构刚度和快速酶降解。且部分基因mRNA靶序列常包埋在RNA分子的二级结构及高度折叠的区域中,且siRNA无法接近并识别靶序列,因此无法切割mRNA。此外,当靶基因发生基因突变时而产生新的siRNA时,也会影响siRNA抑制靶基因的效率。因此常规的siRNA中,可发挥沉默效应的siRNA仅有60%-70%[19]。建立高效、稳定的siRNA既是将其用于基因组学相关实验的必要前提,又是用于临床治疗的坚实基础,本实验在设计与合成siRNA时应注意RNA内的修饰位置与修饰的化学类型,以防止siRNA沉默效应受到干扰及脱靶效应的发生[20]。因此本实验根据前期VIM在肝门部胆管癌细胞株QBC939中表达较高的研究基础,设计并合成三条VIM-siRNA序列及一条阴性对照序列,分别命名为S1、S2、S3及siRNA阴性对照序列,将三条序列及阴性对照序列分别用脂质体法瞬时转染进入QBC939细胞中,根据RT-PCR及Western-Blot实验结果可知:3组siRNA均已经成功转入细胞内且成功抑制QBC939细胞内VIM的表达。但是三条VIM-siRNA序列沉默效果不一,S2的沉默效果较S1及S3好,差异具有统计学意义。再次表明此类实验仅设计合成单条VIM-siRNA可能存在一定的局限性。后续本团队将继续探讨并研究抑制VIM对QBC939细胞株增殖、侵袭及迁移中的影响及在成瘤裸鼠体内中的作用,从体内及体外等实验综合研究VIM与QBC939细胞的生物学行为间关系。
致谢:本文作者感谢内蒙古自治区人民医院临床医学研究中心提供的实验平台及临床医学研究中心王敏老师在相关实验操作上的指导。

