DEB-TACE联合MWA及阿帕替尼治疗巨块型肝癌的临床疗效
冯超凡, 胡继红, 张学贤, 游占亮, 王 飞, 赵 卫, 万 程, 熊 峰
原发性肝癌根据大体病理形态分为块状型、弥漫型随着肿瘤微创技术的发展,TACE已经成为无法切除的肝癌的一线治疗方式,越来越广泛的应用于临床中晚期肝癌的治疗[1-3]。对于巨块型肝癌(肿瘤长径>10 cm),TACE术后多会出现病灶边缘残留,而受制于肿瘤体积,消融也很难彻底清除病灶,单一治疗的效果有限,临床上逐渐形成了以TACE为基础的微创介入联合治疗新模式。本研究探讨采用DEB-TACE联合MWA及阿帕替尼治疗巨块型肝癌。
1 材料与方法
1.1 病例来源和纳入、排除标准
收集2017年5月至2019年5月期间在昆明医科大学第一附属医院接受载药微球联合阿帕替尼及消融治疗的巨块型肝癌患者共23例,年龄为(54.3±12.4)岁。肿瘤大小为(12.00±1.63)cm。最终随访至2020年10月1日,随访患者直至死亡或随访期结束。
纳入标准:①参考中国肝细胞癌TACE临床实践指南,满足诊断标准且符合手术适应证者;②肿瘤最大径>10 cm;③BCLC分期B或C期;④患方自愿签署研究知情同意告知书与手术有创知情同意书。排除标准:①年龄<18岁或>80岁;②肝功能Child-Pugh为C级或终末期肝病评分>18分;③对比剂过敏者;④心肾功能障碍或血液系统疾病患者;⑤门静脉主干癌栓完全闭塞,无侧支循环建立;⑥出现不良反应停药时间超过1个月或更换其他靶向药物;⑦失访。
1.2 治疗方法
1.2.1 TACE治疗 首先经股动脉入路将5 F YASHIRO导管置于腹腔干动脉造影明确肿瘤供血血管。后将聚乙烯醇载药微球(100~300μm)载入表柔比星50 mg,配置成微球混悬液。将微导管超选至肿瘤的供血动脉内,推注载药微球混悬液,栓塞完毕后造影见肿瘤供血血管呈残根样改变后,退出微导管并超选择下一支肿瘤供血动脉重复栓塞过程,若1瓶微球混悬液栓塞结束后,造影仍见肿瘤显影,则加用无色型聚乙烯醇栓塞微球(100~300μm)继续栓塞,栓塞满意后,将YASHIRO导管退至肝总动脉造影,见异常染色消失,退管,结束手术。
1.2.2 消融治疗TACE术后2周,在CT引导下将微波消融针(单针)穿刺至肿瘤边缘,消融范围应达到癌旁5~10 mm组织,消融功率50~70 W,首次时间为7~10 min,然后根据术中CT扫描病灶的气化程度,决定是否继续延长消融时间或更换穿刺部位再次消融。
1.2.3 阿帕替尼的应用 DEB-TACE术后3 d开始服用阿帕替尼(江苏恒瑞迦俐生生物医药科技有限公司),初始剂量500 mg/d。当患者出现不良反应不可耐受时,则减量至250 mg或更低剂量,甚至停药,停药时间不超过30 d。症状缓解后,再选择口服合适剂量。
随访期间,根据检查结果决定是否需要行DEB-TACE或行消融治疗,且2次治疗间隔需大于30 d,再次行DEB-TACE治疗或消融治疗,则在治疗前3 d停药。若病灶出现进展,则加用肝动脉置管化疗灌注术(HAIC)或加用免疫治疗。
1.2.4 疗效评估 按照规律间隔时间(1、3、6、12个月)复查患者AFP、肝功能及影像学,根据修改后实体瘤疗效评价标准(mRECIST)1.1[4]评估疗效。疾病控制情况分为完全缓解(CR)、部分缓解(PR)、稳定(SD)或进展(PD),计算肿瘤客观缓解率(ORR)=(CR+PR)/总例数×100%,控制率(DCR)DCR=CR+PR+SD/总例数×100%,统计患者总生存期(OS)、无进展生存期(PFS)及术后AFP。根据术后肝功能评分及并发症的发生情况评估DEB-TACE及消融术后不良反应,根据常见不良事件评价标准(CTCAE)5.0[5]评价阿帕替尼的不良反应。
1.3 统计学分析
采用SPSS25.0统计分析软件,计量资料服从正态分布的数据采用±s表示。使用Fisher精确检验评估分类变量,计数资料以数量及百分比来表示,采用秩和检验比较术前术后的肝功能指标,使用Kaplan-Meier方法分析中位总生存期(mOS)及绘制生存曲线,使用Cox比例风险模型进行单因素及多因素分析,以P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
2017年5月至2019年5月在昆明医科大学第一附属医院接受DEB-TACE联合阿帕替尼及消融治疗的23例巨块型肝癌患者的临床资料见表1。

表1 患者一般资料
2.2 疗效
本组无色型聚乙烯醇栓塞微球平均用量为2.1瓶,所有患者于术后1、3、6、12个月复查腹部增强MRI或CT;术后1个月,ORR为56.5%(13/23),DCR为95.7%(22/23),其中CR 3例(13.0%),PR10例(43.5%),SD 9例(39.1%),PD1例(4.3%);术后6个月,ORR为18/23(78.2%),DCR为22/23(95.7%),其中CR 9例(39.1%),PR 9例(39.1%),SD 4例(17.4%),PD1例(4.3%);术后6个月OS为91.3%,至随访结束时,患者的mPFS为14.0个月(95%CI:12.1~15.9个月),中位总生存期(mOS)为29.0个月(95%CI:19.5~34.5)。术后1年生存率达到78.3%(18/23)、术后1年PFS为43.5%(10/23)(表2)。术后6个月1例患者达到PR(图1)。

图1 1例巨块型肝癌患者行DEB-TACE联合MWA和阿帕替尼治疗前后影像学表现

表2 23例患者术后缓解变化情况 [例(%)]
评估了每个HCC结节抗肿瘤反应,在36个肝癌结节中,术后1年CR为22/36(61.1%),PR为12/36(33.3%),SD为0/36(0),PD为2/36(5.6%),ORR与DCR相同,为34/36(94.4%)。根据肝功能储备,Child-Pugh A和B之间的ORR分别为29/36(80.6%)和5/36(13.9%)(P=0.020);根据BCLC分期,BCLC B期和C期之间的ORR分别为18/36(50.0%)和16/36(44.4%)(P=0.505)。
2.3 安全性
TACE治疗存在着一定的不良反应,主要以栓塞术后综合征及一过性肝功能损伤为主,在第一次TACE术后几乎所有患者均出现栓塞术后综合征,其中主要表现为腹痛、发热、恶心、呕吐等,但症状均未超过3级。所有患者肝功能受损后,经过临床对症处理,肝功能大都可恢复至术前。见表3。
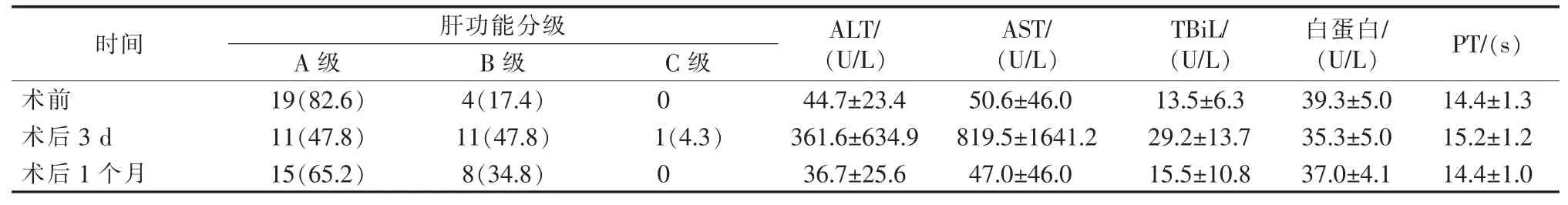
表3 23例患者术前后肝功能变化
在行TACE术后所有患者行微波消融治疗,平均消融点为7.05点,消融时间为29.65 min,对比TACE来说,消融减轻了肝功能的损伤。但消融也存在一定的不良反应,如气胸、肝包膜下出血、疼痛等,绝大部分患者在术后3 d症状逐渐缓解,只有2例患者出现严重的肝包膜下出血。所有术后综合征均未影响患者生存质量。
患者在术后口服阿帕替尼,不良反应主要包括手足综合征、继发性高血压、蛋白尿、脱发及皮肤色素沉着症等。所有患者不良反应均未超过3级(表4),通过减量或降低服药频率不良反应得到缓解,未发生停药或者换用其他靶向药物,未发生与不良反应相关死亡。
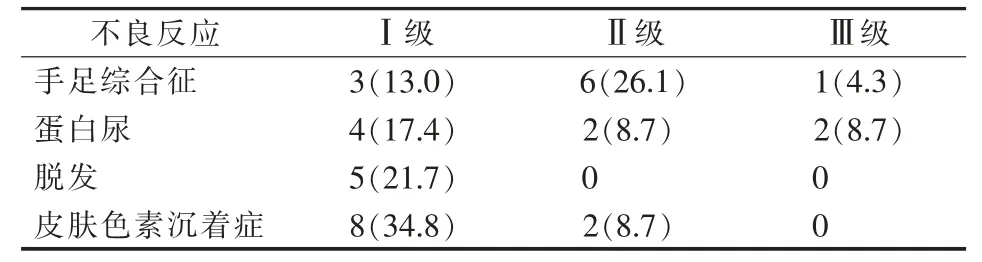
表4 23例患者服用阿帕替尼后不良反应 [例(%)]
2.4 单因素分析
选择肿瘤个数、是否有门脉侵犯、TACE次数、消融次数及术前AFP水平作为变量行单因素分析,结果显示,只有肿瘤个数P<0.05,故未进行多因素分析。单独分析了门静脉侵犯程度与患者预后的关系,结果显示PVTT等级与患者预后密切相关(P=0.009),因此肿瘤个数及PVTT等级可认为是患者预后的预测因素。见表5。
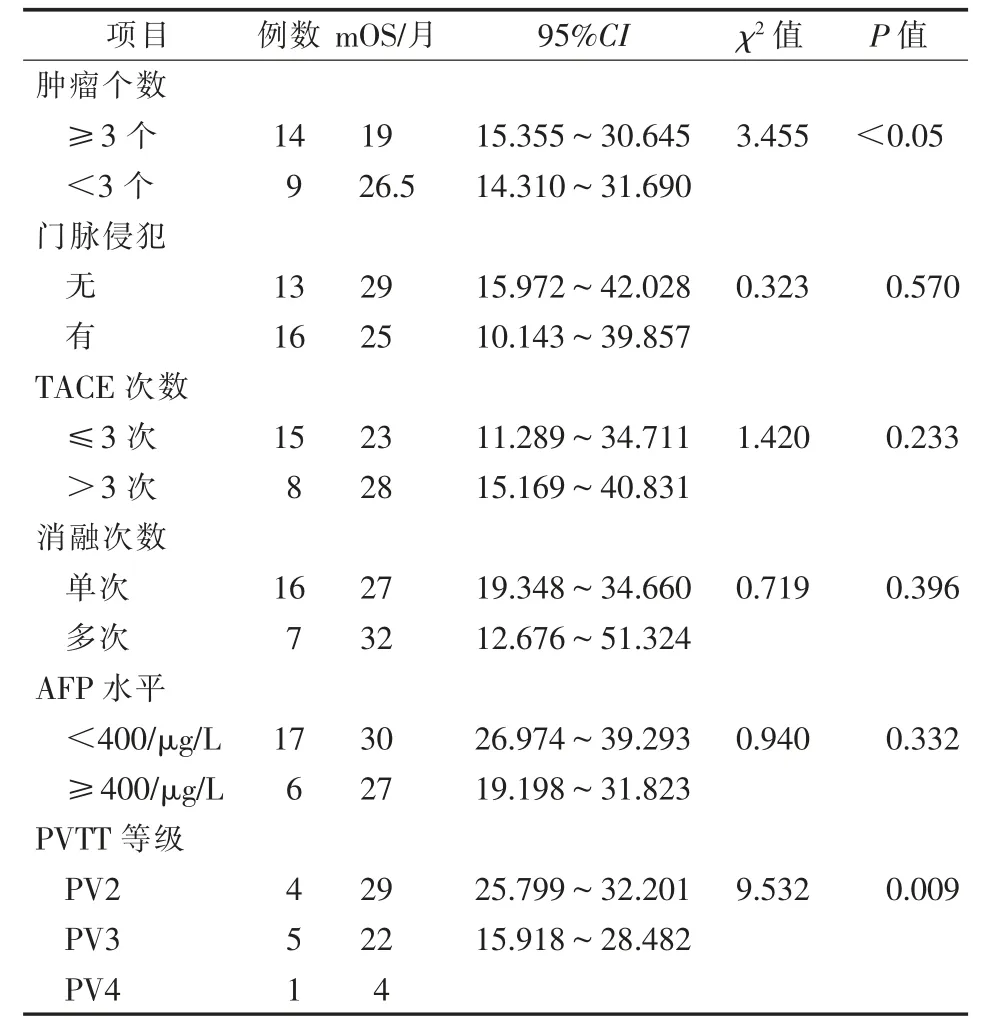
表5 单因素分析患者OS的影响因素
3 讨论
DEB-TACE实现在阻断肿瘤血供的同时持续性向肿瘤组织局部输送化疗药物,降低了全身静脉化疗的不良反应,本研究中,未出现骨髓抑制等严重并发症。相对于TACE,栓塞微球能沉积在末梢血管达到持续性栓塞效果。本研究采用了联合消融的治疗方法,尽可能使残余病灶坏死。消融术后1个月复查CT或MR,可见病灶几乎完全坏死,AFP明显下降,取得良好疗效。已有多项研究证实阿帕替尼对肝癌患者有明显疗效[6-7],本研究中患者在服用阿帕替尼后肿瘤得到了有效控制,其mOS为27.0个月,与Wu等[8]联合索拉菲尼对比显著提高了生存时间(27.0个月 比21.0个月)。
单一治疗并不能延长晚期肝癌患者生存期,TACE可增加VEGF-2水平促使肿瘤血管的再生,诱发肿瘤细胞扩散及转移;并且巨块型肝癌(≥10 cm)因为其肿瘤负荷较大,易导致病灶边缘消融不彻底以致病灶残留复发,巨大病灶往往需要多针消融,存在一定风险。单一治疗存在缺陷,以TACE为中心的联合治疗在巨块型晚期肝癌治疗中尤为重要,TACE联合阿帕替尼可抑制靶向性结合VEGFR,抑制肿瘤血管生成,延长中晚期癌症患者的OS及PFS。TACE术后会造成肿瘤病灶的部分坏死,并不能达到完全坏死,存在边缘区残留,多次TACE很容易造成患者术后肝功能严重损伤,而微波消融已被证实对于中晚期肝癌局部控制安全有效[9],TACE联合MWA可在短期内灭活边缘残余病灶,减少TACE次数,对肝功能不会造成严重损伤,改善了患者肝功能受损导致的死亡[10]。并且TACE可以阻断肿瘤血管,减少肝动脉血流量及减少血液热吸收,增加了TACE后MWA的肿瘤的坏死作用,提高疗效及肿瘤控制率。
联合治疗较单一治疗不良反应会有所增多,DEB-TACE的危害性较小,诱发的栓塞术后综合征较为轻微[11-13]。本研究消融术后只有2例患者出现严重的肝包膜下出血,术后3 d症状逐渐缓解,没有出现膈肌损伤及肠道损伤等并发症。同时部分患者在服用阿帕替尼后出现不良反应,但均未超过3级,在减量或降低服药频率后症状得到缓解,本研究不存在因为不能耐受不良反应而停药或者终止治疗的患者。
本研究中,术前肝储备功能是影响肿瘤结节预后的预测因素,而与术前BCLC分期无关,这表明术前肝功能对于患者的预后及生存期极其重要。单因素分析显示,预后较好患者只存在单个病灶,与其他因素关系不大,在有无门静脉侵犯因素中,患者预后无明显差异,但PVTT等级较低的患者较等级高的患者预后更好,因此肿瘤个数及PVTT等级是预测肝癌患者预后不良的重要因素,这也在相关研究中得到证实[14]。术前AFP≤400μg/L及无门脉癌栓患者中位生存时间更长,与之前相关研究结果相仿[15]。
本研究仍存在一些局限性。首先,由于是一项回顾性研究,可能存在选择偏倚和混淆因素。其次,样本量较小,所有样本均来自单中心,因此需要多中心的研究来验证结果。最后,本研究可能存在一些混杂因素,例如评判肿瘤疗效时存在误差。
综上所述,DEB-TACE联合MWA及阿帕替尼对巨块型中晚期肝癌具有良好的疗效及耐受性,改善了患者生存时间及生存质量。

