牛传染性鼻气管炎病毒gE 蛋白在杆状病毒中的表达及抗原性鉴定
杨木娇,林 俊,张 娟,王 婉,向文杰,薛 飞,朱远茂
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
牛传染性鼻气管炎(Infectious bovine rhinotracheitis,IBR)是由IBR 病毒(IBRV)即牛疱疹病毒1 型(BHV-1)引起的一种急性、热性、接触性传染病。IBR 临床表现以呼吸道疾病为主,伴有结膜炎、流产、死胎、乳房炎、产奶量减少及脓疱性外阴阴道炎或龟头包皮炎,有时还可诱发幼牛脑炎。而且IBRV侵入机体后可造成潜伏感染和终身带毒,使得本病难以根除,给养牛业造成严重经济损失[1]。
IBRV 属于疱疹病毒科,α 疱疹病毒亚科,水痘病毒属,是有囊膜的双链线性DNA 病毒。gE 是由US8 基因编码的IBRV 结构糖蛋白之一,可刺激机体产生抗体。其在病毒粒子表面及病毒感染细胞表面高水平表达,并在体内诱导细胞融合,从而影响病毒的传播和释放因此gE 基因缺失。缺失可造成病毒毒力降低,限制病毒在细胞间的传播,从而降低病毒在体内的复制能力[2-3]。IBRV 基因缺失标记疫苗免疫后能有效地保护牛群,如gE-基因缺失苗和gE-/TK-双基因缺失苗等,而且通过使用gE 基因缺失苗并配套使用gE 抗体检测试剂盒,可实现鉴别诊断疫苗免疫牛与自然感染牛,有助于控制并消灭该病[4-5]。
杆状病毒表达系统已被广泛用于外源蛋白的表达。在大多数情况下,重组蛋白经过翻译后加工、修饰并转运至适当的细胞位置后,其功能与原蛋白相似。蜂素信号肽(Honeybee melittin signal peptide,HBM)可以介导外源蛋白进入昆虫细胞内质网进行翻译后糖基化修饰,可使外源蛋白分泌至培养上清,同时HBM可提高外源蛋白的表达量[6-7]。因此,本研究利用融合PCR 的方法在gE 基因5'端引入HBM,在Bacto-Bac杆状病毒表达系统中进行表达,并对重组gE蛋白(rgE)进行了反应原性和免疫原性鉴定。
1 材料与方法
1.1 主要实验材料IBRV-8(野毒株)、IBRV-56(gE 缺失株)、MDBK 细胞和Sf21 昆虫细胞、IBRV-8、IBRV-56 免疫兔血清、 gE 抗体阳性牛血清和阴性牛血、健康山羊血清均由本实验室保存;供体质粒pFastBac1 购自Invitrogen 公司; TOP10 感受态细胞购自北京索莱宝科技有限公司;DH10Bac 菌株购自北京华奥宝生科技有限公司;6~8 周龄雌性BALB/c 小鼠购自辽宁长生生物技术有限公司。
病毒DNA 提取试剂盒、质粒提取试剂盒购自Axygen 公司;胶回收试剂盒、DreamTaqGreen PCR Master Mix(2×)和Prestianed Protein Ladder 均购自Thermo Fisher公司;Prime STAR HS DNA Polymerase、DEPC水、dNTP Mixture、DL2000 和DL5000 DNA Marker 均购自宝生物工程(大连)有限公司;XbaI、BamHⅠ限制性内切酶和T4 DNA 连接酶购自NEB 公司;杆状病毒穿梭载体bacmid 小量抽提试剂盒和BCA 蛋白浓度检测试剂盒购自碧云天公司;FITC 标记的兔抗牛IgG、HRP 标记的山羊抗鼠IgG 和HRP 标记的兔抗羊IgG 均购自Sigma-Aldrich;Dylight700 标记的山羊抗兔IgG 购自KPL 公司;TMB 购自北京泰天河生物技术有限公司;ELISA 酶标板购自Greiner 公司;Grace Insect Medium 和CellfectinⅡReagent 购自Gibco公司;High Affinity Ni-NTA Resin 购自金斯瑞生物科技公司;山羊抗IBRV血清购自VMRD公司。
1.2 目的基因的扩增将IBRV-8 以1000 TCID50接种于生长状态良好的单层MDBK 细胞,于5% CO237 ℃条件下培养约48 h,待细胞出现约80% CPE 时收集病毒液,反复冻融3 次后提取IBRV-8 的基因组DNA。
根据参考文献[8]设计扩增HBM 基因片段的引物:HBM-P1: 5'-TCTAGGATCCATGAANATTCTTAGT CAACGTTGCCCTTGTTTTTATGGTCG-3'/HBM-P2: 5'-ATCCGCATAGATGTAAGAAATGTATACGACCATAAA AACAAGGGC-3'。HBM-P1 的5'端插入BamH I 酶切位点和起始密码子ATG,HBM-P1 和HBM-P2 之间有19 bp 互补碱基,可互为模板,采用引物直接退火法扩增HBM 片段。
根据GenBank中的IBRV基因组序列(NC_001847.1),设计扩增gE 基因片段的引物:gE-p3:5'-TACATCT ATGCGGATCAACCCACCGCGCCG-3'/gE-p4:5'-TAT ATCTAGATTAGTGATGGTGATGGTGATGTTTATATGCA GCCCTAC-3'。在gE-p4 的下游插入6×His 标签、终止密码子和XbaI 酶切位点。HBM-P2 下游和gE-p3上游之间有15 bp 的互补碱基。由于IBRV 基因组中G+C 含量高达约72%,所以采用Prime STAR HS DNA Polymerase 进行热启动PCR 扩增gE 基因片段,反应程序如下:(1)先将反应管置于PCR 仪中97 ℃预变性7 min,再取出反应管加入Prime STAR HS DNA Polymerase;(2)98 ℃10 s,57 ℃5 s,72 ℃1 min 40 s,共30 个循环;72 ℃10 min。进一步以HBM 基因片段和gE 基因片段为模板,采用Prime STAR HS DNA Polymerase 进行融合PCR,获得融合基因片段,命名为rHBM-gE。
1.3 重组杆粒(rBacmid-gE)的构建与鉴定用限制性内切酶XbaI 和BamH I 分别对rHBM-gE 片段和转移载体pFastBac1 进行双酶切和纯化后,用T4 DNA 连接酶将rHBM-gE 连接至质粒pFastBac1 中,再转化至TOP10 感受态细胞,经Amp+平板筛选,挑选阳性菌落过夜振荡培养。提取重组质粒并经双酶切鉴定,将鉴定阳性的重组质粒(pFB-rgE)由上海生工生物工程有限公司进行测序。将测序正确的pFB-rgE 转化至含有杆粒的DH10Bac 感受态细胞中,构建重组杆粒。利用pUC/M13F/M13R 通用引物对重组杆粒进行PCR 鉴定,获得阳性重组杆粒(rBacmid-gE)。
1.4 重组杆状病毒(rBV)的构建用转染试剂CellfectinⅡReagent 将rBacmid-gE 转染对数生长期的Sf21昆虫细胞后,于27 ℃培养72 h 至细胞出现病变,即获得重组杆状病毒(rBV)。收集上清液,此为P0 代rBV,继续扩繁传代,共培养17 代。提取P4、P7 和P17 代次的rBV 基因组DNA,采用pUCM13F/M13R引物、gE 特异性引物,鉴定gE 基因是否已经整合于rBV 中。
1.5 重组gE 蛋白(rgE)的间接免疫荧光(IFA)鉴定将P14 代rBV 接种于96 孔细胞培养板中处于对数生长期的Sf21 昆虫细胞,同时设置未接种的细胞作为空白对照,27 ℃培养72 h,PBST 洗涤后用固定液(甲醇、丙酮1∶1 混合)室温固定15 min,加入含有5%脱脂乳和3% BSA 的PBST,37 ℃封闭2 h;洗涤后分别加入100 μL 的1∶50 稀释IBRV 阴、阳性牛血清作为一抗,洗涤后加入1∶200 稀释的FITC 标记的兔抗牛IgG 作为二抗,37 ℃避光孵育1 h,洗涤后用90%甘油封板,于倒置荧光显微镜下观察是否有绿色荧光。
1.6 rgE 的纯化及western blot 鉴定经1.4 和1.5鉴定rgE 在rBV 中获得表达后,对rBV 进行大规悬浮培养,收集1 L上清液,用High Affinity Ni-NTA Resin 纯化后4 ℃过夜透析,使用BCA 试剂盒测定纯化后的蛋白浓度。
纯化后的rgE 经10% SDS-PAGE 电泳后转印至NC 膜上,4 ℃过夜封闭,洗涤后分别以IBRV-8 和IBRV-56(gE 缺失株)免疫的兔血清(1∶200)、山羊抗IBRV 血清和健康山羊血清(1∶5 000)作为一抗,Dylight700 标记的羊抗兔IgG(1∶10 000)以及HRP 标记的兔抗羊IgG(1∶5 000)为二抗,室温作用1 h,分别用近红外光扫描成像系统和化学发光成像检测特异性条带。
1.7 rgE 的免疫原性鉴定将纯化的rgE 免疫6 周龄BALB/c 小鼠,4 只为免疫鼠和2 只为对照鼠。每只免疫鼠注射200 μg 的rgE,对照鼠注射等体积的PBS。每两周免疫一次,共免疫两次,分别在首免后1 周、2 周和二免后2 周采血,用经蔗糖密度梯度纯化的IBRV-8 作为包被抗原(3 μg/孔),以待检鼠血清(1∶50)为一抗,HRP标记的山羊抗鼠IgG(1∶15 000)为二抗,通过间接ELISA方法检测小鼠血清抗体。
2 结 果
2.1 目的基因的PCR扩增结果分别以IBRV全基因组为模板和gE-P3/gE-P4为引物,PCR扩增gE基因片段;HBM-P1和HBM-P2可互为模板,采用引物直接退火法扩增HBM片段,结果分别得到1 756 bp和76 bp目的片段(图1)。再以gE 和HBM 基因片段为模板进行融合PCR,结果可扩增得到1 830 bp 的融合基因片段rHBM-gE,与预期大小相符(图1),表明获得了目的基因片段rHBM-gE。
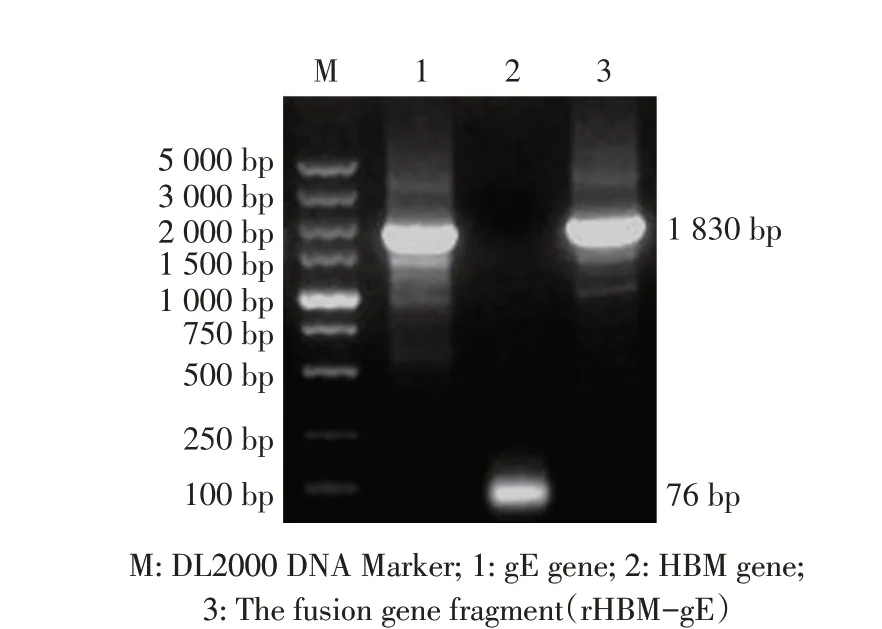
图1 目的基因的PCR扩增Fig.1 PCR amplification of target genes
2.2 rBacmid-gE 的构建与鉴定结果将测序正确的重组质粒pFB-rgE 转化至含有杆粒的DH10Bac 感受态细胞中,构建重组杆粒。使用pUCM13F/M13R引物对重组杆粒进行PCR 鉴定。结果显示,阳性杆粒可扩增到4 132 bp 的目的条带(图2),大小与预期相符。表明获得了包含rHBM-gE 基因片段的阳性重组杆粒rBacmid-gE。
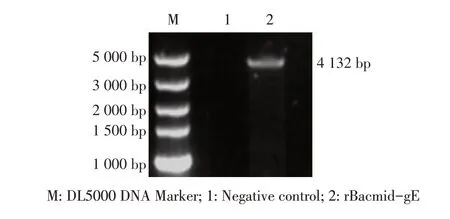
图2 rBacmid-gE的PCR鉴定Fig.2 PCR identification of rBacmid-gE
2.3 rBV 的PCR 鉴定结果提取不同代次rBV 的基因组DNA,分别用pUCM13F/M13R 引物和gE 特异性引物进行PCR 扩增,结果各代次的rBV 均可分别扩增出4 132 bp和1 830 bp的目的基因片段(图3),表明获得了已整合gE 基因的rBV,而且rBV 能稳定传代。
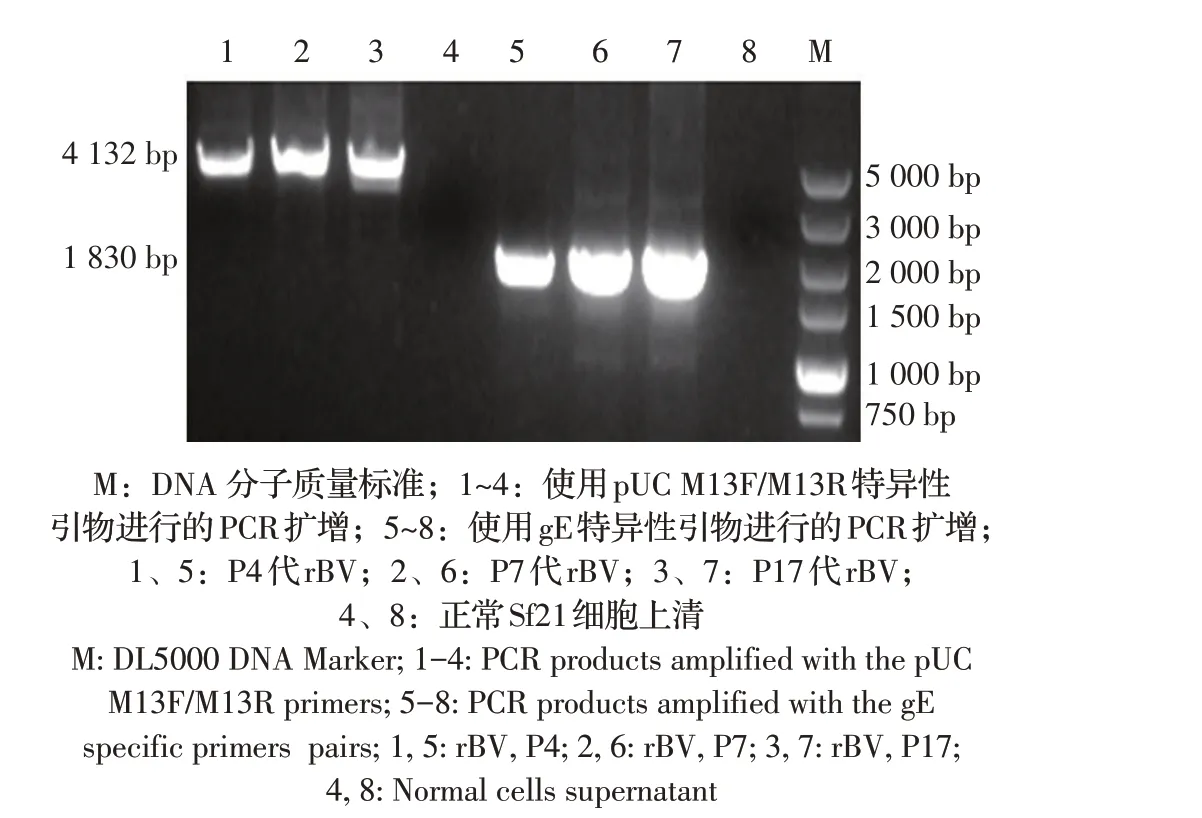
图3 不同代次重组杆状病毒的PCR鉴定Fig.3 PCR identification of recombinant baculovirus of different generations
2.4 rBV 的IFA 鉴定结果利用P14 代rBV 感染96孔细胞培养板内生长良好的Sf21 细胞, IFA 检测结果显示,感染rBV 的Sf21 细胞与gE 抗体阳性牛血清反应并出现绿色荧光(图4A),绿色荧光信号主要集中在细胞质和细胞膜上,而与gE 抗体阴性牛血清不反应(图4B),同时,未接种rBV 的Sf21 细胞与gE 抗体阳性牛血清不反应(图4C)。进一步表明获得了能表达rgE 的rBV,且rgE 蛋白位于Sf21 细胞质和细胞膜,可以在Sf21 细胞中合成、加工和运输。
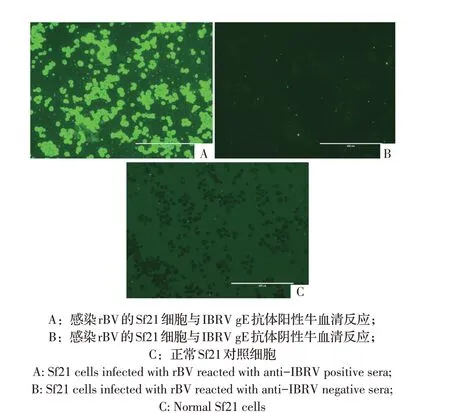
图4 rBV的IFA鉴定Fig.4 Identification of rBV by IFA
2.5 rgE 的纯化及鉴定结果对rBV 进行PCR 和IFA鉴定后,大量培养rBV,并收集1L 上清液,对rgE进行纯化,纯化后的rgE 浓度为0.78 mg/mL。
将纯化后的rgE 经western blot 鉴定,结果显示rgE 蛋白与IBRV-8 免疫的兔血清和山羊抗IBRV 血清均在约110 ku、68 ku 和55 ku 处呈阳性反应(图5A 和图5C),与山羊抗IBRV 阳性血清还在约130 ku 处呈阳性反应(图5C),与IBRV-56(gE 缺失株)免疫兔血清和健康山羊血清均不反应(图5B 和图5D)。表明rgE具有较强的反应原性,且仅与gE抗体反应。
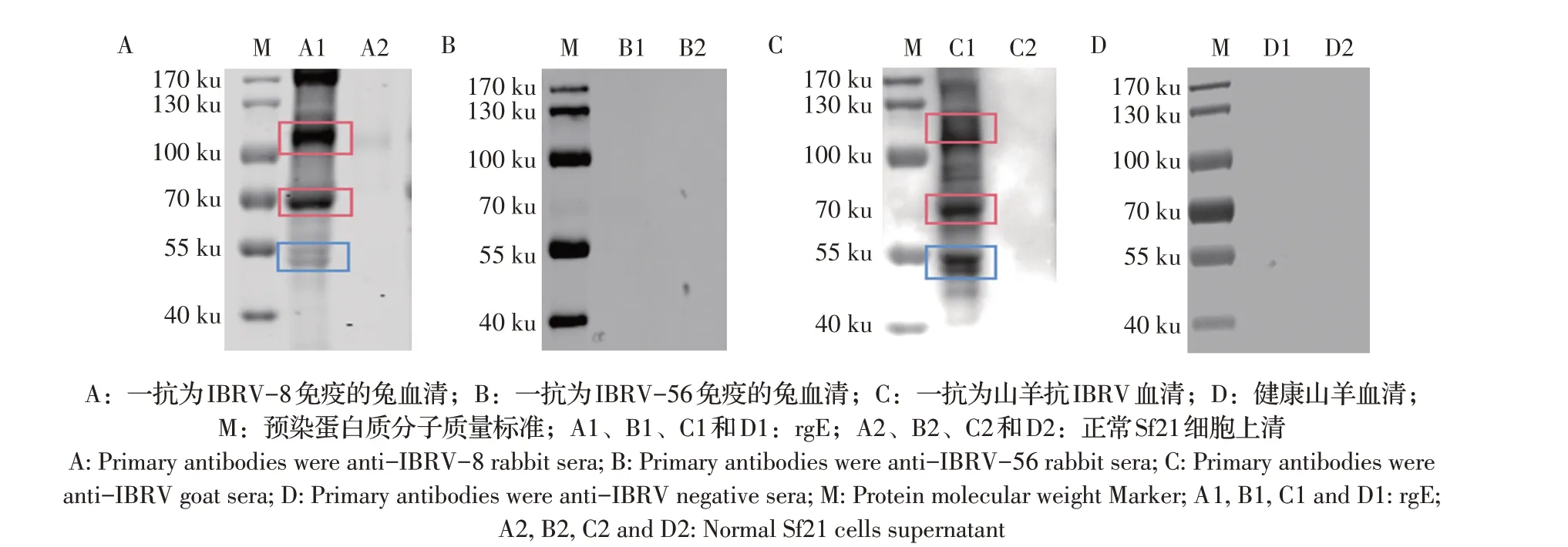
图5 Western blot检测rgE的表达Fig.5 Western blot analysis of the rgE expression
2.6 重组蛋白的免疫原性鉴定结果采用间接ELISA 方法检测rgE 免疫组小鼠和空白对照小鼠的血清抗体水平,结果显示,首免后1 周免疫鼠即可产生针对rgE 的抗体,免疫鼠首免后1 周、2 周和二免后2 周的血清抗rgE 抗体水平(平均值)均明显高于对照组小鼠(平均值),且免疫组小鼠抗体水平(平均值)随着免疫次数的增加逐渐增高,且后一次血清抗体水平明显高于前一次;而对照组小鼠的抗体水平(平均值)始终无变化(图6)。表明rgE 可诱导小鼠产生特异性gE 抗体,具有良好的免疫原性。

图6 间接ELISA方法检测小鼠血清抗体结果Fig.6 The rgE induced of serum antibodies in mice were detected by indirect ELISA
3 讨 论
IBRV 常规疫苗接种的牛与野毒感染的牛通常不能通过血清学检测区分开来,对疫苗免疫效果评价带来了困难,且无法实施IBRV 的清除计划。gE 对IBRV 复制是非必需的,但它能诱导快速、持久的免疫反应,IBRV gE 基因缺失株虽毒力减弱但仍具有良好的免疫原性,因而gE 常被选作构建基因缺失标记疫苗的可靠候选基因。同时,血清中的gE 特异性抗体可成为鉴别疫苗免疫和自然感染牛的可靠标记[9]。对正在实施IBRV 清除和控制计划的国家,能区分疫苗接种和自然感染牛对贸易限制和监督至关重要[10]。此外,使用gE 基因缺失疫苗有可能监测到野生型病毒在动物种群中的传播,并确定其在畜群、地区和国家中的真正感染率[11],因为gE 血清转阳意味着感染了野生型病毒。
有研究表明,原核表达的蛋白因缺乏糖基化修饰而使得gE 蛋白功能无法完全得到呈现,相比原核表达系统,真核表达系统可使表达产物进行翻译后修饰,使其具有天然的构象[12]。有研究已通过使用杆状病毒-昆虫系统和哺乳动物细胞成功截短表达了一些疱疹病毒gE 蛋白[13-16]。由于gE 蛋白包含几个抗原结构域,因此表达完整蛋白可能会提高gE 抗体的检测效果[17]。
为了获得具有完整功能和良好抗原性的IBRV gE 重组蛋白,本实验利用Bac-to-Bac 杆状病毒表达系统表达了gE 基因全长,获得了能在上清中表达gE 基因的rBV,而且rBV 能稳定传代分泌。IFA 鉴定结果显示,rBV 感染的Sf21 细胞与gE 抗体阳性牛血清反应可产生特异性免疫荧光,而与gE 抗体阴性牛血清不反应,表明感染细胞表达出了具有生物活性的rgE,且其具有良好反应原性和正确的细胞定位,可以在Sf21 细胞中合成、加工、运输。这一结果与先前报道的利用杆状病毒系统表达的BoHV-1糖蛋白的细胞定位结果相吻合[14,18]。本研究大量培养rBV 后收集上清对rgE 进行纯化,经western blot 试验表明,rgE 在培养上清中获得了分泌表达。通过western blot检测结果可见rgE与gE抗体阳性血清的反应出现了若干不同大小的条带,其中,与gE抗体阳性兔血清和牛血清的反应均有约110 ku、68 ku 和55 ku 大小的条带,与羊源IBRV 抗血清的反应后还在约130 ku处有特异性条带,分析可能是由于rgE 蛋白发生翻译后修饰,尤其是糖基化修饰以及糖基化修饰位点和程度不同的结果,从而使rgE 存在若干个异构体,而与gE 抗体阳性兔血清的反应还在170 ku 处有条带,这可能是因为rgE 发生了聚集。姜良利用重组杆状病毒表达系统对大小为1 176 bp 的gE 胞外区片段进行诱导表达,经western blot 和IFA 分析显示,得到了43 ku 的gE 融合蛋白,该重组蛋白具有良好的免疫原性[19]。AlaaA.El-Kholy 利用杆状病毒表达系统表达了BHV-1.1 Abu-Hammad 株的gE 蛋白,获得了80 ku 的重组gE 蛋白(rBac/gE-AbuH)[10]。据报道,经计算gE 的MWt 约为61 ku,表观MWt 约为92 ku[20]或94 ku[13]等,区别在于翻译后修饰尤其是糖基化的结果。这表明昆虫细胞中rgE/AbuH 的翻译后修饰不足,很可能是N-糖基化不足。其他学者在昆虫细胞中表达IBRV 的gD 蛋白[17]和gE 蛋白[8]时也观察到类似的不完全加工现象。而本实验经western blot检测可发现rgE 异构体的分子量大小分别有68 ku、110 ku、130 ku 等,说明其糖基化修饰应该较为充分,而哪一种异构体的获得量更多以及糖基化修饰的具体位点,需要进一步研究分析。此外,小鼠在免疫rgE 后可产生结合IRBV-8 的特异性抗体,且随着免疫次数的增加和时间的推移,抗体水平也随之增加,进一步证明rgE 获得了表达,且具有良好的免疫原性,可刺激机体产生特异抗体。
综上所述,本研究利用杆状病毒表达系统对IBRV 完整gE 蛋白实现了分泌性表达,rgE 具有良好的抗原性,为建立IBRV gE 特异性抗体检测方法,实现gE 基因缺失疫苗免疫牛和自然感染牛的鉴别诊断别奠定了物质基础,同时为gE 结构和功能的研究奠定了一定的基础。

