单核细胞增生李斯特菌RsbS 蛋白的抗应激机制作用研究
夏 叶,李春华,孙莹慧,朱永军,缪德年*,辛永萍
(1.上海市农业科学院畜牧兽医研究所,上海 201106;2.浙江大学医学院附属第二医院,浙江 杭州 310009)
单核细胞增生李斯特菌(简称单增李斯特菌,Listeria monocytogenes,Lm),是一种严重危害健康的食源性人兽共患致病菌,可通过多种途径传播,引起人和动物的感染,出现胃肠炎、脑膜炎、败血症和流产等症状,致死率可达20%~30%,与大肠杆菌O157、沙门菌以及空肠弯曲杆菌并称世界4 大食源性病原菌,被WHO 列为必检的食源性致病菌[1-3]。Lm 的致病性与其强大的抗应激能力密不可分,该菌可在高渗透压(10%~20%NaCl)、低温高温(0.4 ℃~45 ℃)以及宽泛的pH(pH2.5~pH9.0)条件中生长,从而使其广泛存在于自然界、食品加工及储存环境中[4]。
细菌在遭遇应激或环境变化时,会启动相应的抗应激机制来适应环境并抵抗应激。革兰氏阳性菌中,Sigma B(σB)作为最重要的应激调控因子,直接或间接参与细菌的抗应激过程[4-6]。σB首先在枯草芽胞杆菌中被发现[7],而其活性也受到调控操纵子(Rsbs)的精密调控[8]。该调控操纵子由7 个基因组成:rsbR、rsbS、rsbT、rsbU、rsbV、rsbW和rsbX,sigB位于rsbW之后、rsbX之前。σB操纵子上游的rsbR、rsbS和rsbT 编码的蛋白构成应激复合体RsbRRsbS-RsbT,稳定整个抗应激系统。RsbS 作为复合体中的骨架蛋白,其磷酸化/非磷酸化状态在σB抗应激激活过程中至关重要[9]。枯草芽胞杆菌和Lm 中的RsbS 较保守,二者同源性高达74.1%,但其在Lm中发挥的抗应激机制尚无报道。本研究通过原核表达系统获得重组RsbS 蛋白并纯化后,免疫BALB/c 小鼠,制备RsbS 多克隆抗体,生物信息学预测其理化特性和潜在磷酸化位点,进行蛋白互作筛选,并通过Lm 野生株10403S 和缺失株ΔrsbR分析RsbS 参与的抗应激机制,以期为研究RsbS 蛋白的生物学功能及其在Lm 抗应激过程中发挥的作用奠定基础。
1 材料与方法
1.1 主要实验材料及实验动物Lm 野生型菌株10403S、缺失株ΔrsbR[10]、大肠杆菌DH5α 和Rosetta(DE3)、原核表达质粒pET-30a、RsbR 蛋白[10]、RsbX蛋白及10403S 全菌蛋白[11]均由本实验室保存。
脑心浸液培养基(BHI)购自北京陆桥技术股份有限公司;酵母浸膏、胰蛋白胨、卡那霉素(工作浓度为50 μg/mL)、异丙基硫代半乳糖苷(IPTG)、DNA 连接酶、BCA 蛋白定量试剂盒和HRP 标记的羊抗鼠IgG(IgG-HRP)购自生工生物工程(上海)有限公司;2×PCR Mix、高保真酶2×phanta Max Master Mix、DNA 胶回收试剂盒、PCR 产物纯化试剂盒、质粒抽提试剂盒、RNA 抽提试剂盒、反转录试剂盒以及SYBR Green 购自南京诺唯赞生物科技有限公司;DNA Marker 购自北京全式金生物技术有限公司;限制性内切酶和蛋白Marker 购自宝日医生物技术(北京)有限公司;核酸电泳染料Goldview 购自上海赛百盛基因技术有限公司;His-Ni 纯化柱购自赛默飞世尔科技(中国)有限公司。
6 周龄~8 周龄BALB/c 小鼠(18 g~22 g,雌性)购自浙江中医药大学动物实验研究中心。
1.2 RsbS 蛋白的理化特性分析通过ExPAsy 服务器(https://web.Expasy.org/protparam/)分析RsbS 蛋白的理化性质。利用NetPhos 3.1 服务器(http://www.cbs.dtu.dk/services/NetPhos/)预测RsbS 蛋白潜在的磷酸化位点。采用SWISS-MODEL 在线软件预测RsbS 蛋白的三级结构。
1.3 rsbS基因的PCR 扩增与重组RsbS 蛋白的表达根据Genbank 中登录的Lm 10403S 株全基因组序列(CP002002.1),通过Vector NTI 软件设计针对rsbS基因完整ORF 片段的引物并引入酶切位点,F:5'-CGGGATCCGTGGGGATACCAATCTTAAAGTTAG G(BamH I)-3'/R:5'-CGGTCGACTCATTCCCCCAATT CCTGTTTAAG(SacI)-3',预期目的片段大小为373 bp。引物由铂尚生物技术(上海)有限公司合成。采用热裂解法提取Lm10403S 株的基因组DNA[12]并作为模板,PCR 扩增rsbS基因。PCR 反应条件:95 ℃30 s; 95 ℃10 s, 55 ℃30 s,72 ℃30 s,35 个循环;72 ℃ 10 min。rsbS基因的PCR 扩增产物经BamH I 和SacI 双酶切,回收后克隆于经同样酶切处理的pET-30a(+)中,转化至大肠杆菌DH5α 感受态细胞,经菌液PCR 检验呈阳性的样品由铂尚生物技术(上海)有限公司测序鉴定。将无氨基酸突变的阳性克隆转化入表达菌株Rosetta(DE3)中,经PCR鉴定正确的重组表达菌命名为pET-30a-rsbS/Rosetta。
将重组表达菌pET-30a-rsbS/Rosetta 37 ℃、160 r/min 振荡培养至OD600nm约0.5,加入终浓度为0.4 mmol/L 的IPTG 诱导培养后,以8 000 r/min 离心10 min 收集菌体,超声裂解后分别收集上清和沉淀(沉淀用含8 mol/L 尿素的PBS 充分溶解),通过SDSPAGE 检测重组RsbS 蛋白表达情况,进一步利用His-Ni 纯化柱对重组RsbS 蛋白进行纯化,采用BCA方法测定蛋白浓度,用于后续试验。
1.4 蛋白互作的等温滴定量热分析根据GE 公司ITC200 微量等温滴定量热仪的操作指南,通过等温滴定量热试验进行RsbS 蛋白与其上游蛋白RsbR 的互作试验。参照肖雨涵等的方法对1.3 中纯化的重组蛋白进行透析[13],以减少溶剂中的杂质在滴定过程中可能引起的热效应变化。滴定蛋白(RsbS)与被滴定蛋白(RsbR)浓度比为5∶1,RsbS 蛋白单次滴定体积10 μL,滴定速度2 s/μL,滴定间隔300 s,搅拌速度300 r/min,反应温度25 ℃。实验结果利用NanoAnalyze 软件进行independent 和blank(constant)拟合,通过计算结合位点数(n)、亲和力常数(Ka)、熔变(ΔH)、熵变(ΔS)等热力学参数来判断蛋白间的互作关系。
1.5 RsbS 多克隆抗体的制备及鉴定将纯化的重组RsbS 蛋白作为抗原,与弗氏完全佐剂等体积混合,采用注射推拉法充分乳化至油包水状态,于小鼠脊椎两侧经皮下多点注射。免疫前经尾静脉采血作为阴性对照,每10 d 免疫一次。初免抗原量为200 μg/只,二免、三免和四免抗原量均为100 μg/只。四免后一周眼眶采集血,分离血清后,3 000 r/min 离心20 min,收集上清即为RsbS 多克隆抗体。将纯化的重组RsbS 蛋白以每孔3 μg 的量包被于96 孔聚乙烯酶标板,以2 倍倍比稀释的RsbS 多抗(1∶500~1∶256 000)作为一抗,羊抗鼠IgG-HRP(1∶5 000)作为二抗,采用间接ELISA 测定抗体效价。当OD450nm值>0.2,且P/N≥2.1 时的最大抗体稀释倍数即为其效价。参照文献中western blot 方法鉴定RsbS 多抗的反应原性[11]。即以RsbX 蛋白和空载体pET-30a/Rosetta裂解液作为阴性对照,检测制备的RsbS 多克隆抗体能否与Lm10403S 全菌蛋白中的RsbS 蛋白特异性结合。鉴定正确后的多克隆抗体用于后续研究RsbS 参与细菌抗应激反应的机制。
1.6 应激状态下Lm 野生菌株与缺失菌株rsbS基因转录水平的分析将培养至OD600nm约0.6 的Lm 野生株10403S 和缺失株ΔrsbR分别用BHI 液体培养基(pH7.4)和含5% NaCl 的BHI 应激培养基于37 ℃震荡培养30 min 后,离心收集菌体。根据说明书抽提全菌RNA 并逆转录成cDNA 后,参照本实验室建立的方法[11],利用qPCR 分别检测野生株和缺失株中rsbS(F:5'-AAACGTCGGCCAGAGGAGTA-3'/R:5'-CTTT TGCACCCATTAGTTTAGACAT-3')在应激/非应激状态下的转录水平。以gyrB(F:5'-AGACGCTATTGA TGCCGATGA-3'/R:5'-GTATTGCGCGTTGTCTTCGA-3')作为内参[11],以BHI 液体培养的非应激组作为对照组,利用2-ΔΔCT法分析rsbS基因的转录水平。
1.7 应激状态下Lm 野生菌株与缺失菌株RsbS 蛋白表达量分析将培养至OD600nm约0.6 的Lm 野生株10403S 和缺失株ΔrsbR分别用BHI 液体培养基和含5% NaCl 的BHI 应激培养基于37 ℃震荡培养30 min后,离心收集菌体,超声裂解收获全菌蛋白。利用western blot 鉴定野生株和缺失株中RsbS 蛋白在应激/非应激状态下的表达量差异,以RsbS 多克隆抗体作为一抗(1∶500),羊抗鼠IgG-HRP 作为二抗(1∶5 000),GAPDH 作为内参蛋白,利用Quantity One 软件进行定量分析。
2 结 果
2.1 RsbS 蛋白的理化特性分析经ExPAsy 服务器分析显示,Lm RsbS 蛋白分子式为C565H938N136O175S4,含有118 个氨基酸,亮氨酸含量最高为13.6%,异亮氨酸含量次之为12.7%,不含天冬氨酸、色氨酸和酪氨酸。RsbS 蛋白带正电荷残基8 个,负电荷残基18 个,等电点为4.38。RsbS 蛋白在体外的理论半衰期为100 h,不稳定系数为32.55,表明该蛋白较为稳定。RsbS 蛋白的平均亲水指数(GRAVY)为0.625,预测其在胞外的可能性较高,表明该蛋白具有较高亲水性。NetPhos 3.1 服务器分析显示,RsbS蛋白共有8 个潜在的磷酸化位点,分别为S18、T24、S40、S56、S69、T88、S101 和S107,提示该蛋白可能易被磷酸化。经SWISS-MODEL 在线软件同源建模的方法预测RsbS 蛋白三级结构(图1)。RsbS 蛋白序列与SWISS-MODEL 中作为模板的序列枯草芽孢杆菌RsbS 蛋白的一致性高达73.28%,GMQE值0.77,QMEAN 值-0.51,表明预测的三级结构可靠性高,基本可代表RsbS 蛋白的真实状态,提示Lm RsbS蛋白可能与枯草芽胞杆菌RsbS 蛋白一样参与细菌的应激调控。
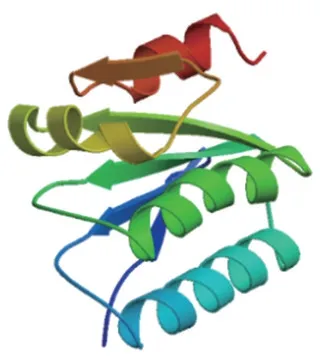
图1 Lm RsbS蛋白三级结构预测Fig.1 Protein tertiary structure prediction of Listeria monocytogenes RsbS
2.2 重组表达质粒及重组RsbS 蛋白表达的鉴定结果以构建的重组质粒为模板扩增rsbS基因,目的条带与预期373 bp 大小相符(图2),表明重组表达质粒pET-30a-rsbS正确构建。测序鉴定结果显示扩增的rsbS基因未发生突变。
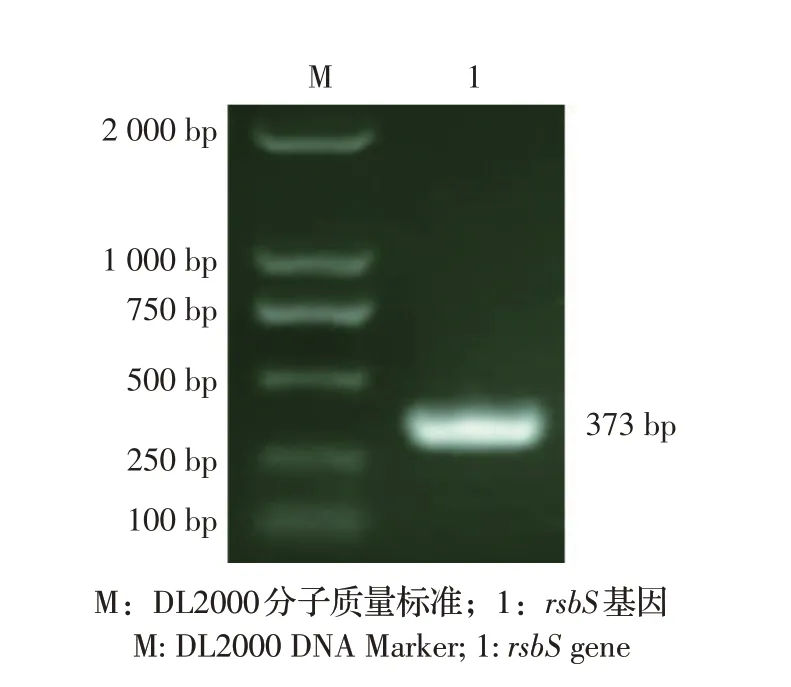
图2 重组质粒pET-30a-rsbS的PCR鉴定结果Fig.2 PCR identification of recombinant plasmid pET-30a-rsbS
重组表达菌pET-30a-rsbS/Rosetta 经0.4 mmol/L的IPTG 诱导表达3 h 后,收集裂解菌体的上清和沉淀经SDS-PAGE 检测。结果显示,重组菌的上清和沉淀中均在18.8 ku 处出现目的条带,与重组RsbS蛋白预期大小一致,而空载体菌对照样品未出现相应条带;重组RsbS 蛋白在上清和沉淀中均有表达,上清中的蛋白量略高于沉淀中的蛋白;利用His-Ni纯化柱对重组RsbS 蛋白进行亲和层析纯化,SDSPAGE结果显示蛋白纯化效果较好(图3)。BCA方法检测纯化蛋白浓度约1 μg/mL。结果表明,获得的重组RsbS蛋白具有良好的纯度和浓度,可用于后续试验。
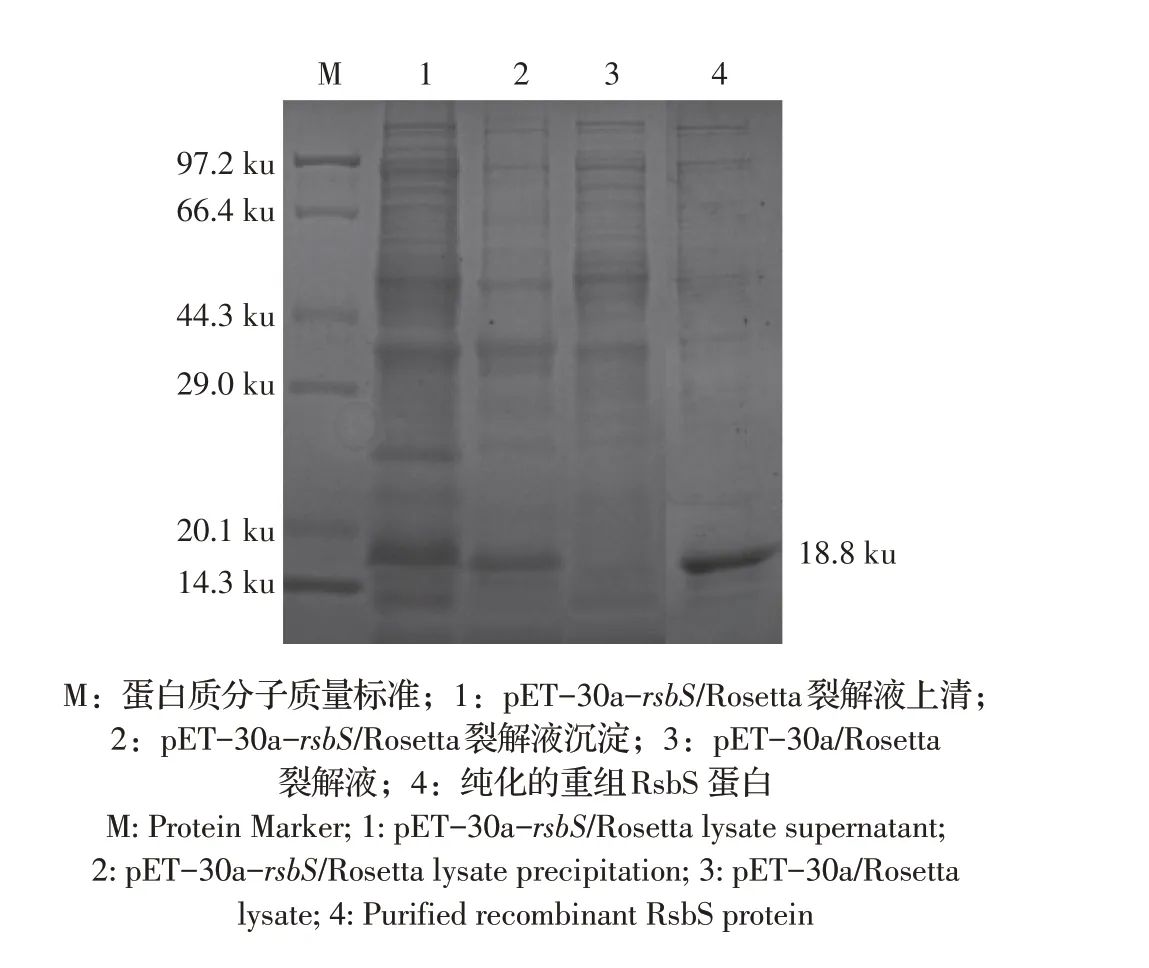
图3 重组RsbS蛋白表达及纯化的SDS-PAGE检测结果Fig.3 SDS-PAGE identification of expression and purification of recombinant RsbS protein
2.3 蛋白互作的等温滴定量热分析蛋白质间发生生化反应均会有一定程度的热量改变,等温滴定量热法是近年发展起来的用于研究生物分子间相互作用的重要技术,可灵敏的捕捉反应体系中的热量变化,通过监测体系中的热量变化确定蛋白间是否发生相互作用。利用NanoAnalyze 软件绘制RsbS 与RsbR蛋白互作的等温滴定量热曲线并计算热力学参数。图4 上半部分显示了RsbS 蛋白每次滴入RsbR 蛋白溶液中,反应体系所吸收的热量值,将上半部分图中每个峰的峰面积积分值对RsbS 与RsbR 的摩尔比作图(所有数据均已扣除背景滴定),即得出图4 下半部分的拟合曲线。图4 结果显示,每10 μL RsbS 蛋白滴定入RsbR蛋白,体系均发生了1.67 μW~3.35 μW的能量变化,对应产生的摩尔热量约为1 100 kJ/mol~2 206 kJ/mol,表明RsbS 与RsbR 蛋白间发生了反应,导致体系产生了热量变化。利用NanoAnalyze软件计算得到RsbS 与RsbR 蛋白互作的热力学参数为:结合位点数n=3.43、亲和力常数Ka 为1.48×1012L/mol、ΔH1.16×103kJ/mol、ΔS4.13 kJ/mol/K。根据蛋白互作的热力学规律可初步判断[14]:RsbS 与RsbR 间的互作为吸热反应,两个蛋白间存在至少3个结合位点,ΔS>0 且ΔH>0 表明该两个蛋白间的互作是由疏水力作用主导,提示RsbS 与RsbR 蛋白在体外存在互作。
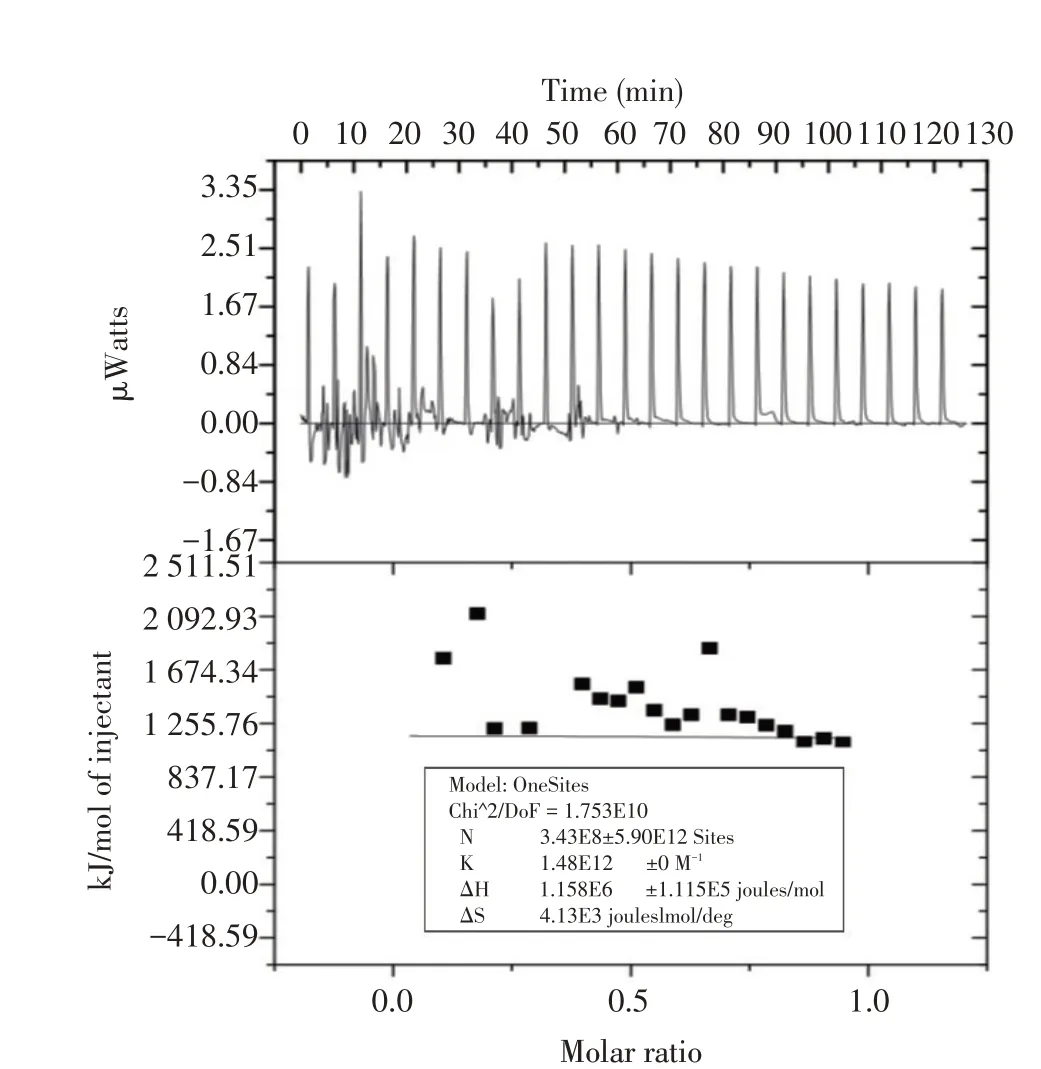
图4 RsbS与RsbR互作的等温滴定量热曲线Fig.4 Isothermal titration calorimetry curve of RsbS-RsbR binding
2.4 RsbS 多克隆抗体效价和反应原性鉴定结果将纯化的重组RsbS 蛋白经4 次免疫小鼠后,收获血清,间接ELISA 测定RsbS 多克隆抗体效价约1∶128 000(图5A)。经western blot 检验该多克隆抗体的反应原性,结果显示,Lm10403S 全菌蛋白在18.8 ku 处出现特异性条带,阴性对照RsbX 蛋白及空载体菌pET-30a/Rosetta 裂解液均未见反应条带(图5B)。表明获得的RsbS 多克隆抗体具有良好的反应原性,可以用于后续试验。
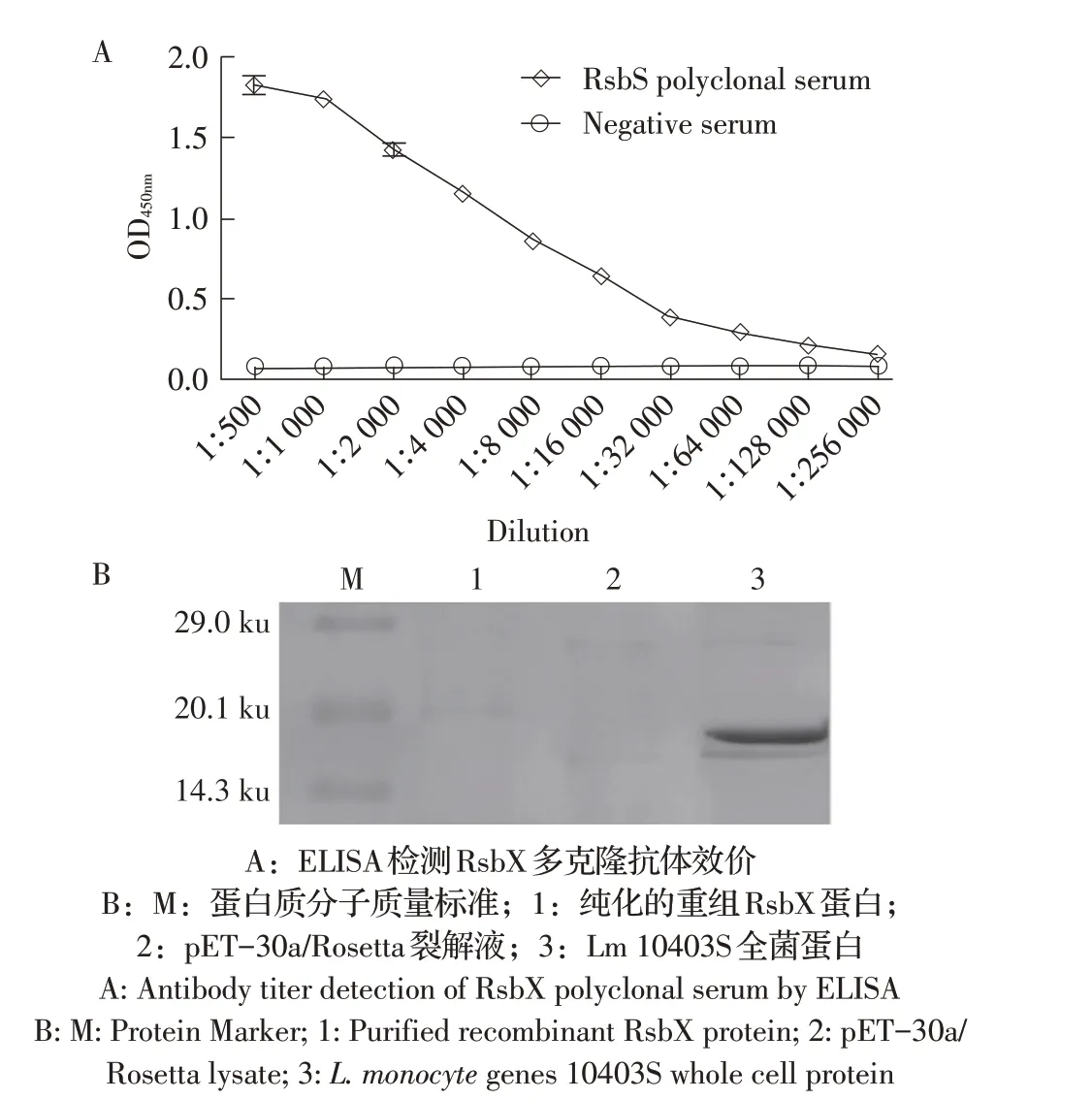
图5 RsbS多克隆抗体效价的测定(A)及western blot(B)检测结果Fig.5 Titer(A)and western blot(B)detection of RsbS polyclonal antibody
2.5 rsbS在应激条件下的转录水平分析利用qPCR检测Lm 野生株和缺失株在NaCl 应激条件下rsbS基因的转录水平。结果显示,5%NaCl 应激30 min 后,野生株10403S 中rsbS基因的转录水平显著增高,约为未应激对照组的2.10 倍(P<0.01);而缺失株ΔrsbR中rsbS基因的转录水平降低,约为对照组的61%(P<0.05),具有统计学差异(图6)。可见5% NaCl 应激会刺激LmrsbS基因的转录水平增高,提示该基因可能具有抗渗透压应激的功能;但缺失株ΔrsbR中rsbS基因在5% NaCl 应激条件下的转录水平降低,提示rsbS基因的抗渗透压应激功能可能受rsbR基因的调控。表明rsbS基因通过rsbR基因的介导而参与抗应激反应。
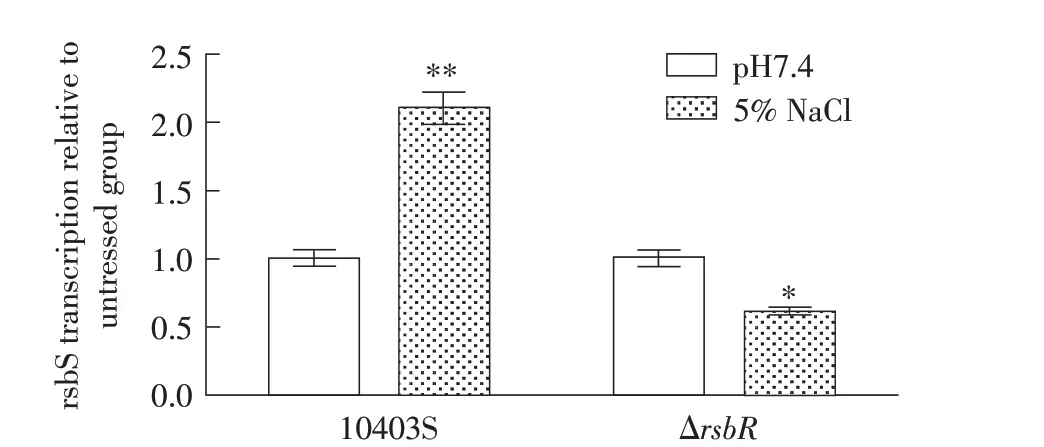
图6 Lm 10403S和ΔrsbR中rsbS基因在NaCl应激和未应激(pH7.4)条件下的转录水平差异Fig.6 Transcription difference of Listeria monocytogenes 10403S and ΔrsbR rsbS gene under NaCl stress or unstress(pH7.4)condition
2.6 RsbS 在应激条件下的表达量分析利用本研究制备的RsbS 多克隆抗体经western blot 检测Lm 野生株和缺失株在NaCl 应激条件下RsbS 蛋白的表达量。结果显示,5% NaCl 应激30 min 后,野生株10403S中RsbS 蛋白的表达量增高,约为对照组的1.53 倍(P<0.05),具有统计学差异(图7A、7B);缺失株ΔrsbR中RsbS 蛋白的表达量降低,约为对照组的51%(P<0.05),具有统计学差异(图7C、7D)。可见5%NaCl 应激会刺激Lm RsbS 蛋白的表达量增高,提示RsbS 蛋白可能参与Lm 抗渗透压应激的过程;但rsbR缺失的情况下,RsbS 蛋白在5% NaCl 应激条件下的表达量降低,提示RsbS 的抗渗透压应激作用可能需要RsbR 蛋白的协同参与。进一步验证RsbS 通过与RsbR蛋白互作参与抗应激反应。
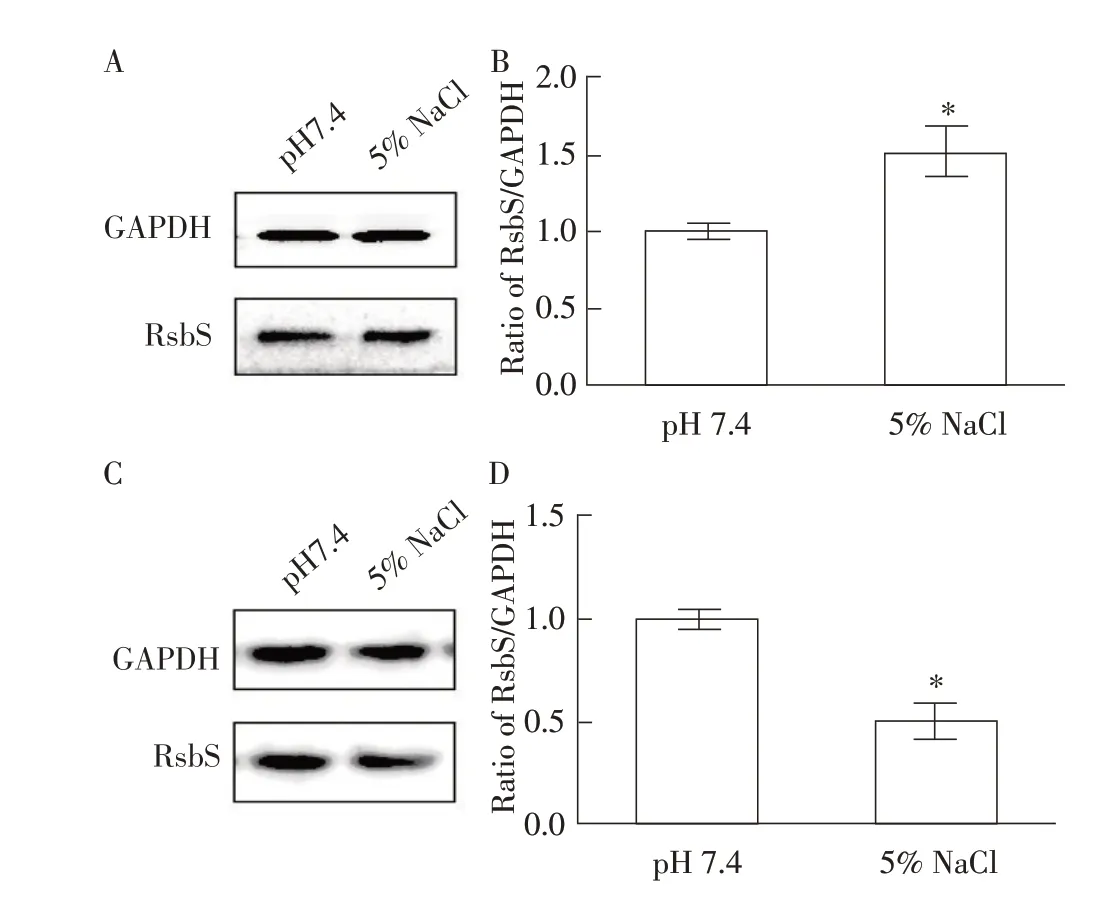
图7 Lm 10403S(A、B)和ΔrsbR(C、D)中RsbS蛋白在NaCl应激和未应激(pH7.4)条件下的表达量差异Fig.7 Expression difference of Listeria monocytogenes 10403S(A,B)or ΔrsbR(C,D)RsbS protein under NaCl stress or unstress(pH7.4)condition
3 讨 论
Lm 拥有强大的抗应激能力,σB作为该菌最重要的应激调控因子,其活性受到7 个调控操纵子(Rsbs)的精密调控。其中,RsbS 作为整条应激调控通路中的开关蛋白,其生物学功能及其在抗应激过程中发挥的作用具有重要的研究价值。
本研究通过生物信息学预测RsbS 蛋白的理化特性、三级结构和磷酸化位点,发现其与SWISSMODEL 中的模板序列枯草芽孢杆菌RsbS 蛋白的一致性高达73.28%,提示Lm RsbS 蛋白可能与枯草芽胞杆菌RsbS 蛋白拥有类似的应激调控功能[15]。本研究利用等温滴定量热技术对与RsbS 的互作蛋白进行了筛选和鉴定,发现Lm RsbS 与RsbR 蛋白存在互作反应,且两个蛋白间至少存在3 个结合位点。该结果与Reeves 等利用酵母双杂交系统验证的枯草芽胞杆菌RsbR-RsbS应激复合体相类似[16],与Dessaux等提出的渗透压应激中Lm可能瞬时存在RsbR-RsbS-RsbT复合体的假设相一致[6]。基因在应激状态下的转录和表达水平通常与其抗应激功能密切相关。进一步利用qPCR 和western blot 技术,分别对Lm 野生株和ΔrsbR缺失株在NaCl 应激条件下rsbS的转录和表达水平进行分析:检测到NaCl 应激条件下,Lm 野生株中rsbS的转录和表达水平增高,表明RsbS 蛋白通过提高表达量正向参与了Lm 的抗渗透压应激过程,本研究首次对Lm 应激状态下的rsbS水平进行了分析,所得结果与枯草芽胞杆菌RsbS 为应激正调控因子的结论一致[17];而缺失株ΔrsbR在NaCl 应激条件下rsbS的转录和表达水平均降低,提示RsbS 蛋白可能通过RsbR 的介导参与Lm 的抗渗透压应激过程,该结果进一步验证了RsbR-RsbS 蛋白互作的结论,即在RsbR 缺失的情况下,RsbS 的应激应答水平降低,提示RsbS 的抗应激功能需在RsbR 的协同作用下才能发挥。枯草芽胞杆菌RsbR-RsbS 应激体协同作用从而激发细菌应激应答的观点已被多次验证[15-19],然而在Lm 中RsbR-RsbS 应激体的研究仍处于起步阶段。综上,推测RsbS 蛋白调控Lm 的抗应激过程是一个较为复杂的多元调控方式,可能涉及到多个蛋白的互作和应激应答,且生物信息学预测RsbS 蛋白具有8 个潜在磷酸化位点,因此RsbS 是如何与互作蛋白协同作用从而直接或间接影响Lm 的应激应答,以及影响互作的关键磷酸化位点有哪些?还需要进一步研究。
本研究获得了Lm 重组RsbS 蛋白及其多克隆抗体,首次验证了其RsbS 与RsbR 蛋白的体外互作,分析了rsbS在NaCl 应激条件下的转录和表达水平,为探明Lm RsbS 蛋白的生物学功能奠定基础,为阐明RsbS 在应激调控中发挥的作用及Lm 的抗应激调控机制提供了重要基础和研究工具。

