CP 和NCP 型牛病毒性腹泻病毒腹腔注射小鼠感染模型的建立
吴陈华,王丽娜,岳 山,陈楠楠,黄雯静,高 丽,付金蕾,刘思雨,赵 童,白彤彤,苏思雨,黄 江,白彪慧,金 鑫,范春玲,2,刘 宇,2,张泽财,2,周玉龙,2,朱战波,2*
(1.黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319;2.黑龙江省牛病防控技术创新中心,黑龙江 大庆 163319)
牛病毒性腹泻/黏膜病(BVD/MD)是由牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起牛的一种接触性传染病。BVDV 是黄病毒科(Flaviridae)瘟病毒属(Pestivirus)成员,该病毒属还包括猪瘟病毒(Classical swine fever virus,CSFV)和羊边界病毒病(Border disease virus,BDV)[1]。根据是否引起细胞病变,BVDV 可分为两种生物型:致细胞病变型(Cytopathogenic,CP)和非致细胞病变型(Noncytopathogenic,NCP)[2];根据BVDV 基因序列的差异,BVDV 又可分为BVDV-1、BVDV-2 和BVDV-3 3 个基因型。由于BVDV易突变且不同的病毒株间存在同源重组现象,因此BVDV基因亚型众多,目前BVDV-1分为1a~1u共21个亚型,BVDV-2分为2a~2d共4个亚型[3]。
BVDV 的天然宿主包括牛、羊、猪和多种反刍动物,反刍动物价格高,不宜作为实验动物,因此小鼠用于BVDV 的研究更具优势。构建稳定的小鼠感染模型有助于研究BVDV 体内感染的致病机理及疫苗开发。研究显示,BVDV 急性感染后主要表现为白细胞、淋巴细胞和血小板减少等症状[4-5]。对妊娠母羊和胚胎人工感染BVDV,母羊及感染后所生的羔羊均产生了明显的临床症状,剖检可见消化道粘膜弥散性出血、肠系膜淋巴结肿大等病理变化[6]。Bachofen 等通过耳缘静脉注射、滴鼻和采食被BVDV 污染的干草等3 种接种方式感染兔子,结果显示BVDV 在回肠中的病毒载量最高,且淋巴组织表现出现了典型的病理变化[7]。Han等通过口服低剂量和高剂量的NCP型BVDV感染BALB/c 小鼠,结果显示,NCP 型BVDV 感染的BALB/c 小鼠体内的血小板降低,且高剂量感染的BALB/c 小鼠的淋巴细胞减少[8]。Seong 等通过腹腔注射和滴鼻两种感染方式对BALB/c 小鼠接种了3 株BVDV。结果显示,腹腔注射比滴鼻的感染方式成功率更高[9]。上述研究表明小鼠可以感染BVDV 并出现相应症状,有望作为BVDV 感染的动物模型,但不同生物型BVDV感染小鼠的致病性差异尚不清楚。
目前,关于BVDV 感染小鼠的致病性和动物感染模型的研究较少。为了建立CP 和NCP 型BVDV 急性感染的小鼠模型。本研究利用腹腔注射BVDV 的方式感染BALB/c 小鼠,研究感染小鼠体内白细胞、淋巴细胞、血小板和BVDV 抗原在各组织中的增殖情况,比较两种不同生物型BVDV 在小鼠血液和组织中的分布差异及病理变化,为BVDV 疫苗的研制和致病机理的研究奠定基础。
1 材料与方法
1.1 主要实验材料CP 型BVDV NADL 株及NCP 型BVDV NY-1 株、4%多聚甲醛、牛肾上皮细胞(MDBK)由本实验室保存。BVDV NPro多克隆抗体由本实验室制备;SP Kit(Broad Spectrum)(SP-0022)购自博奥森公司;DMEM 培养基购自Gibco 公司;TRIzol 购自Invitrogen 公司;苏木精-伊红染色液购自深圳市达科为生物工程有限公司;反转录试剂盒、SYBR PremixTaqII 购自TaKaRa 公司。SPF 级雌性BALB/c 小鼠(18 g~22 g)购自哈尔滨医科大学实验动物学部。
1.2 小鼠的感染试验将BALB/c 小鼠饲养在无菌条件的动物房内,适应7 d 消除应激后随机分为3组,分别为CP 组、NCP 组和对照组,每组各9 只。参照Seong 的方法将CP 组和NCP 组小鼠每只经腹腔注射0.4 mL 104TCID50/mL 相应病毒液[9],对照组每只注射0.4 mL DMEM。每天观察记录小鼠的临床症状,对死亡小鼠及时剖检并观察其剖检部位的病变情况,共观察10 d。
1.3 病料采集及小鼠血常规的检测分别于感染后第4 d、7 d 和10 d 每组各随即选择3 只小鼠,通过眼眶采集EDTA 抗凝血,使用全动物血细胞检测仪检测各组小鼠的血常规,主要包括检测其白细胞(WBC)、淋巴细胞(LYM)及血小板(PLT)数量,迫杀上述每组感染后7 d 的各3 只小鼠,观察其剖检病变。然后,采集各组小鼠粪便及心脏、肝脏、脾脏、肺脏、结肠、回肠、空肠、十二指肠等脏器。各脏器一份用于提取核酸检测病毒载量,另一份用4%多聚甲醛溶液固定,用于免疫组化和组织病理检查。
1.4 BVDV载量的荧光定量PCR检测将各组小鼠粪便用生理盐水稀释后离心取上清:各组织样品经研磨、反复冻融后,3 000 r/min 离心10 min,取上清采用TRIzol 法提取血液、粪便及各脏器组织悬液中的RNA,反转录成cDNA 后作为模板,利用本实验室建立的荧光定量PCR 方法检测各样品中的BVDV 载量[10]。上游引物:5'-GAGTACAGGGTAGTCGTCAG-3'/下游引物:5'-CTCTGCAGCACCCTATCAGG-3'。反应程序:94 ℃2 min,94 ℃15 s,60 ℃30 s,72 ℃5 min,40 个循环。
1.5 小鼠各组织免疫组化及组织病理学检查将各组小鼠各组织样品经4%甲醛中固定、酒精脱水、石蜡包埋、制备组织切片。以NPro多克隆抗体(1∶600)为一抗孵育过夜。以SP-022 生物素标记的山羊抗兔、大鼠、小鼠和豚鼠IgG 广谱抗体为二抗孵育1 h。经免疫组化检测各组织中的BVDV 抗原的分布;将另一部分各组织切片经苏木精/伊红染色(HE)后,经显微镜观察各组织(脾脏、肝脏和肠)的病理变化。
1.6 数据分析每个试验均重复3 次获得相应的结果后采用GraphPad Prism 6.0 软件对试验数据作图及分析,并采用SPSS 19.0 对检测结果进行单因素方差分析,P<0.05 为差异显著。
2 结 果
2.1 感染后小鼠的临床症状以及剖检病理变化分别通过腹腔注射感染CP 型和NCP 型BVDV 后,大部分小鼠均表现出一定的临床症状。主要表现为被毛粗糙、聚堆、精神沉郁、采食减少等。对照组小鼠无明显的临床症状。分别将CP 和NCP 型BVDV 感染后第7 d 的小鼠剖检均可见肺和肝有出血点,脾肿大,肠道内容物呈黄色水样状,对照组小鼠无明显的病理变化。结果表明两种生物型的BVDV 感染后均造成了小鼠一定的临床症状及剖检病变。
2.2 小鼠的血常规检测结果小鼠腹腔注射两种生物型BVDV 后的第4 d、7 d、10 d 采血进行血常规测定,结果显示,感染后的不同时间,CP 组和NCP 组小鼠血液中的白细胞、淋巴细胞和血小板的数量均低于对照组。感染后第7 d,CP 组与NCP 组小鼠血液中的白细胞、淋巴细胞和血小板数量与对照组相比差异均极显著(P<0.001);感染后第10 d,CP 组小鼠血液中的白细胞、淋巴细胞和血小板数量与对照组相比差异均极显著(P<0.01),NCP 组小鼠血小板数量与对照组相比差异极显著(P<0.01),淋巴细胞数量差异显著(P<0.05),白细胞数量无明显差异。且感染后第7 d 和第10 d CP 组小鼠的白细胞、淋巴细胞和血小板的数量均低于NCP 组(图1),结果表明小鼠出现了BVDV 急性感染后的白细胞、淋巴细胞和血小板减少等症状,且CP 型BVDV 比NCP型BVDV 对小鼠的致病性更强。
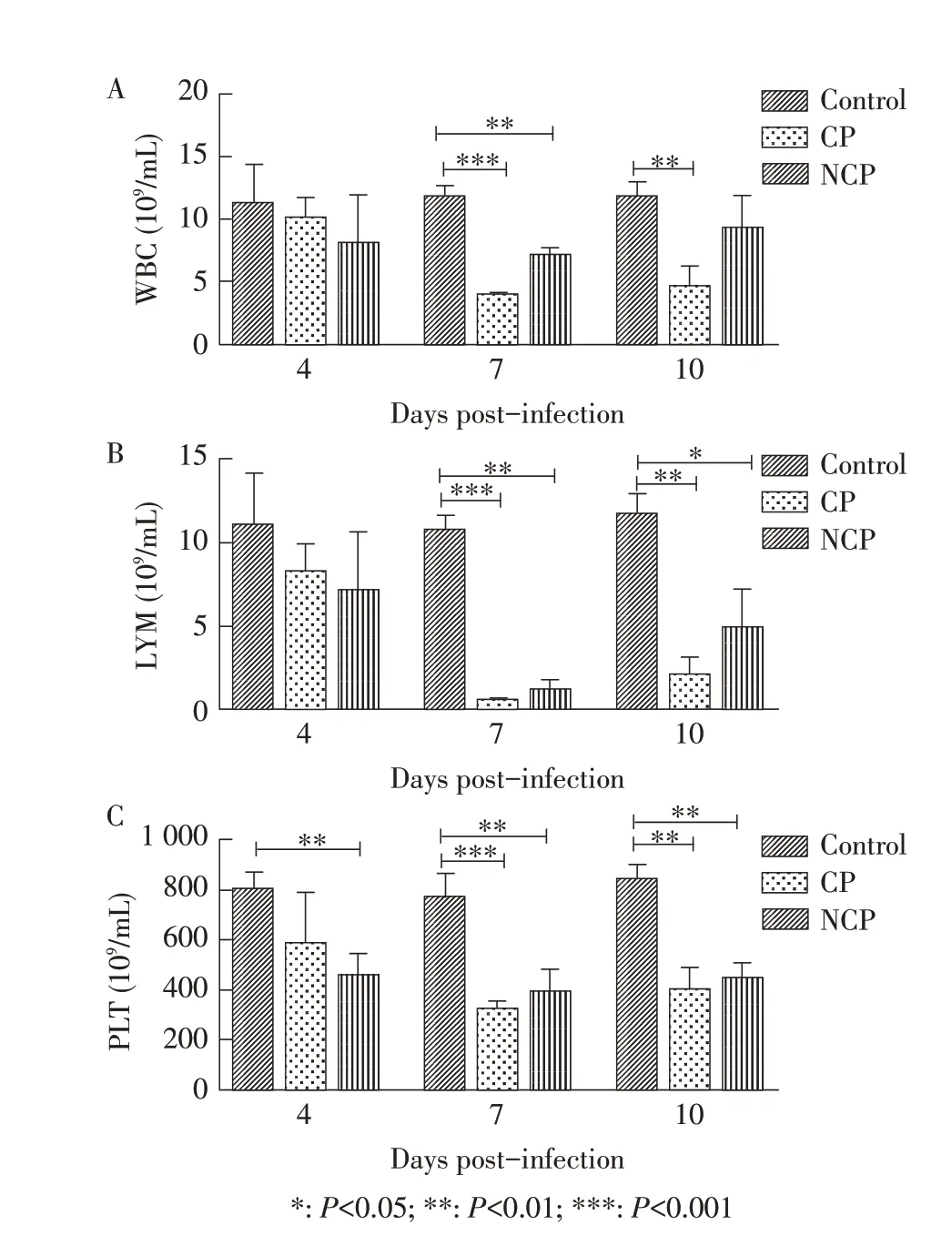
图1 感染BVDV后小鼠体内白细胞(A)、淋巴细胞(B)及血小板数量(C)的测定结果Fig.1 Determination of leukocytes(A),lymphocytes(B)and platelets(C)in mice infected with BVDV
2.3 小鼠BVDV 载量的荧光定量PCR 检测结果小鼠腹腔注射不同生物型BVDV后的第4 d、7 d、10 d采集其各组织样品、粪便和血液样品,进行病毒载量的检测。结果显示:感染后第4 d CP组小鼠除了空肠以外的其他组织均能检测到病毒,NCP组小鼠除了结肠以外的其他组织均能检测到病毒(图2A);感染后第7 d CP 组和NCP 组小鼠的各组织中均能检测到病毒(图2B);感染后第10 d CP 组小鼠除了肝脏、十二指肠和结肠以外的其他组织均能检测到病毒,NCP组小鼠除了肺脏以外的其他组织均能检测到病毒(图2C)。病毒载量结果显示,感染后第7 d 小鼠大部分组织中的病毒载量高于感染后第4 d 和第10 d 小鼠组织中的病毒载量,两种生物型BVDV 感染小鼠后不同时间血液中的病毒载量均较高。对照组小鼠各组织均未检测到相应病毒(图2)。表明小鼠在感染BVDV 后第7 d的病毒载量最高,且血液和脾脏最适用于BVDV的检测。
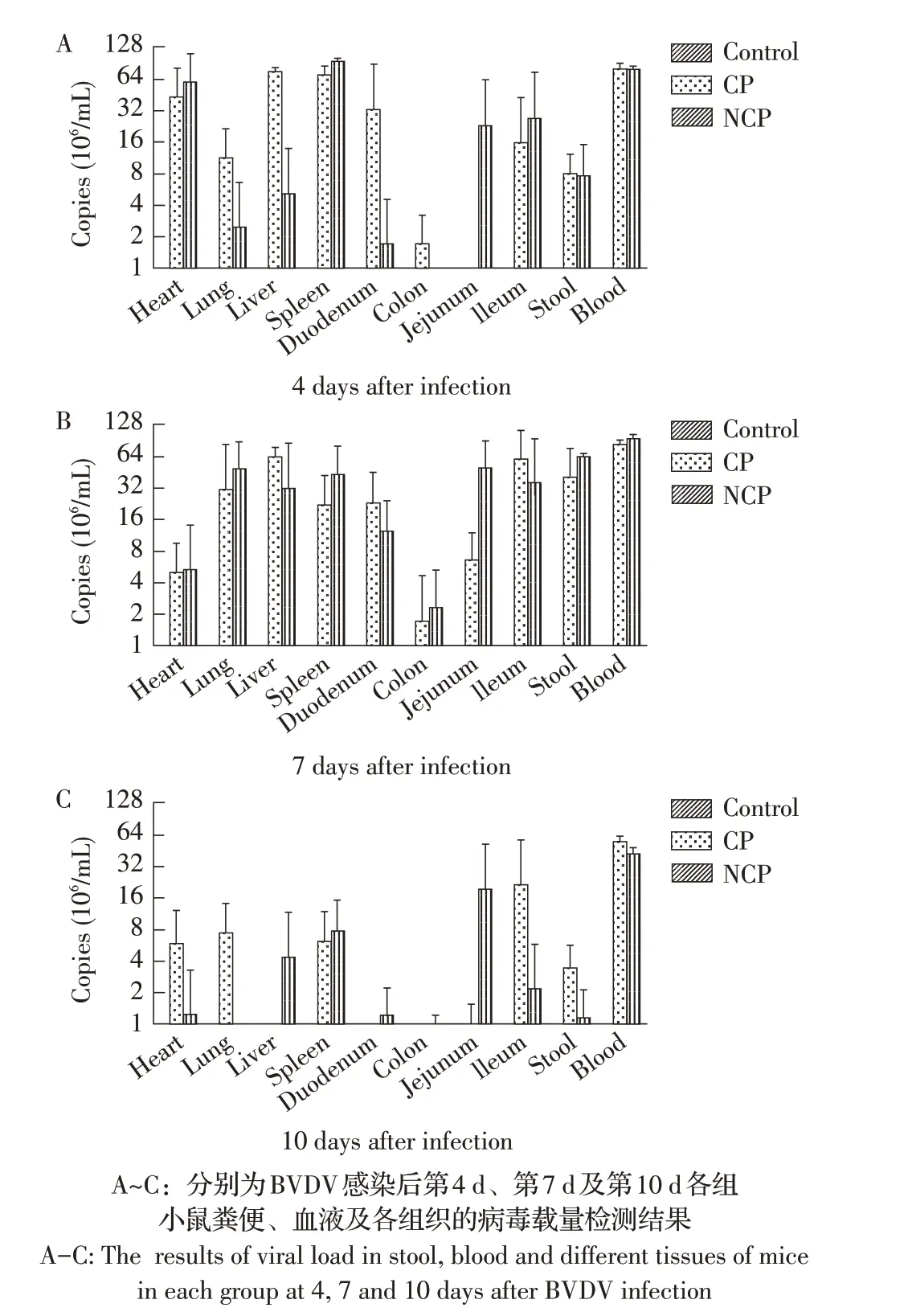
图2 BVDV载量的荧光定量PCR检测结果Fig.2 The BVDV viral load detected by real-time fluorescence quantitative PCR
2.4 小鼠各组织的免疫组化结果对BVDV感染后第7 d小鼠的各组织进行了免疫组化检测。结果显示,CP组:十二指肠黏膜上皮细胞和肠腺上皮细胞(图3A)、肝细胞(图3D)、脾脏淋巴细胞中均呈BVDV阳性(图3G)。NCP 组:十二指肠黏膜上皮细胞、肠腺上皮细胞(图3B)、肝脏中的巨噬细胞(图3E)、脾脏淋巴细胞均呈BVDV阳性(图3H)。对照组小鼠各组织则均为阴性结果(图3C、图3F、图3I)。感染后第7dCP组和NCP组小鼠各组织中均检测到了BVDV 抗原,均呈阳性结果。结果表明CP型和NCP型BVDV均能侵染小鼠各组织。

图3 小鼠各组织的免疫组化结果(400×)Fig.3 Immunohistochemical results of various organs in mice
2.5 小鼠各组织病理变化的观察结果通过显微镜观察各组小鼠感染后第7 d 的组织病理切片,结果可见CP 组小鼠十二指肠肠腺上皮变性坏死脱落、间质疏松水肿和炎性细胞浸润(图4A),肝细胞肿胀、空泡变性和坏死(图4D),脾脏间质疏松水肿(图4G);NCP组小鼠十二指肠黏膜上皮细胞变性、坏死、脱落(图4B),肝脏肝血窦可见淋巴细胞炎性浸润(图4E),脾脏淋巴细胞可见变性和坏死(图4H)。对照组小鼠各组织均无明显病理变化(图4C、图4F、图4I)。结果表明,两种生物型BVDV 感染后均可致小鼠组织的病理损伤,CP组小鼠组织损伤较NCP组小鼠严重,同时表明本研究建立了CP 和NCP BVDV 小鼠的急性感染模型。
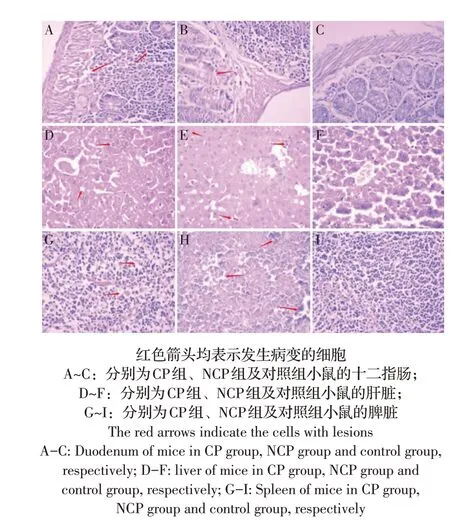
图4 小鼠各组织的病理变化(HE染色,400×)Fig.4 Histopathological changes in different tissues in mice(HE staining)
3 讨 论
BVDV 能够致牛的呼吸系统发病、并能致其腹泻和生殖障碍,给世界养牛业造成了重大的经济损失[11]。有研究表明BVDV 接种妊娠母羊和胚胎后,产生了明显的临床症状[7]。有研究结果表明,新西兰兔食用了被BVDV 污染的干草后,在其大多数器官检测到了BVDV,且组织淋巴出现了典型病变[6]。与兔和羊作为实验动物相比较,小鼠作为实验动物更有利于BVDV 的研究。有研究表明将BVDV 以腹腔注射的方式感染BALB/c 小鼠建立感染模型的成功率更高[9]。所以本研究采用该方式感染BALB/c 小鼠。
本研究将CP 型BVDV NADL 株和NCP 型NY-1株分别通过腹腔注射感染BALB/c 小鼠后,大部分小鼠出现了背毛粗糙、扎堆、精神萎靡等临床症状,但在本研究中两组小鼠均未出现腹泻的临床症状。在感染后7 d 剖检两组感染小鼠可观察到其肝脏、心脏和肺脏均有出血点,脾肿大,且病理切片结果显示感染后7 d 两组感染小鼠的十二指肠黏膜上皮细胞变性、坏死、脱落。表明感染后的小鼠虽然未出现腹泻的临床症状,但在肠道和各脏器中均出现了病理变化,初步证明BVDV 能够感染BALB/c 小鼠,且能致其组织出现相应病变。
有研究显示,BVDV 急性感染犊牛后白细胞、淋巴细胞和血小板的数量均降低[5];BVDV 急性感染BALB/c 小鼠后出现了白细胞降低及淋巴细胞减少的症状[8],与本研究的结果相似。血常规检测结果显示,与对照组相比,在感染后第4 d、7 d 和10 d,CP组和NCP 组小鼠血液中的白细胞、淋巴细胞和血小板数量均降低。感染后第7 d 和10 d CP 组小鼠的白细胞、淋巴细胞和血小板的数量均比NCP 组的低,由此推测CP 型BVDV 比NCP 型BVDV 对小鼠的致病性更强。
本研究利用荧光定量PCR 方法检测感染组小鼠的心脏、肝脏、脾脏、肺脏和空肠等组织以及粪便和血液中的BVDV 载量。结果显示,在感染后第7 d CP 组和NCP 组的各组织、粪便和血液中均能检测到病毒,且在小鼠血液中的BVDV 载量最高。有研究将CP 型BVDV 通过腹腔注射的方式感染小鼠,在感染组的肺脏和肝脏中BVDV 的检出率最高[12],这与本研究结果有差异。推测这一差异可能是病毒株和感染的病毒量不同所致。
Seong 等通过腹腔注射的方式将BVDV-1 感染BALB/c 小鼠,免疫组化结果显示,在感染后第7 d小鼠的肺脏、脾脏和肠等脏器中均检测到了BVDV抗原[13]。本研究中感染后第7 d 小鼠的脾脏、肝脏和肠均能检测到BVDV 抗原。与上述研究结果相符。本研究中感染组小鼠组织的病理切片观察可见十二指肠肠腺上皮变性、坏死、脱落、炎性细胞浸润、肠黏膜坏死、脱落,肝细胞坏死、肝血窦淋巴细胞炎性浸润,脾脏淋巴细胞可见变性和坏死等病理变化。且CP 组小鼠组织病变较NCP 组小鼠严重。Seong 等通过腹腔注射和滴鼻的方式将NCP 型BVDV-1 感染BALB/c 小鼠,组织病理切片观察结果显示,两种感染方式感染小鼠的肝脏均出现炎性细胞浸润和中性粒细胞增多等病理变化[9]。以上研究结果均表明,CP 和NCP 型BVDV 感染BALB/c 小鼠后均可在其各组织中检测到BVDV 抗原,且均能致其组织出现一定的病理损伤。
本研究通过腹腔注射的方式将CP 型和NCP 型BVDV 感染BALB/c 小鼠。根据临床症状和病理变化,血常规、病毒载量及抗原组织分布、免疫组化等结果表明,建立了两种不同生物型BVDV 急性感染的小鼠模型。为进一步对BVDV 的疫苗研制和致病机理等研究奠定了基础。

