高表达活化白细胞黏附分子对胃癌细胞增殖能力的影响
尚万兵,王 变
(新乡医学院法医学院,河南 新乡 453003)
胃癌是常见的恶性肿瘤,其主要治疗方式为手术切除,早期胃癌患者术后5 a生存率可达90%以上,但因胃癌早期临床症状不明显,多数胃癌患者在确诊时已处于中晚期,治疗效果不理想[1-3]。因此,深入探究胃癌的发生、发展机制,明确相关肿瘤标志物,以及研发分子靶向药物等对胃癌的早期诊断、治疗和预后具有重要的价值。活化白细胞黏附分子(activated leukocyte cell adhesion molecule,ALCAM)又称CD166,是免疫球蛋白超家族成员之一,广泛存在于各组织器官中,可通过其黏附作用介导细胞间的相互作用,参与多种生理、病理过程[4-5]。有研究发现,CD166在胃癌中高表达[6],但其如何影响胃癌的发生尚不清楚,基于此,本研究观察CD166对胃癌细胞增殖能力的影响,进一步探讨CD166在胃癌发生、发展中的分子作用机制。
1 材料与方法
1.1 实验动物、细胞、试剂与仪器6~8周龄BALB/c裸鼠(18~23 g)购自北京维通利华实验动物有限公司;人胃癌细胞株AZ-521购自南京科佰生物科技有限公司;RNA提取试剂和反转录试剂购自天根生化科技(北京)有限公司,荧光定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)试剂盒购自美国Bio-Rad公司,达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)培养基、胎牛血清和脂质体2000试剂盒购自美国Invitrogen公司,兔抗CD166多克隆抗体购自美国Abcam公司,小鼠抗β-肌动蛋白(β-actin)单克隆抗体购自武汉博士德生物工程有限公司,辣根过氧化物酶(horse radish peroxidase,HRP)标记的羊抗兔二抗购自北京中杉金桥生物技术有限公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自上海碧云天生物技术研究所;pLOX-CWBmi1-CD166慢病毒质粒由上海吉凯基因化学技术有限公司构建;SpectraMax L酶标仪购自美国Molecular Devices公司,CFX96型实时荧光PCR仪购自美国Bio-Rad公司。
1.2 细胞培养与转染将AZ-521细胞接种于含体积分数10%胎牛血清、体积分数1%青链霉素的高糖DMEM培养基中,于37 ℃、含体积分数5% CO2的恒温箱中培养并传代。取对数生长期AZ-521细胞分为对照组和CD166组,待细胞融合至60%左右时,参照脂质体2000试剂盒说明书进行细胞转染。对照组细胞转染慢病毒空载质粒,CD166组细胞转染pLOX-CWBmi1-CD166慢病毒质粒,8 h后于DMEM培养基继续培养48 h进行后续实验。
1.3 qPCR法检测AZ-521细胞中CD166 mRNA表达水平根据CD166 mRNA序列,设计荧光定量PCR引物,CD166上游引物序列为5′-GATCTCCGCCACCGTCTTCAG-3′;CD166下游引物序列为5′-CGTCGTACTGCACACTTTTC-3′。取对照组和CD166组细胞,采用RNA提取试剂盒提取RNA,并通过反转录试剂盒反转录为cDNA。PCR体系:荧光染料 10 μL,上下游引物各0.6 μL,cDNA 8.8 μL,总体积20 μL。PCR反应条件:94 ℃预变性 5 min,94 ℃变性30 s,58 ℃退火30 s,40个循环。采用2-ΔΔCt法计算2组细胞中CD166 mRNA相对表达量。
1.4 Western blot法检测AZ-521细胞中CD166蛋白的表达收集对照组和CD166组细胞,加入1×上样缓冲液,沸水浴中煮20 min;然后进行聚丙烯酰胺凝胶电泳,结束后将蛋白转移至聚偏二氟乙烯膜上,质量分数5%脱脂奶粉封闭120 min,CD166兔多克隆抗体、β-actin小鼠单克隆抗体 4 ℃孵育过夜,抗体稀释液洗涤3次,每次5 min;HRP标记的羊抗兔二抗室温孵育1 h,加入含Twen-20的磷酸盐缓冲液洗涤3次,每次5 min;暗室中发光显影,扫描蛋白条带,应用Image J软件检测蛋白条带灰度值。以β-actin为内参,计算CD166蛋白的相对表达量。
1.5 CCK-8检测AZ-521细胞增殖能力取对数生长期对照组和CD166组AZ-521细胞,胰蛋白酶消化后接种于96孔板中(每孔8×103个细胞,每孔100 μL),分别培养12、24、48 h,培养结束后每孔加入10 μL CCK-8工作液,37 ℃下避光反应4 h,然后用酶标仪检测各孔在450 nm处的吸光度值,吸光度值越高,表示细胞增殖能力越强。每组设3个复孔,取均值。
1.6 吉姆萨染色检测AZ-521细胞克隆形成能力取对数生长期对照组和CD166组细胞用胰蛋白酶进行消化,分别取100个细胞接种于6孔板中,放置培养箱中继续培养,每隔2 d更换1次培养基,至第12天时细胞克隆基本形成。弃培养基,磷酸盐缓冲溶液洗1遍,室温下甲醇固定10 min,双蒸水清洗1遍,超净台风干。加入吉姆萨染液染色20 min,双蒸水清洗1遍,超净台风干。统计50个细胞以上的克隆数目。每组设3个复孔,取均值。
1.7 动物肿瘤模型制备将46只裸鼠随机分为对照组和CD166组,每组23只。2组裸鼠称质量后腹腔注射戊巴比妥(40 mg·kg-1)进行麻醉,待小鼠失去意识后,于小鼠左侧腋下接种对照组细胞(1×106个),于右侧腋下接种CD166组细胞(1×106个),观察并统计2组小鼠存活情况和成瘤状况,连续统计30 d。
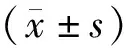
2 结果
2.1 对照组与CD166组AZ-521细胞中CD166 mRNA 及蛋白相对表达量比较结果见图1。对照组和CD166组AZ-521 细胞中CD166 mRNA相对表达量分别为1.21±0.24、3.58±0.56,CD166蛋白相对表达量分别为0.32±0.08、1.41±0.21;CD166组 AZ-521 细胞中CD166 mRNA及蛋白相对表达量均高于对照组,差异有统计学意义(t=6.738、8.401,P<0.05)。

图1 对照组和CD166组AZ-521细胞中CD166蛋白表达(Western blot)
2.2 对照组与CD166组AZ-521细胞增殖能力的比较结果见表1。培养12、24 h时,对照组与CD166组AZ-521细胞增殖能力比较差异无统计学意义(P>0.05);培养48 h时,CD166组AZ-521细胞的增殖能力显著高于对照组,差异有统计学意义(P<0.05)。

表1 对照组与CD166组AZ-521细胞增殖能力比较
2.3 对照组与CD166组AZ-521细胞克隆形成能力比较结果见图2。对照组和CD166组AZ-521细胞克隆形成数分别为(28.96±5.63)、(52.01±6.01)个;CD166组AZ-521细胞克隆形成数显著高于对照组,差异有统计学意义(t=4.848,P<0.05)。

图2 对照组和CD166组AZ-521细胞克隆形成情况(吉姆萨染色,×200)
2.4 动物模型成瘤结果移植瘤模型小鼠肿瘤生长曲线见图3。肿瘤建模过程中,对照组小鼠死亡1只,未成瘤1只;CD166组小鼠死亡2只,其余均建模成功。第30 天时,CD166组小鼠的肿瘤体积显著大于对照组,差异有统计学意义(t=1.291,P<0.05)。
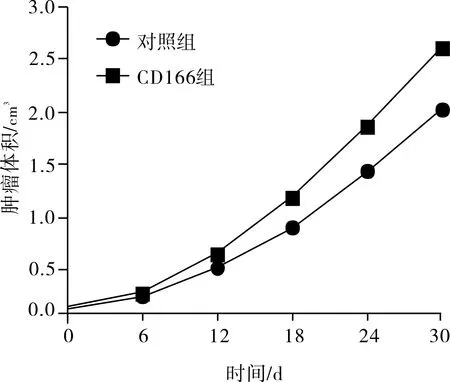
图3 对照细胞和CD166组小鼠肿瘤生长曲线
3 讨论
CD166为免疫球蛋白家族的一类单链跨膜糖蛋白,是淋巴细胞抗原CD6的配体,广泛分布于活化的白细胞、内皮细胞、单核细胞、神经元、造血干细胞、间叶组织干细胞等多种细胞中,参与机体的细胞黏附、造血、炎症等多种生物学过程[7-9]。近年来诸多研究显示,CD166参与多种肿瘤的发生与发展,对肿瘤细胞的生长和转移具有调控作用[10-11]。目前研究显示,CD166在恶性黑色素瘤、胰腺癌、食管癌、前列腺癌、结直肠癌以及乳腺癌中高表达,并与肿瘤的生长和浸润侵袭密切相关[12-16]。但关于胃癌组织中CD166表达及作用机制的研究较少,本研究旨在探究高表达CD166与胃癌细胞生物学行为的关系。
本研究发现,高表达CD166的AZ-521细胞增殖能力、细胞形成克隆能力及成瘤能力均明显提高;提示高表达CD166与肿瘤细胞的增殖密切相关。已有研究证明,CD166可能是通过以下途径促进肿瘤发生和浸润侵袭:CD166可促进前体基质金属蛋白酶-2向活化基质金属蛋白酶-2的转变,而基质金属蛋白酶-2在细胞外基质和基底膜的降解中起着重要作用,细胞外基质的加速降解又促进了肿瘤的浸润转移[17]。但也有研究表明,在某些肿瘤中CD166表达减弱,降低了细胞的黏附能力和能动性,从而促进了肿瘤的远处转移[18]。因此,CD166在不同肿瘤发生、发展中所扮演的角色仍需进一步研究和探索。
综上所述,高表达CD166可促进胃癌细胞的增殖及生长,加快胃癌的发展进程,检测胃组织中CD166的表达对胃癌的早期鉴定、治疗及预后评估具有一定的参考价值。

