高迁移率族蛋白1和Toll样受体9在氧诱导视网膜病变小鼠视网膜中的表达及作用
梁晓洁,刘向玲,李晓鹏
(1.新乡医学院第三临床学院,河南 新乡 453003;2.新乡医学院第三附属医院眼科,河南 新乡 453003)
早产儿视网膜病变(retinopathy of prematurity,ROP)是指由低胎龄、低体质量、缺氧、炎症和感染等因素引起的视网膜血管发育异常的可致盲眼底疾病,其病理机制尚未阐明[1]。近年来,炎症与ROP新生血管形成之间的关系备受关注。新生血管形成涉及多种因子和信号通路,除了熟知的血管内皮生长因子、缺氧诱导因子1α、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、成纤维生长因子和胎盘生长因子等,深入了解和探索视网膜新生血管形成的其他致病因子对于开发ROP的治疗药物至关重要。高迁移率族蛋白B1(high mobility group box 1,HMGB1)作为一种高度保守的核DNA结合蛋白,是炎症反应中重要的炎症介质或促炎细胞因子。HMGB1作为在缺氧期间典型的损伤相关模式分子(damage associated molecular patterns,DAMP)或警报蛋白,可被迅速释放到细胞外,在炎症、脓毒血症、肿瘤、自身免疫性疾病及血管病变中起到非常重要的作用[2]。Toll样受体(toll like receptor,TLR)9可特异性识别存在于细菌和病毒中的核酸序列,且其是识别细菌DNA中胞嘧啶鸟嘌呤二核苷酸(cytidine-phosphate-guanosine,CpG)模体的主要受体。TLR9可与特异性配体CpG相结合,激活先天免疫系统,参与缺血引发的炎症反应[3-4]。既往关于心肌梗死后组织修复的研究发现,HMGB1可通过其受体TLR9参与伤口愈合和缺血后的血管生成[5]。基于此,本研究观察HMGB1和TLR9在氧诱导视网膜病变(oxygen-induced retinopathy,OIR)小鼠视网膜组织中的表达变化,探讨其在OIR发病机制中的作用及相关机制,旨在为ROP临床药物的开发提供新靶点。
1 材料与方法
1.1 实验动物、试剂及仪器7日龄清洁级C57BL/6J小鼠30只,体质量2.0~3.0 g,购自维通利华北京总公司。兔多克隆抗体HMGB1、β-actin购自美国Abcam公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG、兔多克隆抗体TLR9(A14642)购自武汉爱博泰克生物科技有限公司,兔多克隆抗体TLR9(GB11266)、荧光二抗CY3标记山羊抗兔(GB21303)、自发荧光淬灭剂(G0002)及眼球固定液购自武汉塞维尔生物科技有限公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒购自上海碧云天生物技术公司,凝集素B4(isolectin B4,IB4)-594(Alexa Fluor 594-I21413)购自美国赛默飞世尔科技公司。智能控氧仪购自杭州艾普仪器设备有限公司,包埋机购自武汉俊杰电子有限公司,正置荧光显微镜购自日本尼康公司,共聚焦显微镜购自上海仁科生物有限公司,发光仪购自上海天能科技有限公司,TECAN多功能酶标仪由新乡医学院神经精神研究院提供。
1.2 方法
1.2.1 实验分组及OIR模型建立将30只7日龄清洁级C57BL/6J小鼠按随机数字表法分为OIR组和对照组,每组15只。OIR组小鼠和哺乳母鼠放入含体积分数(75±2)%氧气的氧箱中饲养 5 d,每24 h更换一次哺乳母鼠,防止哺乳母鼠氧中毒死亡,5 d后将哺乳母鼠及小鼠重新放回正常空气环境中饲养。对照组小鼠和哺乳母鼠于正常空气环境下饲养。
1.2.2 视网膜铺片法观察小鼠视网膜血管分布及形态参考HE等[6]的方法进行视网膜铺片和染色。具体操作方法:每组小鼠于17日龄时随机取3只,断头处死,取6只眼球置于40 g·L-1多聚甲醛溶液中固定30 min,刺破角膜再固定20 min,磷酸盐缓冲溶液(phosphate buffer saline,PBS)清洗数次;用有齿镊夹住角膜穿刺口,沿穿刺口剪开角膜(剪至锯齿缘时,注意只剪外层巩膜及色素膜);一直延伸至视神经处,用有齿镊夹住两侧巩膜,轻轻向两边撕开(注意不要撕烂视网膜),小心去除晶状体及玻璃体,留下视网膜,无齿镊小心夹住锯齿缘,以视盘为中心将视网膜剪为四叶草形状。按说明书配制IB4-594溶液:500 g IB4粉末和500 μL 氯化钙(1 mmol·L-1)制成重组凝集素,然后再加入49 mL氯化钙(1 mmol·L-1)和500 mL 叠氮化钠(200 mmol·L-1),将剪裁好的视网膜放入500 mL配制好的IB4-594溶液中避光 4 ℃ 下过夜染色,PBS清洗数次后将视网膜内层朝上平铺于载玻片,吸水纸吸去水分,甘油明胶封片;共聚焦显微镜下观察血管分布及形态变化。
1.2.3 免疫荧光染色检测小鼠视网膜中HMGB1和TLR9蛋白表达每组小鼠于17日龄时随机取4只,断头处死,取8只眼球置于40 g·L-1多聚甲醛固定,石蜡包埋,自视神经处连续切片,每间隔6张取1张,切片厚度5 μm。将切片脱蜡,置于盛满pH 6.0的柠檬酸抗原修复缓冲液的修复盒中,于微波炉内进行抗原修复。切片稍甩干后,使用组织化学笔在组织周围画圈并在圈内加入自发荧光淬灭剂5 min,流水冲洗10 min,牛血清白蛋白孵育30 min;滴加抗HMGB1一抗(滴度为1800)、TLR9一抗(GB11266)(滴度为1100),4 ℃孵育过夜,然后使用PBS洗涤3次,滴加山羊抗兔荧光二抗(1300),室温下避光孵育50 min;再使用PBS洗涤3次,滴加二脒基苯基吲哚染液,室温避光孵育10 min;PBS洗涤3次,抗荧光淬灭封片剂封片,荧光显微镜下观察并采集图像,使用Image J 软件计算荧光强度。
1.2.4 Western blot法检测小鼠视网膜中HMGB1和TLR9蛋白表达小鼠于17日龄时每组随机取3只,断头处死,摘取眼球,同“1.2.2”项方法完整分离视网膜,使用放射免疫沉淀法裂解缓冲液(radio immunoprecipitation assay lysis buffer,RIPA)冰上充分裂解组织,4 ℃ 12 000 r·min-1离心10 min提取总蛋白,BCA法测总蛋白浓度,蛋白定量后加入上样缓冲液煮沸;胶板灌注质量分数10%分离胶和质量分数5%浓缩胶,30 min后移入电泳槽,加电泳缓冲液,加样孔加样并电泳,电压 80 V,待蛋白样品通过浓缩胶进入分离胶界面时,调至恒压 120 V;冰盒内进行转膜,恒流300 mA,时间 90 min,结束后在聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上做好标记,将PVDF膜放入脱脂牛奶中封闭2 h;滴加HMGB1一抗(滴度110 000)、TLR9一抗(A14642)(滴度11 000)和内参β-actin(滴度15 000),4 ℃孵育过夜,使用TBST缓冲液洗膜3次,每次10 min;滴加HRP山羊抗兔IgG二抗(滴度15 000),室温孵育2 h,TBST洗膜3次,每次10 min;11配制发光液,混匀后用锡箔纸包好避光,均匀滴在PVDF膜上,使用发光仪进行发光并采集图像,Image J 软件进行灰度值分析,以目的蛋白灰度值与内参蛋白灰度值的比值表示目的蛋白相对表达量。
2 结果
2.1 2组小鼠视网膜血管形态变化结果见图1。对照组小鼠视网膜完全血管化,自视盘中心向四周放射状均匀分布,血管形态及走形正常。OIR组小鼠视网膜中央处可见血管闭塞区,闭塞区周边可见大量新生血管簇,视网膜血管走形迂曲。
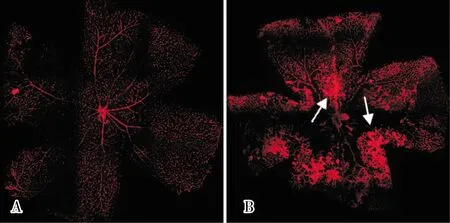
A:对照组;B:OIR组;白色箭头所指为新生血管族。
2.2 2组小鼠视网膜中HMGB1和TLR9蛋白表达免疫荧光染色结果比较结果见图2和表1。对照组小鼠视网膜各层间结构整齐,HMGB1蛋白呈红色,主要表达于神经节细胞层,在内核层及外核层可见少量表达(图2A);OIR组小鼠视网膜增厚,各层间结构紊乱,组织紧密度降低,HMGB1蛋白呈红色,在神经节细胞层、内核层、外核层表达明显增多(图2B)。对照组小鼠视网膜中TLR9蛋白(红色)主要表达于神经节细胞层、内核层(图2C);OIR组小鼠视网膜中TLR9蛋白(红色)在神经节细胞层及内核层的阳性表达增加(图2D)。OIR组小鼠视网膜中HMGB1、TLR9蛋白荧光强度值显著高于对照组,差异有统计学意义(P<0.05)。
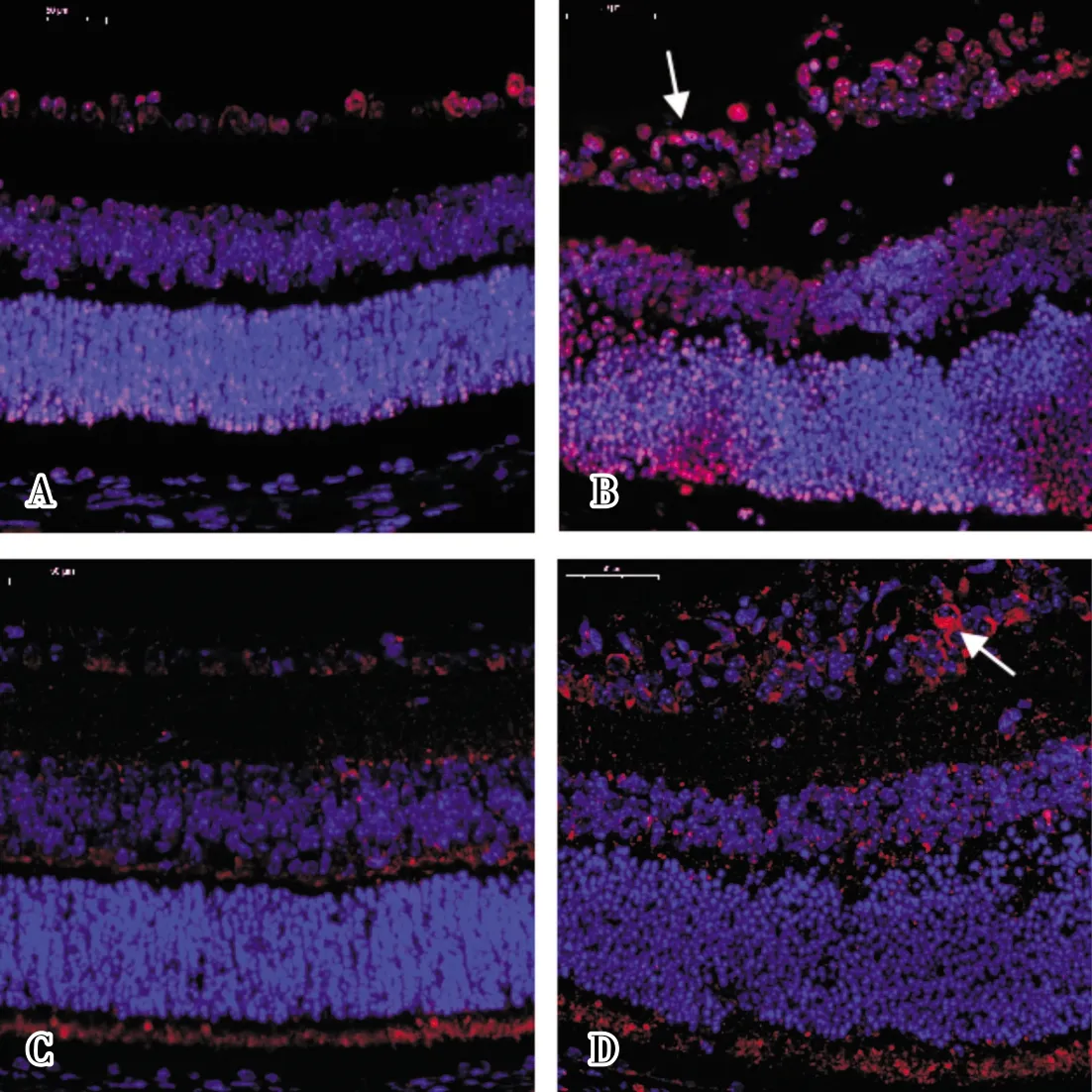
A:对照组小鼠视网膜中HMGB1蛋白表达;B:OIR组小鼠视网膜中HMGB1蛋白表达;C:对照组小鼠视网膜中TLR9蛋白表达;D:OIR组小鼠视网膜中TLR9蛋白表达。

表1 2组小鼠视网膜中HMGB1和TLR9蛋白表达比较
2.3 2组小鼠视网膜中HMGB1和TLR9蛋白表达Western blot检测结果比较结果见图3和表2。HMGB1法蛋白印迹条带表达于相对分子质量约25 000 区域,OIR组小鼠视网膜中HMGB1蛋白相对表达量显著高于对照组,差异有统计学意义(P<0.05)。TLR9蛋白印迹条带表达于相对分子质量约125 000区域,OIR组小鼠视网膜中TLR9蛋白相对表达量显著高于对照组,差异有统计学意义(P<0.05)。

1:对照组;2:OIR组。

表2 2组小鼠视网膜中HMGB1和TLR9蛋白相对表达量比较
3 讨论
OIR小鼠模型是目前研究ROP应用最广泛的模型。STAHL等[7]研究表明,出生第7天的小鼠放入含体积分数(75±2)%氧的高浓度氧箱中5 d后,小鼠的视网膜血管收缩,视网膜中央不成熟的毛细血管发生退行改变并导致中央区域血管闭塞,再次回归室内空气时,中央区开始缺氧,炎症因子、促进血管增生因子上调,诱导病理性新生血管簇形成,而新生血管形成是OIR模型制备成功的主要标志。本研究采用SMITH等[8]设计的方法建立OIR模型,结果显示,对照组小鼠视网膜完全血管化,自视盘中心向四周放射状均匀分布,血管形态及走形正常;OIR组小鼠视网膜中央处可见血管闭塞区,闭塞区周边可见大量新生血管簇,视网膜血管走形迂曲,说明OIR模型制备成功。
近年来研究发现,炎症与ROP病理性血管形成关系密切,炎症与血管新生是2个相互联系、共同发展的病理过程,持续的炎症会损害组织的完整性[9]。炎症诱导的血管生成不仅是急性感染或慢性炎症性疾病中病原体防御的关键组成部分,还在修复机制中起着至关重要的作用[10]。HMGB1是一种高度保守的核染色质结合蛋白,被认为是重要的晚期炎症因子,也是先天性和适应性免疫系统的早期预警信号,参与多种非感染性炎症疾病(癌症[11]、创伤[5]、自身免疫[12]等)的发病机制。本研究免疫荧光检测结果显示,OIR组小鼠视网膜增厚,各层间结构紊乱,组织紧密度较正常视网膜减低,HMGB1蛋白在神经节细胞层、内核层、外核层表达较对照组显著增多;且Western blot检测结果也显示HMGB1蛋白表达较对照组显著增高。HMGB1主要通过死亡细胞的被动释放和免疫活性细胞的主动分泌进入细胞外[2]。缺血、缺氧可导致视网膜细胞损伤和死亡,被动释放HMGB1蛋白,死亡细胞引起炎症刺激,激活免疫细胞主动分泌HMGB1蛋白,释放到细胞外的HMGB1可能以髓样分化蛋白2依赖的方式与糖基化终末产物受体或TLR4结合,通过刺激内皮祖细胞向内皮细胞分化直接参与血管生成,或者通过促使巨噬细胞和内皮细胞释放促血管生成因子,间接调节内皮细胞的增殖、迁移、萌芽[2,13]。已有研究报道,HMGB1除了可与RAGE、TLR4等结合调节血管生成,还可能通过TLR9发挥调节血管生成的作用[5]。
TLR是病原体识别受体家族,参与机体的固有免疫。TLR家族有11个成员,其中TLR9多表达于内质网、溶酶体、多囊泡体,主要结合细菌和病毒DNA中的非甲基化CpG DNA基序,对于预防自身免疫和不适当的免疫反应非常重要[14]。TLR9与不同配体结合后调控血管生成的作用也不同[5]。本研究中免疫荧光检测结果显示,OIR组小鼠视网膜中TLR9蛋白表达荧光强度值高于对照组,TLR9主要分布在神经节细胞层、内核层;且Western blot检测结果也显示,小鼠视网膜中TLR9蛋白相对表达量高于对照组。据此推测,OIR小鼠视网膜缺血缺氧、细胞受损死亡等引起炎症反应,使TLR9表达增高,激活单核/巨噬细胞系统,上调核因子-κB(nuclear factor-κB,NF-κB)、激活蛋白-1(activator protein-1,AP-1)、促血管生成因子的表达,进而引起TNF-α及白细胞介素(interleukin,IL)类(如IL-6)表达增高,产生信号级联反应,从而参与视网膜新生血管形成[5,14-15]。
视网膜新生血管形成是众多疾病如ROP、糖尿病视网膜病变(diabetic retinopathy,DR)等发生的共同病理改变,这种血管与正常血管不同,其管壁薄弱,容易造成渗出、出血、增生等一系列病变,最终导致视力丧失。DR和ROP有着共同的致病基础:缺氧和炎症。在关于DR的研究中发现,慢性炎症是DR的重要病理机制,TLR9和HMGB1蛋白在视网膜神经节细胞层、内核层、外核层中均表达增加,认为其参与DR的发生、发展[16]。这与本研究中OIR小鼠视网膜中HMGB1、TLR9的表达变化类似。LIU等[5]研究显示,心肌梗死和扩张型心肌病小鼠心脏组织中TLR9表达增高,TLR9与HMGB1相互作用,促进心肌细胞的存活、创伤愈合及心肌梗死后血管生成;心肌梗死模型中TLR9基因敲除小鼠病死率明显增高,TLR9缺乏可消除HMGB1在心肌梗死后的保护作用。因此,认为HMGB1和TLR9可单独也可相互作用参与免疫应答、创伤愈合及调节血管生成,促进OIR的发生、发展。
综上所述,OIR小鼠视网膜中HMGB1和TLR9表达显著增高,其可能相互作用共同参与视网膜新生血管形成,促进OIR的发生、发展。但二者具体存在怎样的关系,通过哪些信号通路的变化促进新生血管形成等机制仍不清楚,需要后续进一步深入研究。

