不同冻存保护剂对未性成熟小鼠睾丸生精细胞冻存的影响
张啸龙,张杰平,王金玉,于岚,冯科,曲晓伟,夏彦清,郭海彬,万锋,张翠莲*
(1.郑州大学人民医院 河南省人民医院,郑州 450003;2.河南大学人民医院,郑州 450003;3河南大学医学院,郑州 450003)
青春期前男性肿瘤患者,因睾丸内尚无成熟精子,性腺毒性治疗可能会导致生育能力永久性丧失,睾丸组织或细胞低温冻存是保存其生育力重要的手段[1]。然而,在全身性肿瘤患者中,睾丸组织冷冻及复苏后自体移植意味着患者可能再次引入癌细胞的高风险[2]。考虑到睾丸细胞悬浮液可以进行分选清除癌细胞,而精原干细胞(SSC)可以在体外培养用于精原干细胞移植[3-4]或诱导分化成圆形精子细胞,通过圆形精子细胞注射(ROSI)获得子代。因此,对于青春期前男性肿瘤患者,睾丸生精细胞冻存是其保存生育力重要的途径之一。非梗阻性无精子症(NOA)是男性不育的一种重要类型[5],特别是睾丸内无精子给NOA治疗带来巨大的挑战。研究发现,部分NOA患者睾丸存在SSC和圆形精子细胞,SSC可以通过体外诱导分化形成单倍体圆形精子细胞,而圆形精子细胞可以通过ROSI而获得遗传学的子代[6-7],因此SSC和圆形精子细胞作为生命的种子对于NOA患者的治疗具有重要的临床价值和意义。NOA患者的睾丸生精细胞保存是其生育力保存的重要的途径,并具有潜在的临床应用价值。
目前,国内外尚无完善的睾丸生精细胞的保存体系,对NOA和青春期前男性睾丸细胞冻存的研究报道更少。由于人类睾丸组织稀少且不易获取,而小鼠作为研究哺乳动物胚胎发育以及人类遗传疾病的典型模式动物,在生命科学领域发挥着至关重要的作用。本文选择两周龄小鼠来模拟人在青春期前未性成熟的睾丸发育状态,采用不同的冻存方案对小鼠睾丸生精细胞进行低温冷冻,并检测冻存后生精细胞细胞活率、复苏率、细胞凋亡、线粒体膜电位水平的变化,探索睾丸生精细胞最佳冻存方案。
材料与方法
一、实验材料
1.实验动物:C57BL/6J雄性2周龄小鼠200只,购于河南省实验动物中心,实验动物生产许可证[SCXK(豫) 2017-0001]。
2.主要试剂和仪器:Annexin V-FITC细胞凋亡检测试剂盒购自美国Sigma试剂公司,线粒体膜电位检测试剂盒(JC-1)购自上海碧云天生物技术公司;Ⅳ胶原酶、透明质酸酶、胰酶、二甲基亚砜(DMSO)均购自美国Sigma试剂公司;蔗糖、D-海藻糖(细胞培养级)及DMEM/F12培养基购自上海联迈生物工程有限公司。流式细胞仪(BD Canto plus,美国)、梯度降温盒(Thermo Fisher,美国)。
二、实验方法
1.实验分组:根据冻存液组分不同分为5组。A组:DMEM/F12培养基中含10% DMSO、及10% FBS;B组:DMEM/F12培养基中含10% DMSO、10% FBS及0.1 mol/L蔗糖;C组:DMEM/F12培养基含10% DMSO、10% FBS及0.1 mol/L海藻糖;D组:DMEM/F12培养基中含15% DMSO、10% FBS及0.1 mol/L蔗糖和0.1 mol/L海藻糖;E组:DMEM/F12培养基中含10% DMSO、10% FBS及0.1 mol/L蔗糖和0.1 mol/L海藻糖。以新鲜睾丸组织解离后的睾丸生精细胞为对照组。
2.睾丸生精细胞悬液制备:采用两步酶解法制备小鼠睾丸生精细胞悬液[8],步骤简述如下:将2周龄雄性C57BL/6J小鼠脱颈处死,取出双侧睾丸,清洗后剥除白膜,取20 mg睾丸组织,用眼科剪剪碎睾丸组织<1 mm,转移至15 ml无菌离心管,410g室温离心10 min,弃上清液,留取下层组织沉淀;添加酶Ⅰ4 ml,水浴锅中37℃孵育15 min,孵育过程中持续振荡酶解组织悬液;410g室温离心30 s,弃上清液,留取下层组织沉淀;加酶Ⅱ4 ml,水浴锅中37℃孵育15 min,孵育过程中持续振荡酶解组织悬液;添加10% FBS 4 ml终止消化,410g室温离心10 min,弃上清液,DMEM/F12培养基4 ml重悬,410g室温离心10 min,0.45 μm细胞滤器过滤细胞悬液去除组织碎片;分装于5个1.5 ml离心管中,410g室温离心10 min,弃上清液。分别加入A、B、C、D、E组冻存保护剂1 ml,转移至对应的5个1.8 ml冻存管(每管接收相当于4 mg睾丸组织所制备的细胞)。
3.睾丸生精细胞悬液的的冷冻和复苏:程序化冷冻:将上述各组冻存管置于梯度降温盒中,按照说明书操作,-80℃冰箱中12 h,转移至液氮中冻存。复苏[9]:2个月后从液氮中取出,迅速置于37℃水浴锅中2~3 min,待完全融化后,转移至15 ml离心管中,并添加 DMEM/F12培养基3 ml,室温410g离心5 min,洗涤2次,弃上清液,无菌PBS 1 ml重悬,用于后续实验。对照组的睾丸生精细胞悬液不作冷冻处理,直接进行后续实验。
4.细胞活率检测:台盼蓝拒染法进行细胞活率检测,将细胞悬液与0.4%台盼蓝溶液以9:1混合混匀,室温孵育5 min。染色后,立刻在倒置显微镜200倍下随机取数个视野观察细胞并计数,每个样本统计细胞总数不少于1 000个。活细胞形态圆而透亮,台盼蓝染料拒染;死细胞被台盼蓝染料成蓝色。活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。
5.生精细胞凋亡检测:采用Annexin V-FITC/PI试剂盒及流式细胞仪检测睾丸生精细胞凋亡。步骤简述如下:悬浮细胞1 000g离心5 min,弃上清,PBS洗涤细胞2次,收集细胞(1~5×105),加入195 μl Annexin V-FITC结合液轻轻重悬细胞,加入5 μl Anexin V-FITC混匀,加入10 μl碘化丙啶染色液(PI)轻轻混匀后室温避光孵育10~20 min,随后置于冰浴中。使用铝箔进行避光。孵育过程中重悬细胞2~3次。1 h内用流式细胞仪上机检测,Anexin V-FITC为绿色荧光,碘化丙啶(PI)为红色荧光。并以新鲜消化的睾丸生精细胞作为对照组进行对比分析。
6.线粒体膜电位检测:采用线粒体膜电位检测试剂盒(JC-1)及流式细胞仪检测睾丸生精细胞线粒体膜电位。取1~6×105个细胞,重悬于0.5 ml细胞培养液中,加入0.5 ml JC-1染色工作液,颠倒数次混匀置于细胞培养箱中37℃孵育20 min。在孵育期间,按照每1 ml JC-1染色缓冲液(5×)加入4 ml蒸馏水的比例,配制JC-1染色缓冲液(1×),并放置于冰浴。37℃孵育结束后,600g4℃离心3~4 min,沉淀细胞,弃上清。用JC-1染色缓冲液1 ml洗涤2次,再用1 ml JC-1染色缓冲液重悬后,用流式细胞仪测定荧光强度,激发波长488 nm(绿色),发射波长 530 nm(红色),荧光强度的变化与对照组比较。
三、统计学方法
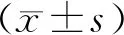
结 果
一、各组生精细胞冻存前后细胞活率及复苏率
与冻存前比较,5组(A~E)细胞冻存复苏后的细胞活率均显著下降(P<0.05);5组间冻存复苏后的细胞活率及复苏率比较中,A组细胞活率及复苏率显著低于其余4组,E组的细胞活率及复苏率显著高于其余4组(P<0.05),B、C及D组间差异无统计学意义(P>0.05)(表1)。
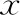
表1 冷冻前后各组睾丸生精细胞细胞活率及复苏率(-±s)
二、各组睾丸生精细胞冻存后细胞恢复情况
以每4 mg睾丸组织解离冻存后实际回收的活细胞数,对睾丸细胞冻存复苏后进行定量计算。统计结果显示,E组睾丸生精细胞的恢复数量[(17.83±0.84)×104]最高,显著高于其余4组(P<0.05);A组的恢复数量[(10.82±0.43)×104]最低,显著低于其余4组(P<0.05);B、C、D组间没有显著性差异(P>0.05)(图1)。
与其余4组比较,*P<0.05、#P<0.05。
三、各组间睾丸生精细胞凋亡水平的比较
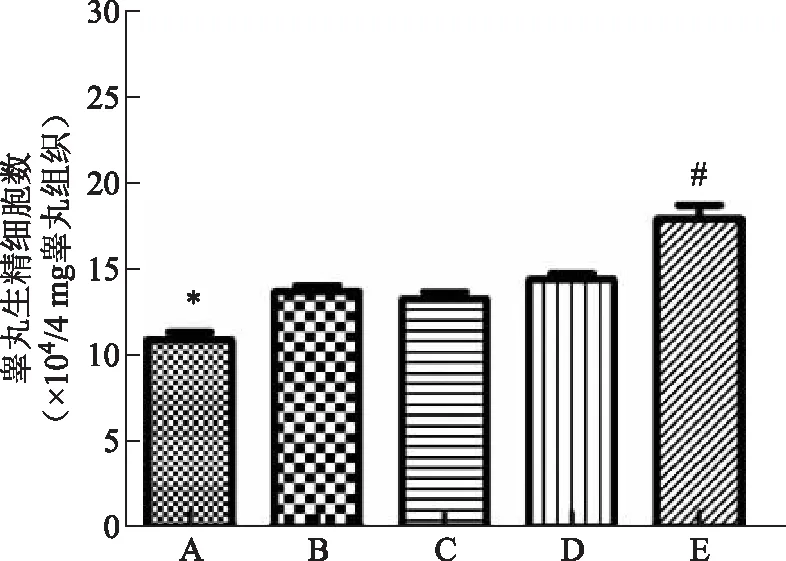
流式细胞仪检测细胞凋亡。统计结果显示,和对照组相比,冻存复苏后5组细胞凋亡率均显著增加[(57.08±2.40)% vs.(18.77±0.95)%、(47.42±1.74)% vs.(18.77±0.95)%、(54.06±2.13)% vs.(18.77±0.95)%、(45.19±2.29)% vs.(18.77±0.95)%、(29.62±1.95)% vs.(18.77±0.95)%](P<0.05);5组冻存细胞间的细胞凋亡率比较,A组细胞凋亡显著高于其余4组(P<0.05),E组细胞凋亡率显著低于其余4组(P<0.05),而B、C、D组间的细胞凋亡率无显著性差异(P>0.05)(图2)。

与其余各组比较,*P<0.05;与B、C、D、E组比较,#P<0.05;与A、B、C、D组比较,&P<0.05。
四、各组睾丸生精细胞线粒体膜电位的比较
膜电位下降程度用R1/R2表示,R1与R2的比值越高说明线粒体膜电位越高。统计结果显示,和对照组相比,冻存复苏后5组细胞线粒体膜电位均显著下降[(1.13±0.12) vs.(4.73±0.25)、(1.62±0.18)vs.(4.73±0.25)、(1.53±0.14) vs.(4.73±0.25)、(1.27±0.15)vs.(4.73±0.25)、(3.58±0.23) vs.(4.73±0.25)](P<0.05);5组冻存细胞间的线粒体膜电位下降程度比较,E组下降程度最低,显著低于其余4组(P<0.05),而A、B、C和D组间的下降程度无显著差异(P>0.05)(图3)。
与其余各组比较,*P<0.05,#P<0.05。
讨 论
无精子症在男性不育人群中的发生率为10%~15%[10],尽管近年来辅助生殖技术的快速发展,但是针对NOA特别是睾丸内无精子患者来说,辅助生殖技术却无计可施,然而幸运的是部分NOA患者睾丸存在精原干细胞。此外,对于即将接受性腺毒性治疗的青春期前男性肿瘤患者,虽然睾丸内尚无成熟精子,但却有精原干细胞。针对NOA睾丸内无精子患者和青春期前男性肿瘤患者,睾丸组织或细胞低温冻存是唯一一种保存其生育力的方法[1]。睾丸组织或细胞低温冻存后复苏,然后进行睾丸组织或细胞移植是一种生育力保存和恢复的方案,已在多种物种进行实验[11-17]。例如,Fayomi 等[18]将低温保存的青春期前恒河猴睾丸组织自体移植到其背部皮肤或阴囊内成功产生功能性精子并能生育后代;在人类中,对非霍奇金淋巴瘤患者的睾丸细胞进行低温冷冻,待患者康复后将冷冻的睾丸细胞复苏并移植到他们的睾丸中[19-20]。然而,目前尚无针对睾丸组织或细胞悬液冷冻保存的最佳方案[21]。此外,对于青春前期全身性肿瘤患者,其睾丸组织可能存在癌细胞污染,需将睾丸组织解离成细胞悬液后进行分选,清除癌细胞后进行睾丸生精细胞冷冻,最后复苏后进行移植。因此,对于NOA睾丸内无精子患者和青春期前男性肿瘤患者,睾丸生精细胞冻存是其保存和恢复生育力重要的方法。
低温冻存保护剂在睾丸生精细胞冻存和复苏过程中起着重要的作用。冷冻保护剂可分为渗透性保护剂和非渗透性保护剂,其中常用的渗透性保护剂是DMSO,因其分子量小,细胞膜穿透性强,在细胞冻存和复温过程中能降低细胞内冰晶的形成,从而对睾丸组织及细胞悬液能起到较好的保护作用,是目前睾丸组织冷冻最常用的冷冻保护剂。非渗透性保护剂中最常用的是蔗糖、海藻糖,可在脱水和复水化过程中,通过形成粘性外壳稳定细胞膜来保护细胞。Jahnukainen等[22]用10%蔗糖、5%和10%的DMSO冷冻保护剂冷冻保存恒河猴睾丸组织,复苏后将睾丸组织移植到裸鼠背部皮下,结果能够启动精子发生过程。Lee等[23]用添加胎牛血清的DMSO和海藻糖的冷冻保护剂冷冻保存小鼠睾丸细胞悬液,复苏后和无海藻糖的冷冻保护剂组相比,小鼠SSCs的细胞活力显著提高,并保持了SSCs的细胞功能。虽然国内外研究者尝试用的多种冷冻保护剂保存睾丸生精细胞,但其冷冻复苏效果尚不十分理想,且冷冻复苏效果检测指标单一(细胞活率)。本研究采用含有不同成分(DMSO、FBS、蔗糖、海藻糖)和浓度的冷冻保护剂对未性成熟小鼠睾丸生精细胞进行冷冻保存,然后检测冷冻复苏后细胞活率、细胞凋亡和细胞线粒体膜电位,力求寻找更佳的冷冻方案。
本研究结果显示,与新鲜对照组比较,冻存复苏后各组细胞活率均显著下降,细胞凋亡率显著升高且细胞线粒体膜电位显著降低;其中添加0.1 mol/L蔗糖和0.1 mol/L海藻糖的冻存组的细胞活率和复苏率均最高、细胞凋亡率最低、细胞线粒体膜电位程度最低;未添加0.1 mol/L蔗糖和0.1 mol/L海藻糖的组别的细胞活率和复苏率均是最低,其细胞凋亡率最高。提示在细胞冷冻处理中,冷冻保护剂中添加0.1 mol/L蔗糖或0.1 mol/L海藻糖对细胞低温冷冻均具有一定的保护作用,而同时添加0.1 mol/L蔗糖和0.1 mol/L海藻糖可显著提高睾丸生精细胞冷冻复苏后细胞活率和复苏率,降低细胞凋亡率,并降低低温冻存对细胞线粒体膜电位损伤的影响,但15%DMSO对细胞的毒性却抵消0.1 mol/L蔗糖和0.1 mol/L海藻糖的部分冷冻保护作用。结果表明,10%DMSO、10%FBS、0.1 mol/L蔗糖和0.1 mol/L海藻糖组合冷冻剂对细胞膜及线粒体膜具有膜稳定的保护作用,是冻存未性成熟小鼠睾丸生精细胞较适宜的冷冻保护剂方案。
本研究尚存在一些不足,首先,浓度分组数量有限,而且限定了冷冻保护载体(冻存管)和冷冻方法(程序性降温)进行比较不同的冷冻保护剂对睾丸生精细胞冷冻保护效果;此外,冷冻保护剂对睾丸生精细胞冷冻保护效果的检测指标仍不全面,未对睾丸生精细胞功能进行检测。因此,在未来研究中,需要增加浓度分组数量,增加睾丸生精细胞检测指标,如细胞甲基化、细胞膜及细胞器形态的变化,并同时比较不同的冷冻载体和降温程序,并对冷冻复苏后细胞进一步培养以明确冷冻保护剂对睾丸生精细胞功能的影响,以探索更适合未性成熟睾丸组织生精细胞的冷冻保护剂,为临床应用提供实验证据和理论支持。

