乳酸菌富硒及产胞外多糖条件的研究
白芳芳,张荣荣,原倩倩,于钰杰,李坤学,马玲
(山西农业大学 食品科学与工程学院,山西 晋中 030801)
硒是一种人体必需的微量元素[1],是谷胱甘肽过氧化物酶、硒磷酸酯合成酶等酶活性中心的组成成分[2-5],可改善机体免疫功能,增强抵抗力,保护心血管和心肌的健康,防癌抗癌,是重金属的天然解毒剂等,并且能促进身体生长,保护视觉器官[6-8]。2017年中国营养学会推荐14岁以上居民每日摄入膳食硒量为60 μg[9-10],人体缺硒会引发克山病、癌症、心脑血管疾病、甲状腺功能障碍等[11]。
硒多糖是多糖与硒的复合物,是有机硒化合物的一种,同时具有硒和多糖的生物活性,但天然的硒多糖并不多,仅存在于某些动植物和微生物中。利用乳酸菌对亚硒酸钠的转化,产物稳定,毒性减弱[12],但需确定培养条件,乳酸菌硒多糖的产量与多种因素有关,例如碳源、氮源、培养时间、温度、培养次数、亚硒酸钠浓度等[13]。陈春[14]的研究表明桑葚多糖组分均具有较好的抗氧化活性,能够抑制α-淀粉酶和α-葡萄糖苷酶的活性,降低机体对糖分的吸收速度,并且经过与硒结合后,抗氧化活性显著增强,增加了组织细胞对葡萄糖的吸收能力,提高了人体葡萄糖耐量,从而具有降血糖的功能。硒化乳酸菌胞外多糖的免疫激活作用优于胞外多糖,硒多糖可激活淋巴细胞的钙通道,有效促进免疫功效,同时富硒胞外多糖还具有抗肿瘤的功效[15-16]。
微生物可通过生物转化将无机硒转化为有利于人体吸收利用的有机硒及单质硒[17-19],有机硒化合物的毒性低[20],在激发免疫反应上比无机硒显著[21],且吸收率更高。大量研究表明大多乳酸菌(如植物乳杆菌、嗜热链球菌、鼠李糖乳杆菌、嗜酸乳杆菌、干酪乳杆菌等)都具有富硒能力,Calomme等[22]研究发现保加利亚乳杆菌将硒非特异性地掺入细菌蛋白质中,将无机硒生物转化为硒代半胱氨酸。此外,乳酸菌对硒具有一定的耐受能力,赵爱兵[23]通过复合诱变选育高富硒嗜热链球菌种,将菌株ZZ-CW4的富硒率提升至83.43%。杨鹤[24]对5种乳酸菌的富硒能力进行了研究,发现嗜酸乳杆菌08001的富硒能力较好,此外,还发现当不同乳酸菌进行复配时,富硒能力显著高于单一菌株的富硒能力(P<0.05)。
本试验选用6种乳酸菌为研究对象,通过测定生长曲线确定各个菌种生长的稳定期,加入不同浓度的亚硒酸钠,以确定菌种的耐硒浓度。在菌种的不同耐硒浓度条件下,以3,3′-二氨基联苯胺法测定菌种的富硒率,苯酚-硫酸法测定其胞外多糖含量,筛选出同时具有较高富硒率和胞外多糖含量的菌种,通过正交试验优化菌种富硒及产胞外多糖条件。
1 材料与方法
1.1 试验材料
1.1.1 菌种
嗜热链球菌(Streptococcusthermophilus)、动物双歧杆菌(Bifidobacteriumanimalis)、鼠李糖乳杆菌(Lactobacillusrhamnosus)、嗜酸乳杆菌(Lactobacillusacidophilus)、副干酪乳杆菌(Lactobacillusparacasei)、植物乳杆菌(Lactobacillusplantarum):由山西农业大学畜产实验室提供。
1.1.2 培养基
MRS培养基[25](牛肉膏10.0 g,蛋白胨10.0 g,葡萄糖20.0 g,酵母膏5.0 g,硫酸锰0.25 g,吐温-80 1 mL, 磷酸氢二钾2.0 g, 乙酸钠5.0 g, 柠檬酸氢二铵2.0 g,硫酸镁0.58 g,蒸馏水1000 mL)、M17培养基:均购自青岛海博生物技术有限公司。
1.2 试验试剂
盐酸、硫酸、氢氧化钠、苯酚、无水乙醇:天津风船化学试剂有限公司;亚硒酸钠:成都麦卡希化工有限公司;3,3′-二氨基联苯胺(3,3'-diaminobenzidine,DAB):西格玛奥德里奇有限公司;三氯乙酸:天津凯通化学试剂有限公司;试剂均为分析纯。
1.3 主要设备
WFJT200型可见分光光度计 尤尼科仪器有限公司;HY-2调速多用振荡器 常州国华电器有限公司;ST-2100 pH计 梅特勒-托利多仪器(上海)有限公司;5801R冷冻离心机 德国Eppendorf公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;BenchTop Pro真空冷冻干燥机 德祥科技有限公司。
1.4 试验方法
1.4.1 菌种的活化[26]
将嗜热链球菌选用M17培养基在42 ℃条件下活化3代,嗜酸乳杆菌、鼠李糖乳杆菌、动物双歧杆菌、副干酪乳杆菌和植物乳杆菌则选用MRS培养基在37 ℃条件下活化3代。
1.4.2 菌种生长曲线的绘制[27]
已活化的嗜热链球菌在M17培养基中以接菌量3%进行培养24 h,每间隔2 h测定其在600 nm处的吸光度值,并绘制菌种生长曲线。其余5种菌种则在MRS培养基中同条件下进行培养,并绘制OD600 nm生长曲线。
1.4.3 乳酸菌耐硒浓度的确定
根据各菌种的生长曲线,选择在菌种对数期时加入1 mg/mL亚硒酸钠溶液,使其在培养基中的浓度为0,5,10,15,20,25,30,35,40,45,50 μg/mL,培养24 h后观察试管底部颜色变化。
1.4.4 3,3′-二氨基联苯胺法测定乳酸菌富硒含量
1.4.4.1 标准曲线的绘制
参考杨靖鹏等[28]的方法,并稍加修改。称取0.1000 g亚硒酸钠,与盐酸按1∶1混合,溶解后定容至100 mL容量瓶中。吸取1 mL定容后的液体稀释50倍,再吸取稀释液0,2,4,6,8,10 mL至烧杯中,加蒸馏水使溶液体积为35 mL,分别加入5% EDTA-2Na溶液1 mL,调节溶液pH值至2.5,分别加入0.5% DAB溶液4 mL,暗反应30 min,使用5%的NaOH将溶液pH值调节至7.0。将上述溶液加至分液漏斗中,与10 mL甲苯溶液混合,振摇,静置使溶液分层,取甲苯层在420 nm处测量吸光度值。
1.4.4.2 样品的测定
取40 mL样品,以4000 r/min离心30 min,吸取20 mL离心后的液体,加蒸馏水使溶液体积为35 mL,加入5% EDTA-2Na溶液2 mL,下同标曲。
1.4.5 苯酚硫酸法测定乳酸菌产胞外多糖含量
1.4.5.1 标准曲线的绘制
参考李进等[29]的苯酚-硫酸法测胞外多糖含量,并绘制标准曲线。
1.4.5.2 胞外多糖的提取
将发酵液样品沸水浴10 min,冷却至室温后加入浓度为80%的三氯乙酸使其终浓度为7%,4 ℃静置过夜,10000 r/min离心15 min除去菌体和变性蛋白,抽滤除去杂质,旋蒸浓缩体积至原体积的1/3,再加入2~3倍体积的无水乙醇,静置使多糖析出,将溶液以10000 r/min离心10 min,保留沉淀,加蒸馏水透析48 h收集多糖溶液进行胞外多糖含量的测定。
1.4.6 乳酸菌富硒单因素试验
1.4.6.1 亚硒酸钠浓度对乳酸菌富硒率及产胞外多糖的影响
以接菌量为3%,培养时间为24 h,培养温度为37 ℃,添加亚硒酸钠浓度为5,7.5,10,12.5,15 μg/mL,测定乳酸菌的胞外多糖产量及富硒率。
1.4.6.2 培养时间对乳酸菌富硒率及产胞外多糖的影响
以接菌量为3%,添加亚硒酸钠浓度为10%,培养温度为37 ℃,培养时间为12,24,36,48,60 h,测定乳酸菌的胞外多糖产量及富硒率。
1.4.6.3 接菌量对乳酸菌富硒率及产胞外多糖的影响
以培养时间为24 h,添加亚硒酸钠浓度为10%,培养温度为37 ℃,接菌量为2%、3%、4%、5%、6%,测定乳酸菌的胞外多糖产量及富硒率。
1.4.6.4 培养温度对乳酸菌富硒率及产胞外多糖的影响
以接菌量为3%,添加亚硒酸钠浓度为10%,培养时间为24 h,培养温度为33,35,37,39,41 ℃,测定乳酸菌的胞外多糖产量及富硒率。
1.4.7 正交试验优化乳酸菌富硒条件
由单因素试验结果得出各因素适宜条件,以乳酸菌胞外多糖含量和富硒率为测定指标进行三因素三水平的正交试验,设计见表1。

表1 正交试验的因素与水平Table 1 The factors and levels of orthogonal experiment
1.5 数据统计分析
试验均重复3次,结果以平均值±标准差表示,使用Statistix 8.1进行数据显著性分析,使用IBM SPSS Statistics 25进行数据统计分析,使用Origin 9.0绘图软件绘制图。
2 结果与分析
2.1 菌种生长曲线
6种乳酸菌的生长曲线见图1。
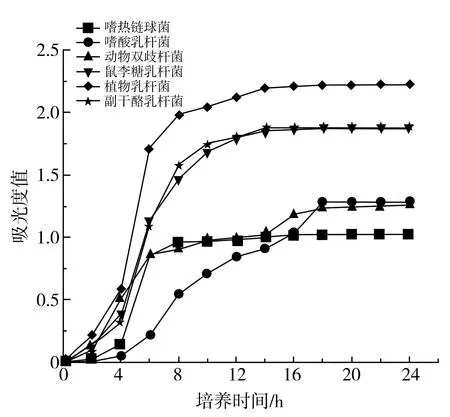
图1 6种乳酸菌生长曲线Fig.1 The growth curves of six strains of lactic acid bacteria
由图1可知,鼠李糖乳杆菌、动物双歧杆菌和植物乳杆菌在培养3 h后进入对数期,持续到10 h;嗜热链球菌在培养4 h后进入对数期,持续到8 h;副干酪乳杆菌、嗜酸乳杆菌在培养4 h后进入对数期,持续到12 h。因此鼠李糖乳杆菌、动物双歧杆菌和植物乳杆菌选择在培养5 h后添加亚硒酸钠,副干酪乳杆菌、嗜热链球菌在培养6 h后添加亚硒酸钠,嗜酸乳杆菌则在培养8 h后添加亚硒酸钠。选择对数期作为加硒时间,有利于菌体转化无机硒和单质硒。宋照军等[30]研究表明在嗜热链球菌生长代谢旺盛时加入亚硒酸钠,对菌体代谢活动抑制较弱,此时有着较高的转化率。
2.2 乳酸菌富硒颜色变化
在6种乳酸菌生长对数期添加不同质量浓度的亚硒酸钠培养24 h后,各种菌株的颜色变化为:植物乳杆菌在亚硒酸钠质量浓度为10 μg/mL,嗜酸乳杆菌和嗜热链球菌在亚硒酸钠质量浓度为15 μg/mL,鼠李糖乳杆菌、动物双歧杆菌和副干酪乳杆菌在亚硒酸钠质量浓度为20 μg/mL时,颜色均为微红。Xia等[31]研究发现乳酸菌在富硒过程中,将一部分无机硒合成硒代胱氨酸,而另一部分则可将无机硒还原成单质硒,试验中菌体变红,则是由于培养基中存在单质硒,说明菌体将部分亚硒酸钠还原成单质硒。
随着亚硒酸钠浓度的不断增大,部分菌体的颜色逐渐加深,最终呈现深红色,而嗜热链球菌、鼠李糖乳杆菌和嗜酸乳杆菌耐硒浓度较低,在较高的亚硒酸钠质量浓度下菌株已无法正常生长。黄秀锦[32]研究乳杆菌的富硒条件时,发现随着亚硒酸钠质量浓度的增加,生物量急剧下降,乳酸菌对硒的富集由生理性富集转变为病理性富集。因此,选择在0~20 μg/mL亚硒酸钠质量浓度下培养的乳酸菌进行富硒率的测定。
2.3 乳酸菌富硒率及产胞外多糖含量测定
由3,3′-二氨基联苯胺法测得的硒标准曲线为:y=0.0029x+0.093,R2=0.9919。由苯酚硫酸法测得的胞外多糖含量标准曲线为:y=0.0151x+0.0756,R2=0.9982。
测定6种乳酸菌富硒率的结果见图2。
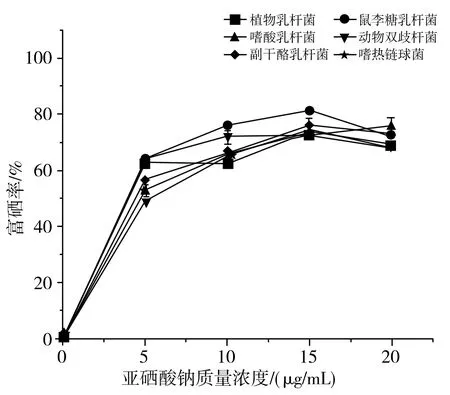
图2 6种乳酸菌添加不同亚硒酸钠质量浓度下的富硒率Fig.2 Se enrichment rates of six strains of lactic acid bacteria with different concentration of sodium selenite
由图2可知,在亚硒酸钠质量浓度为0~20 μg/mL时,6种乳酸菌均具有富硒能力,而亚硒酸钠质量浓度影响乳酸菌对硒的富集作用。随着亚硒酸钠质量浓度的增加,各乳酸菌的富硒率呈先增加后下降的趋势。在亚硒酸钠质量浓度为15 μg/mL时,鼠李糖乳杆菌的富硒率最大,为81.48%;当浓度超过15 μg/mL时,富硒率呈现整体下降趋势,菌株的生长受到了抑制。徐颖等[33]的研究表明在亚硒酸钠质量浓度为8~12 μg/mL时,乳酸菌的富硒率趋于平稳。鼠李糖乳杆菌在各亚硒酸钠浓度下的生长情况较其他菌种良好,选定鼠李糖乳杆菌作为耐硒菌种。
测定6种乳酸菌添加不同亚硒酸钠质量浓度下胞外多糖含量的结果见图3。

图3 6种乳酸菌添加不同亚硒酸钠质量浓度下的胞外多糖含量Fig.3 Extracellular polysaccharide content of six strains of lactic acid bacteria with different concentration of sodium selenite
由图3可知,亚硒酸钠的添加对乳酸菌的胞外多糖含量有影响。当添加一定质量浓度的亚硒酸钠时,各乳酸菌的胞外多糖含量均低于未硒化时;随着亚硒酸钠质量浓度的增大,嗜热链球菌和鼠李糖乳杆菌的胞外多糖含量呈先上升后下降的趋势,这可能是因为低浓度的亚硒酸钠可促进这两种乳酸菌的生长[34],当添加大于10 μg/mL的亚硒酸钠时,菌株的生长受到抑制,多糖的含量降低。植物乳杆菌、动物双岐杆菌、副干酪乳杆菌和嗜酸乳杆菌的生长受亚硒酸钠的影响较大,胞外多糖含量随着亚硒酸钠质量浓度的增大不断降低。当亚硒酸钠质量浓度为10 μg/mL时,鼠李糖乳杆菌的胞外多糖产量为51.48 μg/mL,高于其余菌种。结合6种乳酸菌富硒率的结果,选择鼠李糖乳杆菌作为产胞外多糖的耐硒菌种进行单因素试验。
2.4 单因素试验结果
2.4.1 亚硒酸钠浓度对乳酸菌富硒率及产胞外多糖的影响
由图4可知,亚硒酸钠质量浓度的变化影响鼠李糖乳杆菌的富硒率和胞外多糖含量。随着亚硒酸钠质量浓度的增大,菌种的富硒率和胞外多糖含量先增大后减小。当亚硒酸钠浓度为12.5 μg/mL时,鼠李糖乳杆菌的富硒率达到最大值,为85.41%;当亚硒酸钠为10 μg/mL时,鼠李糖乳杆菌的胞外多糖含量达到最大值,为52.21 μg/mL;随着亚硒酸钠浓度的增大,菌体的生长受到抑制,鼠李糖乳杆菌的富硒率和胞外多糖含量均显著降低(P<0.05)。
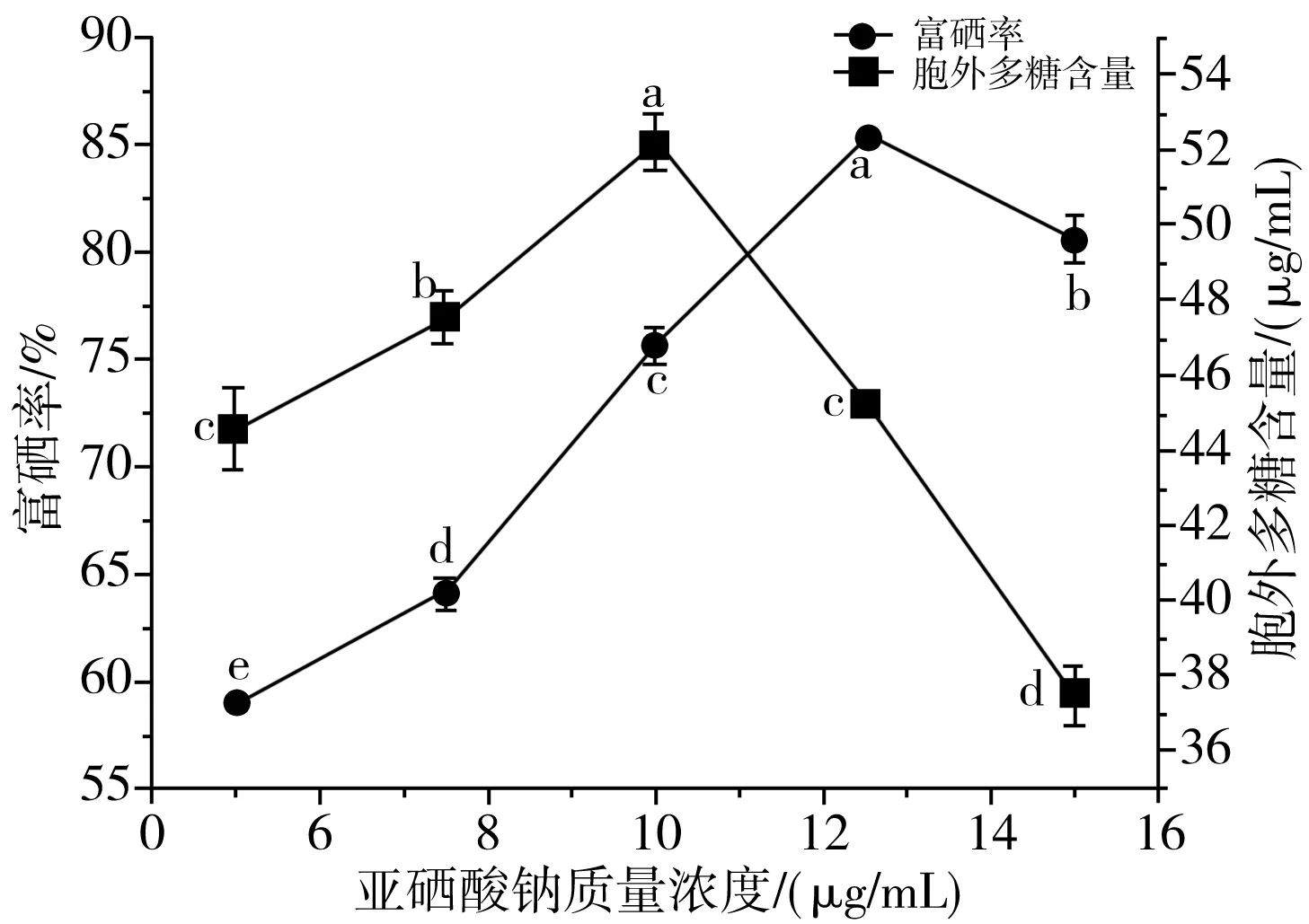
图4 亚硒酸钠浓度对乳酸菌富硒率及产胞外多糖的影响Fig.4 Effect of sodium selenite concentration on selenium enrichment rates and extracellular polysaccharide content of lactic acid bacteria
2.4.2 培养时间对乳酸菌富硒率及产胞外多糖的影响
由图5可知,在培养12~24 h时,鼠李糖乳杆菌的富硒率(80.05%)显著增加(P<0.05),而后随着时间的增加,产量不断下降。菌株胞外多糖的峰值(46.8 μg/mL)则在培养36 h时出现,此后显著下降(P<0.05)。培养时间过长,菌体细胞不断衰亡,葡萄糖激酶、转葡萄糖苷酶以及烯醇丙酮酸磷酸-糖磷酸转移酶等的活性下降,不再合成和分泌胞外多糖[35],同时菌体长时间的培养会产生更多的单质硒,富硒率也出现显著下降(P<0.05)。

图5 培养时间对乳酸菌富硒率及产胞外多糖的影响Fig.5 Effect of culture time on selenium enrichment rates and extracellular polysaccharide content of lactic acid bacteria
2.4.3 接菌量对乳酸菌富硒及产胞外多糖的影响
由图6可知,随着接菌量的增大,鼠李糖乳杆菌的富硒率和胞外多糖含量呈现先升高后降低的趋势。当接菌量过低时,菌体量不足,菌体对硒的富集能力以及合成胞外多糖能力较低,而接菌量过大时,菌体消耗过多的碳源,培养液的低pH影响酶的活性,不利于胞外多糖的积累[36]。当接菌量为5%时,菌株的富硒率和胞外多糖含量均达到最大值,分别为83.18%和59.03 μg/mL。因此,选择接菌量为5%时,能使菌种同时具有较高的富硒率和胞外多糖含量。
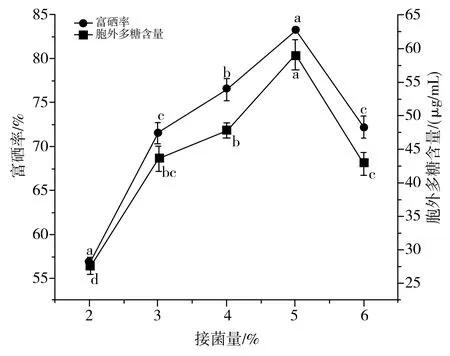
图6 接菌量对乳酸菌富硒率及产胞外多糖的影响Fig.6 Effect of inoculation amount on selenium enrichment rates and extracellular polysaccharide content of lactic acid bacteria
2.4.4 培养温度对乳酸菌富硒率及产胞外多糖的影响
由图7可知,温度是微生物生长及代谢活动的重要因素[37],不同的培养温度对鼠李糖乳杆菌的富硒率和胞外多糖含量有所影响。鼠李糖乳杆菌生长的适宜温度范围为30~40 ℃,当温度从33 ℃升至37 ℃时,菌株的富硒率和胞外多糖含量均显著提升(P<0.05)且在37 ℃时达到最大值,分别为80.74%和51.26 μg/mL。在培养温度较低时,菌体的活力下降,菌体的代谢能力弱,而当温度高于37 ℃时,菌体的活力受到抑制,菌株的富硒率和胞外多糖含量下降。因此,选择37 ℃为鼠李糖乳杆菌高富硒率和高产胞外多糖的温度,确保菌种具有较高的活性。
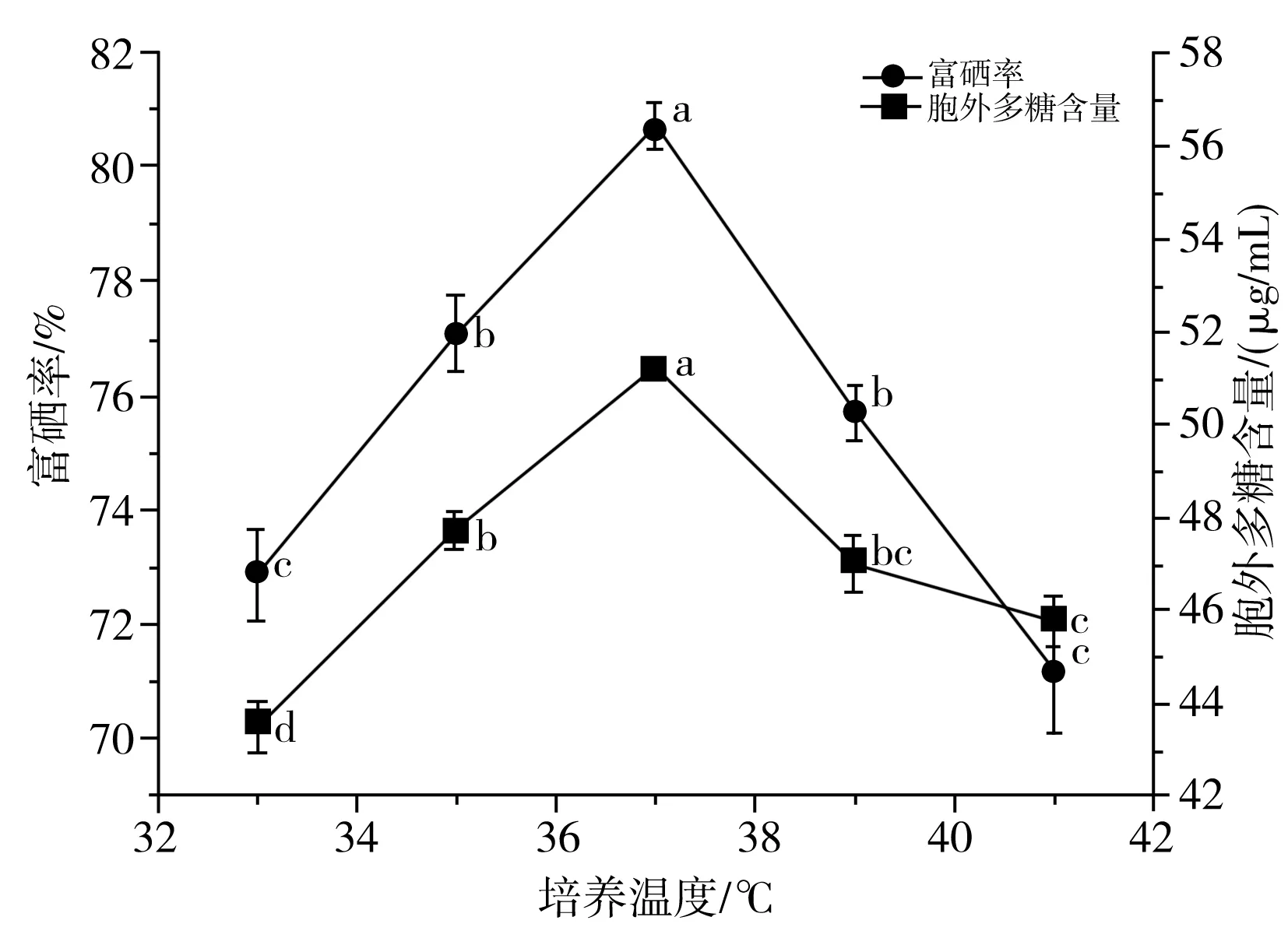
图7 培养温度对乳酸菌富硒率及产胞外多糖的影响Fig.7 Effect of culture temperature on selenium enrichment rates and extracellular polysaccharide content of lactic acid bacteria
2.5 正交试验结果
由表2可知,当以鼠李糖乳杆菌胞外多糖含量为评价指标时,由R1B>R1A>R1C>R1D可知,4种因素对其含量的影响主次顺序为接菌量>培养时间>亚硒酸钠质量浓度>培养温度。由试验组结果可知胞外多糖含量最高的组合为A2B2C3D1,理论值最优组合为A2B2C1D3。通过表3比较可知,组合A2B2C1D3优于组合A2B2C3D1,所以以胞外多糖含量为评价指标时的最优组合为培养时间24 h,接菌量5%,亚硒酸钠质量浓度10 μg/mL,培养温度37 ℃。
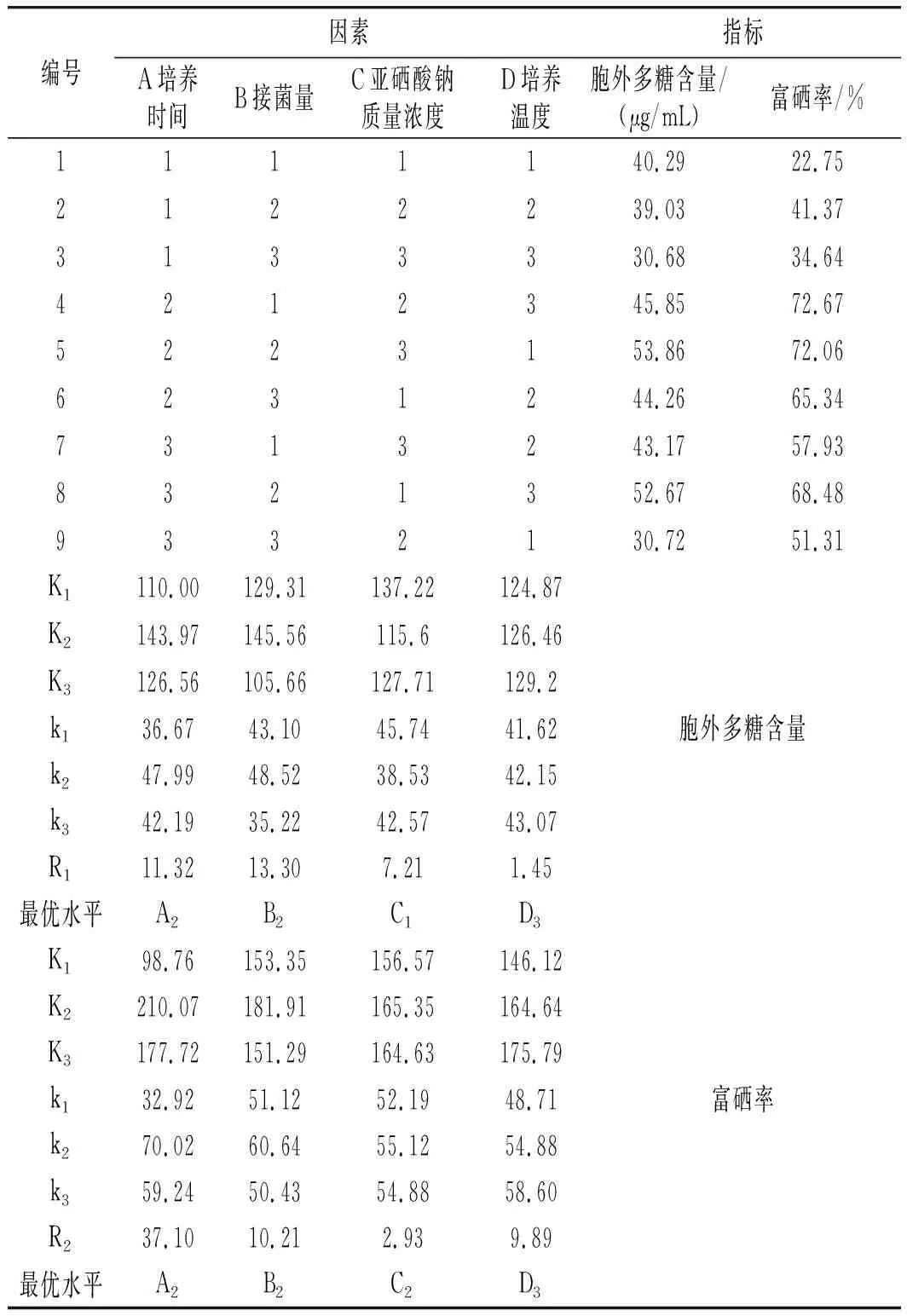
表2 正交试验结果Table 2 The results of orthogonal experiment

表3 理论值与试验值比较结果Table 3 Comparison of theoretical values and experimental values
当以鼠李糖乳杆菌富硒率为评价指标时,由R2A>R2B>R2D>R2C可知,4种因素对其富硒率影响的主次顺序为培养时间>接菌量>培养温度>亚硒酸钠质量浓度。由试验组结果可知富硒率最大的组合为A2B1C2D3,理论值最优组合为A2B2C2D3。通过对比试验结果可知,组合A2B2C2D3优于A2B1C2D3,所以当以富硒率为评价指标时的最优组合为培养时间24 h,接菌量5%,亚硒酸钠质量浓度12.5 μg/mL,培养温度37 ℃。由于试验需要对比研究鼠李糖乳杆菌胞外含量多糖与其硒多糖结构等的差异,所以以富硒率为主要参考指标,探究硒元素对胞外多糖结构等的影响,选定A2B2C2D3为试验条件进行后续试验,即培养时间为24 h,接菌量为5%,亚硒酸钠质量浓度为12.5 μg/mL,培养温度为37 ℃,以不含亚硒酸钠的发酵液所产的鼠李糖乳杆菌胞外多糖作为对照组,与硒多糖进行对比研究。
研究发现鼠李糖乳杆菌经过硒化后的胞外多糖含量和富硒率在培养条件范围内呈现先增加后减少的趋势,这与陈营等[38]研究发现乳酸菌在多糖高产量下菌体活性也最强,随着培养时间的增加,培养基的pH降低,菌体活性减弱,结合多糖降解酶的作用,菌种多糖产量降低的结果相符。通过单因素和正交试验得出的最佳试验条件为培养时间24 h,接菌量5%,亚硒酸钠质量浓度12.5 μg/mL,培养温度37 ℃,而与实际试验条件相比有误差,这可能是由于乳酸菌多次传代影响多糖产量有关。
3 结论
试验选用了6种乳酸菌,由其生长曲线确定各菌的加硒时间,通过对比6种乳酸菌在不同亚硒酸钠质量浓度下的颜色变化、富硒率变化和胞外多糖含量变化,选定鼠李糖乳杆菌作为最佳试验菌种。通过单因素试验确定了正交试验的因素及水平,由正交试验结果得到最佳试验条件:培养时间24 h,接菌量5%,亚硒酸钠质量浓度12.5 μg/mL,培养温度37 ℃。此条件下,鼠李糖乳杆菌的富硒率为79.21%,胞外多糖含量为51.47 μg/mL。

