厚味肽增味机制和部分厚味肽潜在生理功能的研究进展
高瑞,崔春,Dongxiao Sun-Waterhouse
(华南理工大学 食品科学与工程学院,广州 510640)
在食物多样的今天,美味已成为消费者选购食品的首选要求。众所周知,美味不是一种味道(酸味、甜味、苦味、咸味或鲜味)的体现,往往是几种味道相互作用而形成的一种能令消费者愉悦的味道与口感。譬如:5′-核苷酸钠盐能增强甜味,抑制酸味和苦味;高浓度的谷氨酸钠可以增强NaCl的咸度,降低NaCl在食物/食品中的用量,减少人体对盐的摄入量;NaCl和谷氨酸可降低苦味的强度和掩盖苦味的效果。
人类从未停止探索与美味相关的知识。1990年,日本科学家Ueda提出了继五大味觉之后的kokumi概念(kokumi是日语对食物复杂品觉的表达,中文译为厚味)。kokumi并非指独立的口味,而是一种增味增稠的特性,以及连续的、满口性的饱满口感。厚味物质本身具有或不具有味道,而将其加入到食物溶液中,可以在增强基础味觉的基础上赋予食物溶液整体浓厚感、绵延感、连续感和满口性的饱满感[1],这一发现为风味食品的开发提供了新的途径。迄今为止,已发现的厚味物质主要被分为两类:肽类和非肽类。厚味肽因其味道和生理功能的优势,成为科学界研究的一大热点。本文回顾了肽近些年来的研究结果,包括来源、增味特点、受体以及信号传导机制和生理功能。
1 厚味肽来源
厚味不能用一种具体的味道去描述,而是在5种基本味觉的基础上,通过特殊的反应和调节机制使食物/食品产生整体味感,增加食味的持续性和延渗性,使人感受食味的厚度和广度。食物中厚味物质的来源可分为两部分:一是天然存在的,譬如:天然存在于部分葱科植物的厚味肽;二是在食物加工过程中形成。到目前为止,已知的能够引起厚味感的物质大多为肽类,如:谷胱甘肽(γ-Glu-Cys-Gly,GSH)、谷氨酰-缬氨酰-甘氨酰(γ-Glu-Val-Gly)、半胱氨酰-蛋氨酰-苏氨酰(Cys-Met-Thr)。研究发现,厚味肽多为分子质量相对小(<1000 Da)的二肽或三肽,并且序列含有谷氨酸,结构包含γ螺旋的多肽更容易产生浓厚味觉[2]。厚味肽来源广泛,厚味本身比较复杂,感官评定可变性较大,检测手段尚不完善,因此厚味肽的发现和研究仍需进一步的努力。
厚味肽的发现可以追溯到20世纪70年代。1975年,Noguchi等使用链霉蛋白酶水解浓缩鱼蛋白。此水解产物经分离鉴定后得到31种酸性肽,其中包括14个二肽、9个三肽、4个四肽、3个五肽和1个六肽。此水解产物近80%的肽段中含有谷氨酸,并且分子量越小的肽呈现的类似味精的风味活性越强[3]。1978年,Yamasaki等以木瓜蛋白酶水解牛肉,经分离鉴定后得到Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala。由于该肽有肉汤味,当时被称为美味肽[4]。鉴于人们对这类独特风味肽的氨基酸排列特点,呈味特点并不清楚,因此厚味肽的发现和发展较为缓慢,然而这些具有独特风味的肽类的发现,为美味食品的开发提供了启示。
1990年,Ueda将热处理,获得的大蒜水提液(0.1%或0.4%)加入到普通菜汤和鲜味溶液中,并作感官评定,发现菜汤表现出连续的、满口性的和浓厚的口感。Ueda等遂将这种风味定义为kokumi,并确定kokumi的关键成分为含硫化合物,如:蒜氨酸,(+)- s-甲基-L-半胱氨酸亚砜、γ-L-谷氨酰胺-s-烯丙基-L-半胱氨酸[5]。1994年,Ueda团队再次证实洋葱乙醇提取液同样能够产生厚味,其关键成分为反式-(+)-s-丙烯基-L-半胱氨酸亚砜(PeCSO)及γ-谷氨酰胺-PeCSO[6]。1997年,Ueda团队发现将GSH添加到谷氨酸钠和肌苷二钠溶液中,其阈值与在水溶液中的阈值相比显著降低,并且使溶液整体具有厚味[7];当与无机盐体系(NaCl、KCl、CaCl2)相互作用时,能够显著增强咸味,并且kokumi也更为持久和浓郁[8]。
随后,研究学者通过进一步分离鉴定呈厚味的关键成分,发现某些γ-谷氨酰基化的氨基酸呈味特征更加明显,能够协调食品的5种基本味道[9]。2007年,Dunkei等将菜豆的水提物添加到鸡汤中,发现鸡汤的满口性、持久性明显提升。经分离鉴定,他确定能够引起厚味的关键成分为3种γ-谷氨酰肽,分别为γ-Glu-Leu、γ-Glu-Val、γ-Glu-Cys-β-Ala。经感官分析,上述3种肽类在水溶液中的阈值大约为3.3~9.4 mmol/L,而加入到鸡汤中后,其阈值均明显降低,例如:γ-Glu-Cys-β-Ala 加入到谷氨酸和盐的二元体系后,阈值降低了20倍[10]。
2009年,Toelstede等从成熟44周的Gouda奶酪中发现8种α-谷氨酰胺和10种γ-谷氨酰胺厚味候选分子。然而经感官鉴定后发现,只有γ-谷氨酰胺能够赋予成熟奶酪持久性、满口感的厚味,也首次确认了γ-Glu-Glu、γ-Glu-Gly、γ-Glu-Gln、γ-Glu-Met、γ-Glu-Leu和γ-Glu-His为厚味肽[11]。
2012-2013年,Kuroda等先后在扇贝、干扇贝、扇贝提取液、鱼酱和日本酱油原料中发现γ-Glu-Val-Gly。γ-Glu-Val-Gly在不同原料中和经不同加工方式后,浓度有所差异,其中扇贝原料中浓度最低,这可能是因为适当的加工方式有助于生成γ-Glu-Val-Gly[12-14]。2015年,Miyamura等分别对葡萄酒、米酒和啤酒中的γ-Glu-Val-Gly进行定性定量,结果表明所检测的啤酒样品中都含有γ-Glu-Val-Gly,含量在0.08~0.18 mg/L,而在另两种酿造酒中并未发现γ-Glu-Val-Gly。随后,这类厚味肽在发酵虾酱等其他发酵食品中也被发现[15-16]。同时有研究表明,γ-Glu-Val-Gly的厚味强度是GSH的12.8倍,可以用于代替GSH作为食品添加剂。
2017年,Shibata等在大豆种子水提物中发现厚味物质,经分离鉴定后确定主要厚味赋予者为γ-Glu-Tyr和γ-Glu-Phe,并且它们在鲜味溶液中的阈值较低。同时Shibata等首次尝试采用γ-谷氨酰肽与低聚糖相结合来提高厚味的强度[17]。
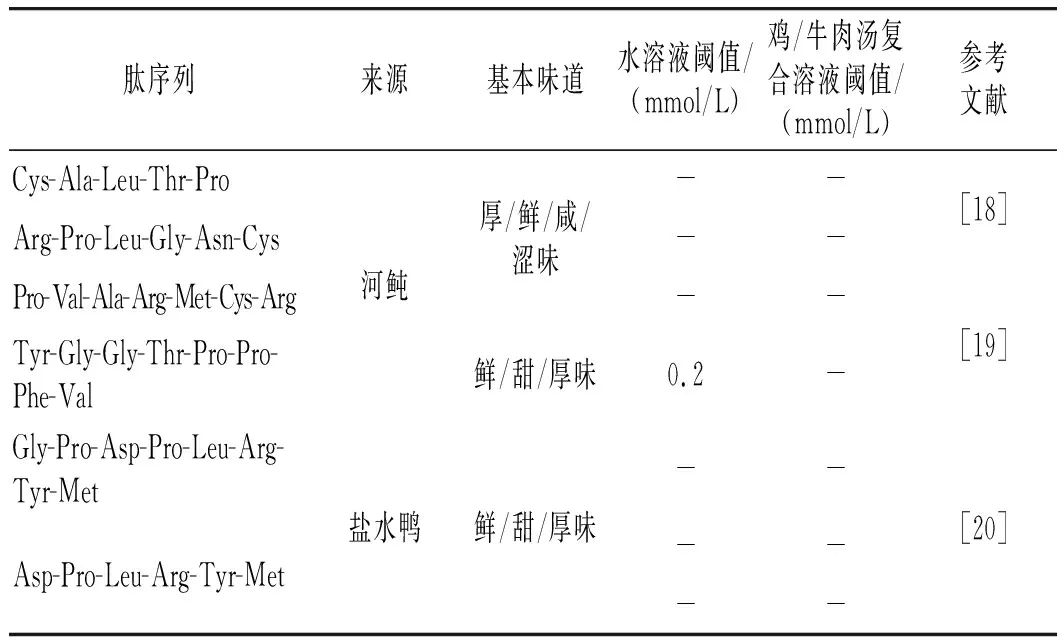
表1 部分食物源厚味肽呈味特点Table 1 Taste characteristics of some palatable peptides from food sources
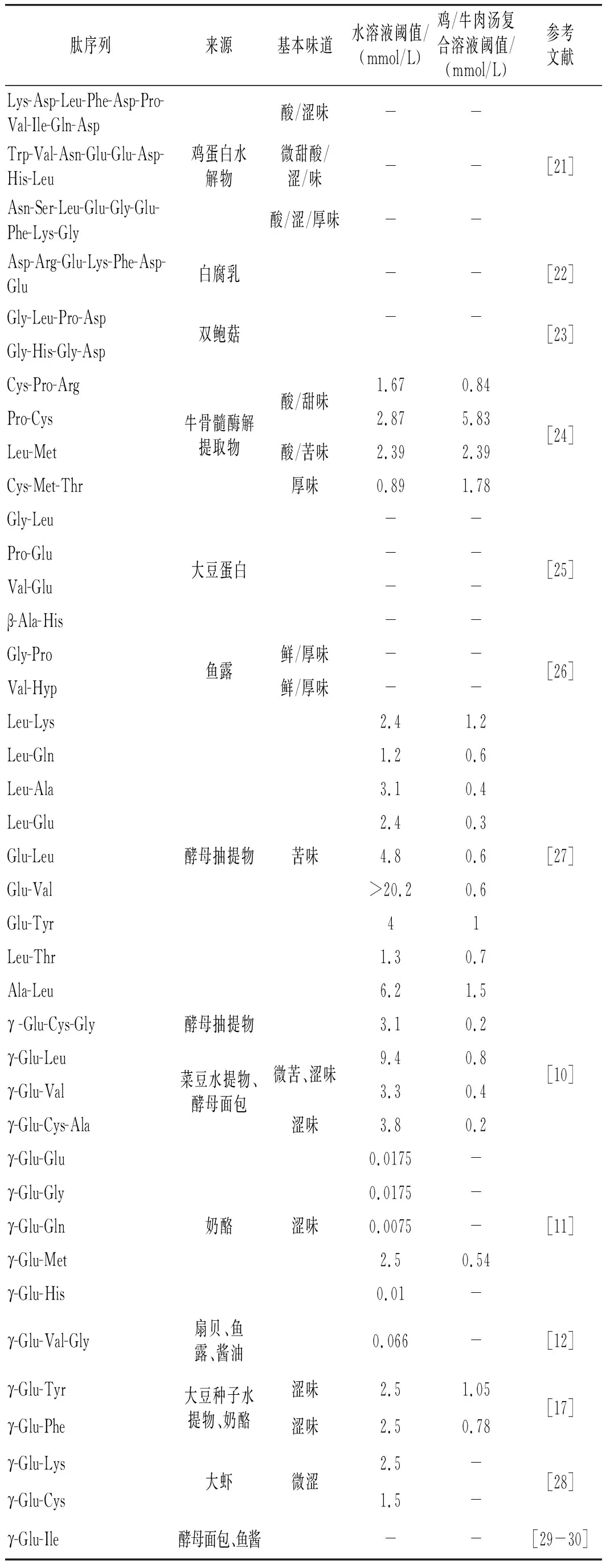
续 表
2 厚味肽受体及其味觉传导机制
目前,5种基本味觉受体已基本得到定论。咸味受体是经上皮细胞钠通道(ENaC);酸味候选受体有PKd1L3/PKd2L1,酸敏感离子通道(ASICs)等;苦味、咸味和鲜味受体均为G蛋白受体家族成员:甜味物质受体为T1R2/T1R3,鲜味物质受体为T1R1/T1R3,苦味物质受体为T2Rs家族[31]。虽然厚味肽研究较晚,但是其部分受体也已经被发现。许多研究均表明,厚味受体为钙敏感受体(calcium-sensing receptor,CaSR)。
2.1 CaSR结构
CaSR属于C类G蛋白偶联受体家族,由1078个氨基酸组成,以异源二聚体的形式存在。CaSR结构主要分为三部分:细胞外结构域(extracellular domain,ECD)、7次跨膜螺旋结构域和胞内结构域(intercellular domains,ICDs)[32]。
ECD包括捕绳夹结构域(venus-flytrap,VFT)和半胱氨酸富集区(CRD),共含612个氨基酸。VFT中含有多种配体结合位点用于与如Ca+和Mg+等多价阳离子、芳香族、脂肪族氨基酸、精胺、多肽、多价抗生素等结合。当激动剂与受体上的位点结合后,CaSR便被活化,触发下游信号通路[33]。7次跨膜螺旋结构域共有250个氨基酸,是胞外结构域与胞内G蛋白的桥梁。ECD和7次跨膜螺旋结构域均含有Cys,该氨基酸在信号传导中扮演了重要的角色。若任意一个Cys突变,CaSR功能便减弱;若Cys缺失,CaSR功能丧失[34]。所以,目前的许多研究表明,Cys是肽类产生厚味的重要原因。ICDs 共有216个氨基酸、2个蛋白激酶 A(protein linase A,PKA) 和3个蛋白激酶C(protein kinase C,PKC)的磷酸化作用位点。该结构域主要参与控制CaSR信号及其信号协同性、调节受体转运。
2.2 CaSR在人体中的分布
CaSR最主要的生理功能是维持和调节钙稳态,因此该受体在调控钙稳态的组织中被大量表达,如:甲状旁腺、肾脏、骨骼。人体内的CaSR最初是由从甲状旁腺中分离得到的cDNA克隆而来的[35],随后的研究也发现,CaSR主要表达于甲状旁腺主细胞。CaSR在肾脏中的分布也较为广泛。Graca等利用不同的检测手段,在髓袢升支粗段、远端小管、集合管乃至整个肾单位中均检测到CaSR。但是, CaSR在这些细胞中的表达水平有所差异,其中髓袢升支粗段中的CaSR数量最多[36]。Ca2+是CaSR最主要的激动剂,而人体骨骼中钙的含量最多,因此,骨骼中的CaSR在人体中所占数量最多。当胞外Ca2+浓度低于其稳态范围时,甲状旁腺主细胞中的CaSR就会表达,大量的甲状旁腺激素(PTH)被释放。与此同时,肾脏对Ca2+的重吸收作用增强。在这一过程中分泌的激素和活性物质也刺激破骨细胞吸收,调节骨形成和骨吸收,维持Ca2+稳态[37]。在胃肠道中也可检测出CaSR,包括胃泌素分泌细胞、黏液分泌细胞、小肠绒毛和隐窝上皮细胞、结肠隐窝上皮细胞、十二指肠神经系统的神经丛、神经突和神经纤维以及大肠绒毛上皮细胞等[38]。
CaSR除了广泛分布于钙调组织中,在一些非钙调组织中也发现了少量表达的CaSR。这些非钙调组织包括心脏、血管、大脑、胰脏、味觉细胞。21世纪初,Racz等在胰腺内的腺泡细胞、导管细胞、血管神经和胰岛α、β细胞中检测到表达的CaSR,其中导管细胞中的数量较多[39]。除此之外,人们还在乳腺组织、T淋巴细胞、主动脉内皮细胞、口腔味觉细胞等多处发现CaSR表达。在不同的组织器官中,CaSR表达数量各异,功能各异(包括促进细胞的增殖分化、凋亡,调节激素的分泌)。由于CaSR在人体分布广泛、功能繁多,因此在医学领域中, 该受体既可以作为某种疾病的判断依据,又可作为治疗的靶点。
2.3 厚味肽增味机制
人类对味觉的感知始于口腔。研究表明口腔内的味觉感受器是味蕾。一般情况下,成年人含有9000多个味蕾,婴儿可能有超过10000个。每个味蕾大概含有50~100个味蕾细胞。在电子显微镜下,可将味蕾细胞分为四类:Type I、Type II、Type III以及Type Ⅳ。
相关研究者在I、II、III型味蕾细胞均发现了CaSR的存在,但是,目前只能确定在III型细胞中表达CaSR。由于检测手段和结果的差异,对于CaSR是否存在于I、II型细胞中仍有争议。迄今对厚味肽的研究机制尚不明确。Wang等认为GSH并不直接刺激CaSR,而是增强CaSR介导的钙诱导反应[40]。Gabriel等发现CaSR与II型细胞中的PLCβ2,III型细胞中的NCAM共表达[41]。Bystrova等发现,在III型细胞中CaSR介导苯丙氨酸刺激的PLC依赖性Ca2+信号的传递[42]。随后,Maruyama等也通过实验发现γ-Glu-Val-Gly能引起PLC依赖型的钙离子释放,从而使瞬时钙离子浓度增加,并且这种级联反应与胞外有无钙离子无关[43]。Sarah推测,CaSR可能和T1Rs或T2Rs存在功能上的偶联关系。
因此,综上所述,厚味肽的可能传导通路大致如下:厚味物质与CaSR作用后,G蛋白构象发生变化,G-味导素激活PLCβ2,胞内钙离子释放效应增强,动作电位产生,神经递质释放,信号从味觉神经纤维传至大脑中枢。
3 部分厚味肽生理功能
厚味肽除了能增加味的满口感、持久感,给人味觉上的享受外,作为肽,厚味肽也被摄入吸收到体内。厚味肽具有吸收率高、稳定性好等特点,能促进机体的代谢活动,部分厚味肽还能发挥如抗炎、抗氧化、免疫系统调节等多种生理功能。
3.1 抗氧化功能
近年来,抗氧化肽因能清除自由基,抑制脂质过氧化,易被机体吸收,而广泛被应用于食品、医药、化妆品等行业。通过研究分析,已发现的抗氧化肽中大多含有Cys、Trp、His、Tyr、Val等氨基酸。其中,His的抗氧化活性主要体现为咪唑基团的供氢能力、脂质过氧自由基的捕获能力以及金属离子的螯合能力;Cys、Met可与相应的自由基直接反应;Tyr、Trp则能为自由基提供氢原子。研究也已证实,抗氧化肽的活性强弱与氨基酸的种类、排列序有关,当肽中含有疏水性氨基酸和芳香族氨基酸时,抗氧化活性更强[44]。而这一点又与厚味肽受体上含有芳香族、脂肪族结合位点这个特征相契合,因此部分厚味肽也具有抗氧化功能。
GSH一直都是科学界的研究重点。GSH除具有厚味外,还是最早被发现的具有抗氧化活性的小分子肽,并且其作用机理已经被明确。GSH正被广泛应用于各个行业。GSH的前体γ-Glu-Cys也被证实具有抗氧化活性。Salama等在铅中毒的大鼠体内进行了抗氧化实验,结果表明γ-Glu-Cys可降低脂肪和蛋白质的氧化程度,提高大鼠体内GSH、过氧化氢酶(CAT)、谷胱甘肽过氧化酶(GPX)和超氧化物歧化酶(SOD)的活性,减轻铅致肾损伤[45]。崔春团队形成了成熟的γ-[Glu](n=1,2,3,4)-Cys合成技术体系。此团队采用谷氨酰胺酶制备和体外活性评价的流程,显示了γ-[Glu](n=1,2,3,4)-Cys酶合成法可行性,证实了γ-Glu-Cys和γ-Glu-γ-Glu-Cys具有清除自由基、螯合Fe2+的能力,并且其抗氧化活性高于GSH,具有成为食品、医药领域抗氧化剂的巨大潜力[46]。
根据上述介绍的抗氧化活性与构效关系,我们可以推断γ-Glu-His、γ-Glu-Tyr、γ-Glu-Leu等厚味肽也具有潜在的抗氧化活性,只是还未被证实或是很少被报道,所以,我们要进一步推进这方面的研发工作,找出更多既有厚味特性又有抗氧化活性的肽类,从而为人类开发出既美味又有益健康的食品。
3.2 抗炎功能
炎症反应可引起慢性肠炎、慢性肾脏病、血管源性眼病和痛风性关节炎等。现已证实,多种肿瘤的发生与慢性炎症有关。人类在与炎症抗争的过程中,开发了许多抗炎药物,但是在服药期间,发现这些抗炎药物具有一定的副作用,会引起患者产生不良反应。目前,人们发现部分γ-谷氨酰肽具有抗炎作用,可能具有替代药物的潜力,为抗炎剂的开发提供了新方向。
有许多研究表明,在胃肠道中,γ-Glu-Cys和γ-Glu-Val作为激活钙敏感受体介导的抗炎途径的激动剂,能够抑制炎症。Zhang等以硫酸葡聚糖钠诱导结肠炎猪为模型,通过给予结肠炎猪γ-Glu-Val,可以观察到干扰素(TNF-α)和白细胞介素(IL-6)均下降到正常水平,TNF-α、IL-6、IL-1β和IFN-γ基因的表达也得到缓和[47]。在急性胰腺炎中,γ-Glu-Cys能够阻断c-Jun氨基端激酶通路和恢复蛋白磷酸酶水平,抑制TNF-α的上升[48]。炎症细胞因子的升高是判断抑郁的一个重要指标。Zhu等在使用酶法合成了γ-Glu-Trp、γ-Glu-Glu-Trp、γ-Glu-Glu-Glu-Trp和γ-Glu-Glu-Glu-Glu-Trp后,向慢性束缚应激和皮质酮诱导的抑郁/焦虑小鼠给予不同含量的γ-Glu-Trp。4周后,小鼠抑郁行为得到缓解;血清检测结果显示:TNF-α、IL-6、IL-1β和IFN-γ含量下降不同程度[49]。
3.3 免疫调节活性
免疫系统是保障机体维持各项生理功能的重要防线。免疫系统既可以清除体内坏死和病变的细胞,又可以防御外来病原体。免疫系统一旦失调受损,就会引起机体患病。
γ-Glu-Trp(SCV-07)是目前最具开发价值的免疫调节肽之一,正被用于肺结核和口腔黏膜炎的治疗。临床实验表明,SCV-07能够促进胸腺和脾脏器官的增长,刺激T细胞分化,激活免疫应答,增加白介素2和干扰素γ的生成,缓解肺结核病人的症状(发烧、咳嗽、呼吸困难、胸痛和心跳过快)[50]。因此,若将SCV-07和标准化肺结核治疗法相结合,可提高单纯肺结核治疗过程中的免疫疗效和免疫水平。此外,当把SCV-07免疫调节剂应用于白血病、淋巴瘤和头颈癌治疗时发现SCV-07能够抑制多种肿瘤细胞系的生长,减缓因放化疗而引起的口腔黏膜炎的严重程度和持续时间[51]。除SCV-07外,GSH在哮喘疾病中也具有免疫调节活性。有文献报道,GSH能够增加哮喘患者体内淋巴细胞的数量、NK细胞的活力,提高IFN-γ的生成量[52]。
3.4 其他生理功能
厚味肽具有营养价值。从厚味肽的组成来看,厚味肽不乏含有人体必需氨基酸Phe、Tyr、Met、Leu等,厚味肽摄入能为人体补充所需氨基酸。早在20世纪90年代,科学家们就通过向小鼠喂食γ-Glu-Tyr补充酪氨酸[53]。厚味肽可发挥解毒功能。谷胱甘肽可以有效缓解因酒精和金属引起的身体中毒症状,还可降低抗癌药物毒性,提高化疗效果[54]。厚味肽也具有抗菌、维持机体免疫功能。摄入人体后的厚味肽会被分解为游离氨基酸,这些游离氨基酸被人体所利用。其中,谷氨酰胺可保护小肠黏膜免受细菌和病毒的入侵,减少细菌移位,还可参与T淋巴细胞的分泌和增殖。若向病患提供外源性谷氨酰胺,可明显增加病人体内的淋巴细胞总数和T淋巴细胞,提高机体的免疫能力[55]。目前,专门针对厚味肽生理功能的研究不多,但是现有的研究数据均表明厚味肽,尤其是γ-谷氨酰胺厚味肽,对人体十分有益,因为它们可参与细胞代谢,改善人体内部微环境,保护胃肠道、肝肾和神经系统等免受损伤。
4 小结
虽然厚味研究与开发比5种基本味觉起步较晚,但是厚味物质的应用前景非常可观。在现代社会中,只有解决温饱功能的食物是不够的。人们在选购食物时,美味与健康是主要的决定因素。厚味与酸、甜、苦、咸、鲜不同。厚味并非独立的口味, 无法呈现直观感受,而是增强食物口感的延长感及浓厚感,让人在食用后能体会到满口感,并且感受到增强了的基本味觉。这样的话,使用小剂量的糖和盐就能呈现更好的甜、咸味觉,从而减少糖、钠在食物/食品中的添加和人体的摄入。因此,厚味肽可作为一种新型调味品运用到食品领域。目前,随着电子舌和CaSR受体鉴别厚味技术的推进,越来越多的厚味肽被发现。然而,厚味肽的分离提取或人工合成仍大多停留在实验室阶段,还没有形成完善成熟的工业化制备体系,并且厚味肽产率低,难以形成市场产业化。所以,如何在实验室制备法的基础上建立和优化出一条工业生产工艺路线是厚味肽获得广泛运用的一大技术难题。此外,研究已经发现部分厚味肽在人体中发挥着重要的生理功能,因此我们应该拓展厚味肽生理功能的研究工作,使厚味肽不仅提供厚味效果, 且同时提供有益健康的生理功能,成为符合特定人群的调味品。

