肺移植术后中心气道狭窄危险因素分析
杨航 卫栋 张稷 周敏 刘东 范立 陈静瑜 毛文君 吴波
肺移植是终末期肺疾病唯一有效的治疗手段,目前我国每年完成500例以上肺移植。气道并发症是肺移植术后的常见并发症,影响受者术后生存率及生存质量。中心气道狭窄是最常见的气道并发症类型,而今国外对中心气道狭窄研究较少,国内尚未见相关研究。本研究通过回顾性分析在南京医科大学附属无锡人民医院肺移植科接受肺移植的受者的临床资料,探讨肺移植术后发生中心气道狭窄的危险因素,为预防肺移植术后中心气道狭窄提供依据,以进一步提高受者术后生活质量及总体生存率。
1 资料与方法
1.1 研究对象与分组
2016年7 月至2017年12月,南京医科大学附属无锡人民医院肺移植科共完成肺移植手术216例。在排除44例围手术期死亡病例、17例资料不完整病例后,最终纳入155例受者进行分析。所有肺移植均经南京医科大学附属无锡人民医院伦理委员会讨论通过后批准实施。
所有受者术后常规进行气管镜检查,检查的频率根据病情的需要而调整。以气管镜直视下的表现为依据,根据国际心肺移植学会(International Society for Heart and Lung Transplantation,ISHLT)关于气道并发症的分级系统[1],将符合狭窄分类且部位为a类(仅吻合口狭窄)及b类(吻合口合并叶或段支气管狭窄)者纳入狭窄组(36例),其余受者纳入对照组(119例)(图1)。狭窄组中,男30例,女6例,年龄52(41,62)岁,单肺移植18例,双肺移植18例,原发病包括肺纤维化21例、慢性阻塞性肺疾病5例、支气管扩张4例、硅沉着病3例、特发性肺动脉高压3例;对照组中,男97例,女22例,年龄58(50,64)岁,单肺移植84例,双肺移植35例,原发病包括肺纤维化63例、慢性阻塞性肺疾病25例、支气管扩张7例、硅沉着病12例、特发性肺动脉高压2例、肺淋巴管平滑肌瘤病4例、闭塞性细支气管炎4例、肺泡蛋白沉积症1例、二次肺移植1例。
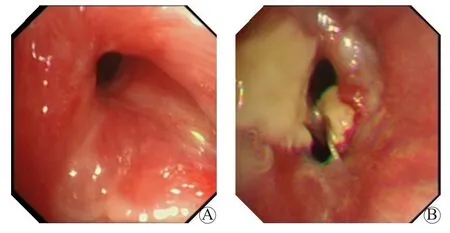
图1 支气管吻合口狭窄分类图例Figure 1 Illustration of classification of bronchial anastomotic stenosis
1.2 免疫抑制方案与真菌感染的预防
所有受者的支气管吻合口吻合方式均为端端吻合[2-3]。术后采用三联免疫抑制方案(钙调磷酸酶抑制剂+抗代谢药物+糖皮质激素)。所有受者术后当日即静脉使用棘白菌素类或三唑类抗真菌药物,撤机后均联合雾化吸入两性霉素B以预防真菌。
1.3 研究方法
将两组的年龄、性别、原发病、手术方式(单、双肺移植)、原发性移植物功能障碍(primary graft dysfunction,PGD)3级、气道真菌感染、冷缺血时间、手术出血量、机械通气时间、重症监护室(intensive care unit,ICU)入住时间等因素进行单因素和多因素logistic回归分析。
根据ISHLT制订的标准,将术后诊断为PGD,氧合指数<200 mmHg(10 mmHg=1.33 kPa)者,分级为PGD 3级[4]。气道真菌感染的诊断标准为气管镜下见典型的黏膜损害表现,及支气管活组织检查(活检)组织病理学或肺泡灌洗液培养结果证实真菌感染[2]。
1.4 统计学方法
采用SPSS 20.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用非参数检验;计数资料以率表示,组间比较采用χ2检验。应用单因素和多因素logistic回归模型来分析中心气道狭窄的危险因素,单因素logistic回归分析中P<0.05的变量被纳入多因素logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 肺移植术后中心气道狭窄的发生情况
155例肺移植受者中,36例发生中心气道狭窄,发生率为23.2%,其中a类狭窄有13例(36%),b类狭窄有23例(64%),发生时间为术后(53±13)d。
2.2 肺移植术后中心气道狭窄危险因素的单因素分析
单因素logistic回归分析结果显示,两组在年龄、性别、原发病、手术出血量上差异无统计学意义(均为P>0.05)。双肺移植[比值比(odds ratio,OR) 2.400,95%可信区间(confidence interval,CI) 1.119~5.418,P=0.023]、PGD 3 级(OR2.718,95%CI1.052~7.022,P=0.022)、 气 道 真 菌 感 染 (OR3.571,95%CI1.546~8.246,P=0.002)、冷缺血时间长(OR4.213,95%CI1.775~10.002,P=0.004)、机械通气时间长(OR4.909,95%CI1.937~12.443,P=0.003)、ICU入 住 时间长(OR1.078,95%CI1.022~1.138,P=0.030)是肺移植术后发生中心气道狭窄的危险因素(表1)。
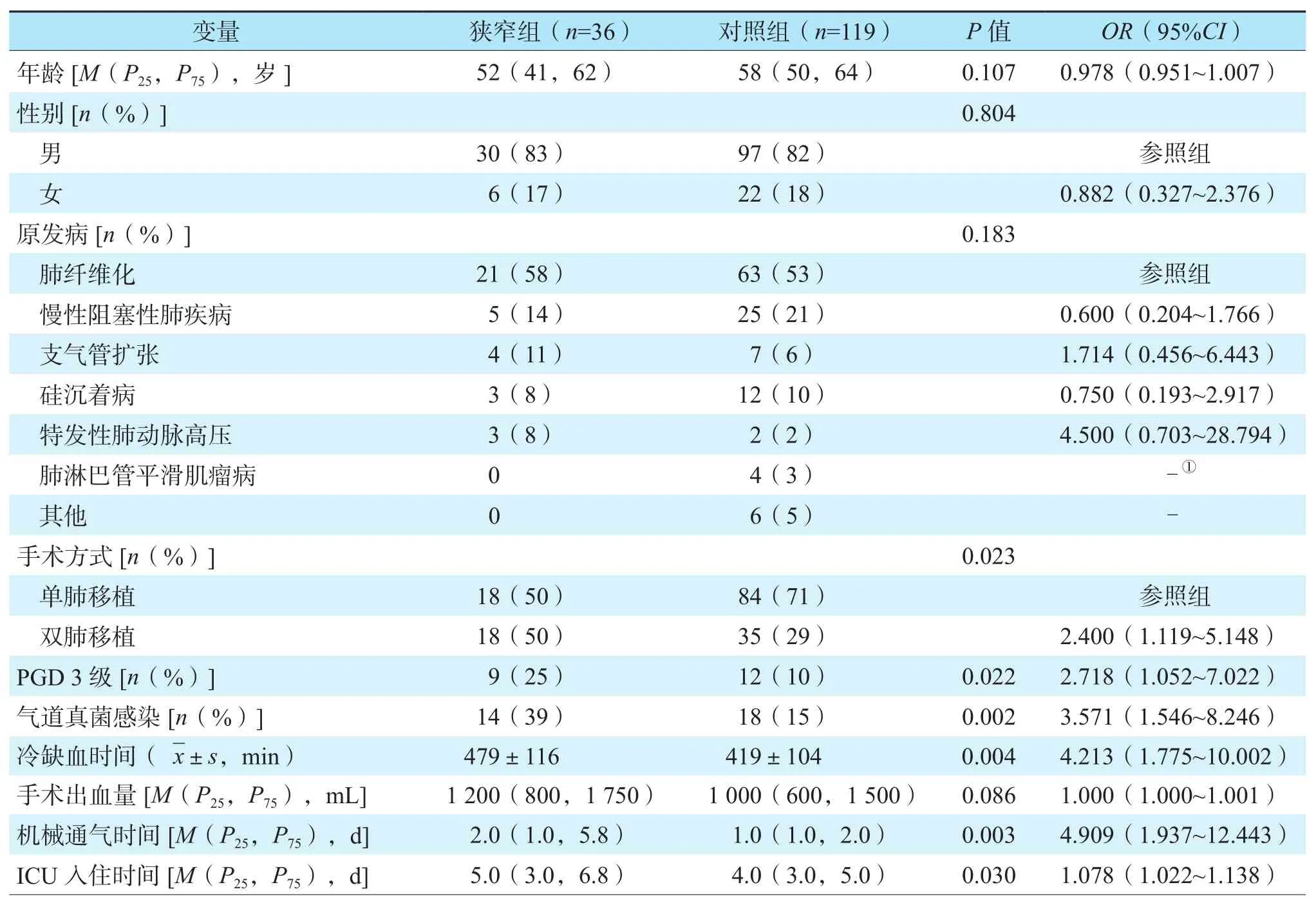
表1 肺移植术后中心气道狭窄危险因素的单因素分析Table 1 Univariate analysis of risk factors of central airway stenosis after lung transplantation
2.3 肺移植术后中心气道狭窄危险因素的多因素分析
多因素logistic回归分析结果显示,气道真菌感染(OR2.694,95%CI1.023~7.095,P=0.045)、冷缺血时间长(OR4.780,95%CI1.888~12.101,P=0.001)、机械通气时间长(OR2.957,95%CI1.030~8.488,P=0.044)是肺移植术后发生中心气道狭窄的独立危险因素(表2)。
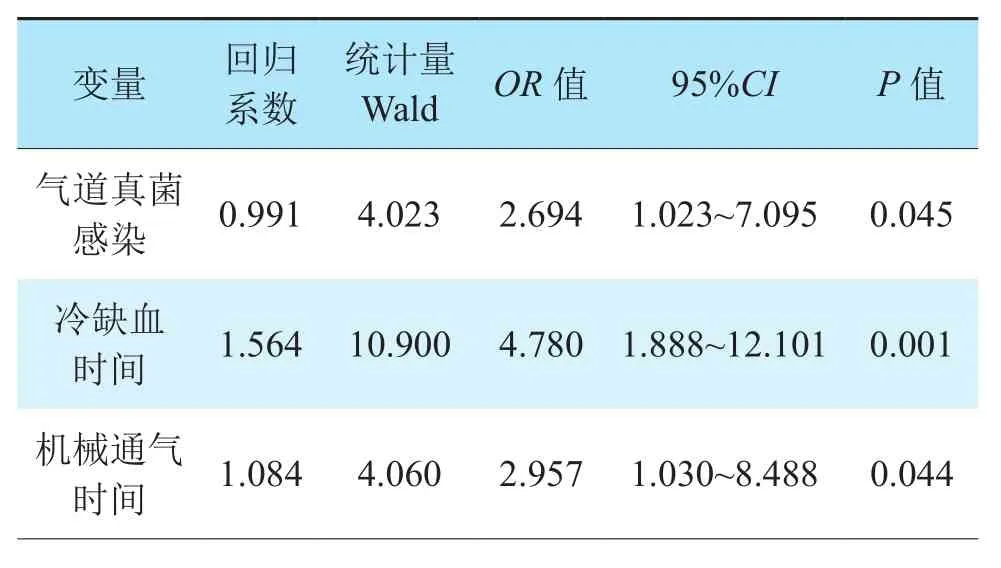
表2 肺移植术后中心气道狭窄危险因素的多因素分析Table 2 Multivariate analysis of risk factors of central airway stenosis after lung transplantation
3 讨 论
本研究是关于肺移植术后发生中心气道狭窄的危险因素研究,目前国内无相关报道。在ISHLT关于成人及儿童肺移植术后气道并发症的共识中,将气道并发症分类为缺血、坏死、裂开、狭窄、软化[1],其中气道狭窄是最常见的类型,据文献报道其发生率为1.6%~32.0%,病死率为2%~3%[5]。根据气道狭窄发生的部位,又将其划分为中心气道狭窄和远端气道狭窄,前者常见,两者可单独或同时存在。中心气道狭窄指支气管吻合口以及吻合口2 cm内的气道狭窄,可导致严重的阻塞性通气功能障碍,影响受者术后生存[6-9]。其临床表现包括呼吸困难、咳嗽、肺功能第1秒用力呼气容积(forced expiratory volume in one second,FEV1)下降等,均为非特异性,胸部CT结合气道三维重建有一定提示作用,但诊断的金标准仍是气管镜检查[10-12]。关于气管镜下气道并发症的评估方法,Dutau等[13]提出了MDS分型法,ISHLT也推荐了一种分级系统,前者侧重于对气道情况的综合分析,后者则直接对不同类型气道并发症的发生部位和程度分级,更加直观方便,本研究采用了ISHLT的分级系统。
一般认为,中心气道狭窄的主要病因是供者支气管缺血[14-15]。肺的双重血液供应包括肺循环和支气管循环,肺移植手术可以重新建立肺循环,但无法重建支气管循环,因此在肺移植术后早期,供者支气管的血供主要来源于低压、氧供不良的肺动脉系统的逆行血流。支气管循环的重建需要数周的时间,在此之前,减少肺血流量或增加肺血管阻力的因素,会加重供者支气管缺血,进而造成支气管壁、软骨损伤等,形成中心气道狭窄。
供肺冷缺血时间的延长将加重气道缺血,本研究显示冷缺血时间长是中心气道狭窄发生的独立危险因素。Mendogni等[16]对单中心147例患者进行回顾性分析,发现冷缺血时间延长是晚期气道并发症发生的危险因素,建议采取积极措施,将冷缺血时间缩短在600 min以内。Nęcki等[17]研究了冷缺血时间与肺移植术后气道介入治疗频率的关系,认为冷缺血时间延长可增加需要气道介入治疗的气道并发症数量。然而,冷缺血时间与肺移植术后气道并发症的关系仍存在争议。部分研究未显示冷缺血时间的长短与气道狭窄的发生率有直接关系[18-19],此外,有报道在双侧序贯式肺移植中,第二个支气管吻合口的并发症发生率并不高于第一个吻合口[5]。导致这些研究结果的原因尚不明确,可能与器官保存技术的发展有关,合适的器官保存液可以减轻供肺缺血时间延长导致的危害。
Frye等[5]的研究认为,肺移植术后机械通气,尤其是高水平呼气末正压(positive end-expiratory pressure,PEEP)的应用,可影响支气管黏膜血供,抑制侧支循环形成,导致吻合口愈合不良,从而形成中心气道狭窄。Van De Wauwer等[20]报道,供肺获取前接受较长时间(50~70 h)的机械通气是气道并发症发生的危险因素,这与本研究的结果相符。PGD可能是中心气道狭窄发生的危险因素,其是缺血-再灌注等多因素共同作用的结果,本质是急性肺损伤,可出现肺间质水肿、肺血流减少等表现,可能导致气道黏膜缺血以及血管重塑[21]。此外,术后早期出现PGD 3级,除需要体外膜肺氧合支持、调控液体负平衡外,常需要延长机械通气的时间[22],采取保护性的肺通气策略(小潮气量、高水平PEEP),进而导致中心气道狭窄的发生率升高。本研究中,狭窄组PGD 3级的发生率(25%)高于对照组(10%),单因素logistic回归分析结果显示差异有统计学意义,但未体现在多因素logistic回归分析中,可能与样本量不足有关,尚需进一步观察。
已有多项研究证实中心气道狭窄与真菌,尤其是曲霉感染之间存在显著相关性[18,23-24]。而细菌、巨细胞病毒感染与中心气道狭窄的关系存在争议[25]。值得注意的是,术前气道真菌定植也可能是气道狭窄发生的危险因素。推测原因为吻合口局部黏膜缺血可破坏黏膜屏障的完整性,使得曲霉等病原体损伤支气管壁,引起局部感染,进一步加重黏膜缺血,甚至导致黏膜坏死。可见,术前、术后的真菌定植及感染情况要引起重视。美国感染性疾病学会建议肺移植受者术后即开始预防性抗真菌治疗[26]。
目前已有多个肺移植中心采用程序性经支气管镜肺活检(transbronchial lung biopsy,TBLB)以监测急性排斥反应的发生[27-28],但本中心基于安全性的考虑,仅在怀疑受者出现急性排斥反应的情况下才实施TBLB,因此本研究限于数据不足,无法分析急性排斥反应与中心气道狭窄的关系。此外,近年来本中心对所有受者均采用端端吻合的方式进行支气管的吻合,尽可能保留较短的供者支气管,故本研究未对外科技术因素进行分析。
综上所述,中心气道狭窄是肺移植术后常见的并发症,影响受者术后生存。本研究结果显示,气道存在真菌感染及冷缺血时间、机械通气时间较长可能会导致肺移植术后中心气道狭窄。应采取积极措施预防,密切监测,以改善肺移植术后受者生存质量。

