心脏移植术后移植物血管病:阜外医院单中心长期随访结果总结
郑珊珊 郑哲 宋云虎 黄洁 廖中凯 房晓楠 刘盛
经过数十年的努力,心脏移植手术的成功率和受者远期生存率得到了大幅度的提高,心脏移植已成为终末期心力衰竭最有效的治疗手段。根据2019年国际心肺移植学会(International Society for Heart and Lung Transplantation,ISHLT)的报告,心脏移植术后受者中位生存期在不断延长,1982年至1991年为8.5年,而2002年至2009年已延长至12.5年,第1年存活的受者其中位生存期已达14.8年[1]。然而,同种异体心脏移植物血管病变(cardiac allograft vasculopathy,CAV)是威胁心脏移植术后受者长期存活的重要因素,术后1年CAV的发生率为7.7%,术后5年为29.8%,术后10年为46.8%,是心脏移植术后5~10年受者死亡的主要原因之一[1-2]。
CAV以冠状动脉内膜弥漫性增生为典型特征,移植术后早期即可出现CAV的初始征象,呈进行性发展[3]。CAV临床上可表现为心肌梗死、充血性心力衰竭、心律失常或心源性猝死[4]。由于供者心脏的去神经支配,CAV的发生发展通常是无声无息的,发现CAV时通常处于疾病的晚期[5],心源性猝死可能是CAV的首要表现[6]。诊断CAV后受者的生存率显著下降,因此早期识别CAV、预测心脏移植受者是否以及何时会发展成CAV并积极治疗是非常有意义的[7]。
中国医学科学院阜外医院于2004年常规开展心脏移植,从首例移植至今,已经过了十余年。在随访过程中,术后长期存活病例中CAV的问题逐渐显露,成为需要解决的棘手问题。本研究旨在总结心脏移植术后CAV的发生情况,分析CAV患者的临床资料、术后生存情况及死亡原因,并总结相关诊治经验,为下一步临床工作和研究方向提供依据。
1 资料与方法
1.1 一般资料
回顾性分析2004年1月至2020年12月在中国医学科学院阜外医院接受心脏移植且临床数据和随访信息完整的1 006例心脏移植受者的临床资料,最终共筛选出48例移植术后CAV患者,其中44例通过影像学检查发现,4例通过心脏活组织检查(活检)发现。4例活检发现CAV的患者由于缺失影像学证据,故不纳入本次分析。1 002例受者中,根据受者有否发生CAV分为CAV组(44例)和无CAV组(958例)。CAV组中,男37例,女7例,年龄(42±12)岁,原发病包括原发性心肌病25例、冠状动脉疾病13例、瓣膜病2例、先天性心脏病2例、其他2例。无CAV组中,男747例,女211例,年龄(46±14)岁,原发病包括原发性心肌病694例、冠状动脉疾病139例、瓣膜病35例、先天性心脏病12例、其他78例。
1.2 免疫抑制治疗及随访方案
免疫抑制治疗方案包括免疫诱导和免疫维持治疗,免疫诱导用巴利昔单抗联合甲泼尼龙,免疫维持治疗应用标准的三联疗法:环孢素或他克莫司+霉酚酸酯+泼尼松。对于存在肾功能异常的患者(术后3次血清肌酐>133 μmol/L),加用西罗莫司,并将他克莫司或环孢素减量,维持原血药谷浓度的1/3~1/2。此外,对于术后诊断为CAV的患者,视情况加用西罗莫司治疗。
心脏移植受者随访频率依据《中国心脏移植术后随访技术规范(2019版)》[8],结合术后临床表现决定。随访时间截止至2021年12月1日。
1.3 CAV的诊断标准
CAV的诊断标准参照ISHLT于2010年发布的关于CAV的标准化命名法[9],该指南将CAV分为4个等级,CAV 0级即未检测到冠状动脉病变,CAV 1~3级分别为冠状动脉轻、中、重度病变。通过冠状动脉CT血管造影(CT angiography,CTA)检查、冠状动脉造影(coronary angiography,CAG)或血管内超声(intravascular ultrasound,IVUS)检查,将存在左主干病变、其他主干血管病变(包括前降支、回旋支、右冠状动脉)及其重要分支血管病变(后降支、左室后支、钝缘支、对角支等)的患者诊断为CAV,并参照指南按严重程度分为CAV 1级、2级和3级。
1.4 研究内容
总结CAV的发生情况,比较两组患者的临床资料,包括受者资料、供者资料和围手术期资料,分析CAV患者的影像学诊断方式及冠状动脉病变情况、药物治疗及合并症情况、术后生存情况及死亡原因。
1.5 统计学方法
采用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,采用Student'st检验进行比较;非正态分布的计量资料以中位数(下四分位数,上四分位数)表示,采用Mann-WhitneyU检验进行比较;计数资料以率表示,比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,比较采用log-rank检验和Breslow检验。P<0.05为差异有统计学意义。
2 结 果
2.1 心脏移植术后CAV的发生情况
1 006 例心脏移植受者中共48例发生CAV,发生率为4.77%。48例CAV患者中4例因缺失影像学证据未纳入分析。44例CAV患者中,18%(8/44)于术后早期(术后1~12个月)发现CAV,20%(9/44)于术后中期(术后1~5年)发现CAV,61%(27/44)于术后晚期(术后5~10年)发现CAV。CAV患者发病时年龄为(47 ± 12)岁,心脏移植至CAV发病时间间隔的中位数为6.0(1.3,8.5)年。
2.2 两组患者临床资料的比较
CAV患者及无CAV患者的临床资料比较见表1。与无CAV组比较,CAV组患者术前吸烟史、术前高血压病史、原发病为冠状动脉疾病及围手术期感染比例均较高(均为P<0.05)。两组患者其余临床资料比较,差异均无统计学意义(均为P>0.05)。
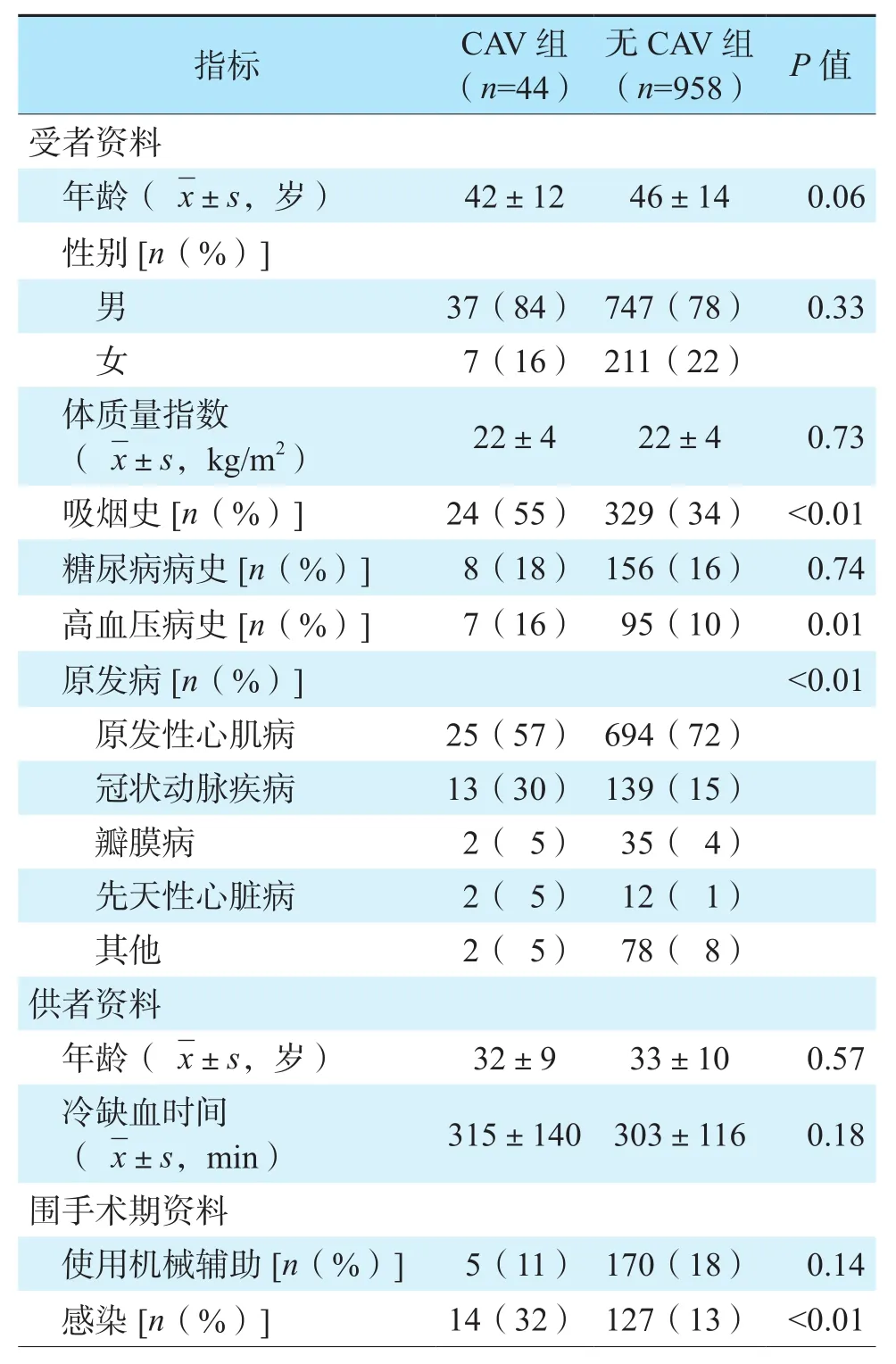
表1 两组患者的临床资料比较Table 1 Comparison of clinical data of patients between two groups
2.3 CAV患者的影像学诊断方式及冠状动脉病变情况
44例CAV患者中,24例通过冠状动脉CTA诊断CAV,4例通过CAG诊断CAV,16例联合使用冠状动脉CTA和CAG诊断CAV。患者冠状动脉血管病变以前降支为主(32例),其次为右冠状动脉(26例)和回旋支(24例)。29例患者存在近段血管病变,30例患者存在中段血管病变,21例患者存在远端血管病变。44例患者中,CAV 1级占45%(20/44),CAV 2级占30%(13/44),CAV 3级占25%(11/44)。
2.4 CAV患者的药物治疗及合并症情况
44例CAV患者中,22例术后使用环孢素+霉酚酸酯+泼尼松三联免疫抑制疗法,22例术后使用他克莫司+霉酚酸酯+泼尼松三联免疫抑制疗法。此外,19例患者除使用三联免疫抑制疗法外还加用西罗莫司治疗。全部患者术后长期使用他汀类药物治疗,7例存在高脂血症,在发现CAV后加用依折麦布治疗。在术后发现CAV后,有20例患者应用抗血小板药物治疗。在随访过程中,75%(33/44)的CAV患者伴有合并症,9例伴有高血压,14例伴有2型糖尿病,25例伴有高脂血症,10例伴有慢性肾功能不全。27例患者在发现CAV时出现一种或多种症状,9例出现心绞痛、13例出现心律失常和14例出现心力衰竭。
2.5 CAV患者术后生存分析与死亡原因分析
44例CAV患者中,11例患者发现CAV后接受经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI),植入支架后,3例患者死亡(1例患者出现支架闭塞,因移植物衰竭行再次心脏移植,术后因排斥反应死亡,其余2例患者死亡原因分别为移植心脏衰竭和排斥反应),2例患者出现支架近段或远端严重狭窄,至投稿日仍存活;未行PCI的33例患者中有5例患者接受再次心脏移植,存活至投稿日,5例患者死亡,死亡原因包括多器官衰竭1例、脑卒中1例、移植心脏衰竭3例。
截止至投稿日,CAV组患者中位随访时间为13.3年,最长随访时间为17年,最长生存时间为17年;无CAV组患者中位随访时间为5.9年,最长随访时间为17年,最长生存时间为17年。CAV组和无CAV组患者术后Kaplan-Meier生存分析结果见图1,两组患者术后长期生存率差异无统计学意义(P= 0.61),但在诊断CAV后(术后6~7年),患者的生存率呈下降的趋势。不同严重程度的CAV患者术后Kaplan-Meier生存分析结果见图2,CAV 1级、CAV 2级和CAV 3级患者术后长期生存率差异无统计学意义(P= 0.62),但即使是病变较轻的CAV 1级患者,术后远期生存率也呈下降趋势。
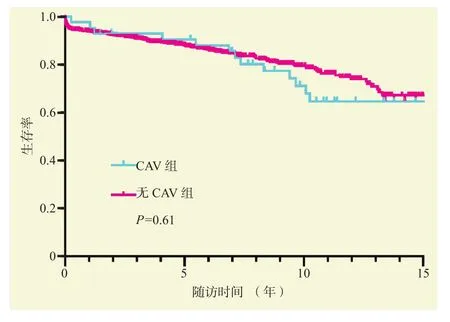
图1 两组患者心脏移植术后生存曲线Figure 1 Survival curves of patients after heart transplantation in two groups
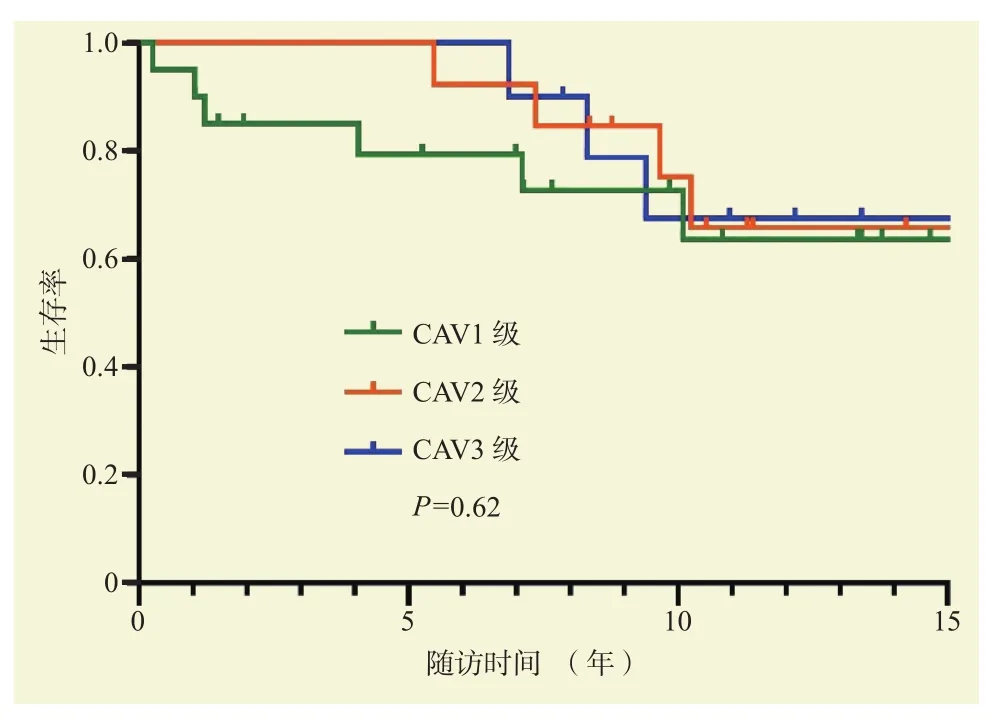
图2 不同严重程度的CAV患者心脏移植术后生存曲线Figure 2 Survival curves of patients with different severity of CAV after heart transplantation
3 讨 论
CAV仍然是一个棘手的问题,是心脏移植术后5~10年受者死亡的主要原因[10-11]。在阜外医院长期随访的病例中,CAV占比越来越高,占总移植例数的4.77%。临床资料分析表明,受者有吸烟史、高血压病史、冠状动脉疾病史、围手术期感染是心脏移植术后发生CAV的高危因素,对于这类患者需要重点关注术后冠状动脉情况。生存分析表明CAV组和无CAV组患者术后长期生存率差异无统计学意义,但可以观察到在诊断CAV后(术后6~7年),患者的生存率呈下降趋势。由于样本量较小,CAV 1级、CAV 2级和CAV 3级患者术后长期生存率差异无统计学意义,但从生存曲线可以观察到即使是病变较轻的CAV 1级患者,术后远期生存率也呈下降趋势,提示无论CAV的程度轻重都应引起临床医师的重视并进行早期诊治。
免疫和非免疫途径介导的内皮损伤被认为与CAV的发展密切相关[3-4,10-12],导致CAV的相关事件贯穿心脏移植的全过程[10]。心脏移植前,供者高龄、吸烟史、高血压病史、创伤性脑死亡以及由此引发的儿茶酚胺风暴,是移植术后受者发生CAV的高危因素[6-13]。在围手术期,供者心脏缺血-再灌注损伤和由此伴随的冠状动脉血管内皮炎是促使CAV发生发展的重要因素。至术后早期,移植物-宿主相互作用介导的排斥反应开始占主导地位。研究表明,受者术后出现排斥反应事件的频率及严重程度与CAV发生率增加有关[3,14-15]。此外,巨细胞病毒感染也与CAV发生发展有关。有文献表明,在被巨细胞病毒感染后,一些患者迅速发生CAV[4,16-17]。其机制可能为巨细胞病毒感染诱导炎症,并通过系统免疫调节机制,导致排斥反应和CAV的发生[4-18]。术后远期,经典的心血管危险因素 (如高血压、高脂血症、肾功能不全和肥胖),也会导致CAV[4-6]。因此,在2010年ISHLT指南中[19],强烈建议心脏移植术后受者严格控制心血管危险因素,如高血压、糖尿病、高脂血症、吸烟和肥胖。
CAG是诊断CAV最常用的方法,被认为是评估CAV的金标准[20]。2010年ISHLT指南建议心脏移植受者每年或每两年进行一次CAG,以评估心脏移植术后CAV[19]。然而,CAG通常低估了CAV的严重程度[21]。IVUS能够评估病变形态和病变分布,在诊断CAV上IVUS通常比CAG更加敏感[4]。若IVUS检测到最大内膜增厚的早期变化(心脏移植术后6周~1年),可将其作为预后的标志[9]。考虑到IVUS是侵入性检查且费用较高,ISHLT指南并不建议将IVUS作为心脏移植术后常规检查。心内膜心肌活检在诊断CAV方面的价值有限,很少用于诊断CAV[22],但能够检测出CAV的促成因素,如排斥反应[23]。对于不能进行CAV侵入性评估的患者,踏车或多巴酚丁胺负荷超声心动图和心肌灌注成像有一定的提示作用[19]。也有研究表明心血管MRI和冠状动脉CTA对CAV的诊断有所帮助[24-25],但检查可能受高静息心率的影响,其诊断及预测价值仍有待确定[4]。
CAV的治疗主要是针对初级预防,包括药物干预和非药物干预[10]。CAV的药物干预主要通过抗内皮增殖、降血脂、降血压等方面,但应注意不损害肾功能[10]。非药物干预包括PCI、冠状动脉旁路移植术(coronary artery bypass grafting,CABG)、再次移植等。球囊血管成形术和PCI已被用于局灶性病变的CAV患者[26]。弥漫性冠状动脉受累的患者由于远端血管质量较差,PCI仍然无效[27-28]。CAV患者行CABG伴有较高的手术风险,病死率较高[29-30]。存在局限性近段病变而远端血管条件较好的CAV患者,可尝试进行CABG;存在弥漫性病变的患者则不适合进行CABG[30]。再次心脏移植是重度CAV患者的最终选择,适用于出现严重CAV伴有难治性移植物功能障碍而无持续排斥反应证据的患者[20]。然而,再次心脏移植的早期及晚期预后均较差(1年生存率为 60%~74%)[31]。CAV患者再次心脏移植需要考虑移植成功的可能性,术前需排除排斥反应的存在,对循环抗体阳性的患者需要进行预处理,并注意选择合适供者[31]。
本研究存在一定的局限性。首先,本研究是一项单中心回顾性研究,受限于回顾性研究固有的局限性,可能存在漏诊的情况。其次,本研究仅是早期探索性研究,由于病例数和随访时间有限,并不能系统评价各种治疗的疗效。但是,本中心作为国内最大的心脏移植中心之一,首次总结我国心脏移植术后长期存活患者中CAV的发病情况及预后,具有较高的参考意义和指导价值。
综上所述,CAV是我国心脏移植常见且棘手的术后远期并发症,在诊断CAV后,患者的长期生存率呈显著下降的趋势。应加深对CAV的认识,早期预防、诊断及治疗,以提高患者心脏移植术后的长期生存率。

