中国移植器官保护专家共识(2022版)
中国肝移植注册中心 国家肝脏移植质控中心 国家人体捐献器官获取质控中心 国家骨科与运动康复临床医学研究中心 中国医师协会器官移植医师分会移植器官质量控制专业委员会中国医院协会器官获取与分配工作委员会 国家创伤医学中心器官保护专业委员会
器官移植是目前治疗终末期器官衰竭最有效的手段,而器官短缺是制约器官移植工作开展的全球性问题[1-2]。供器官获取、保存及移植后缺血-再灌注损伤(ischemic-reperfusion injury,IRI)是影响预后的重要因素。自20世纪器官移植技术开展以来,器官保护技术一直是该领域的研究热点。器官保存液如Collins液、威斯康星大学保存液(University of Wisconsin solution,UW液)、组氨酸-色氨酸-酮戊二酸盐液(histidine-tryptophan-ketoglutarate solution,HTK液)等相继问世,促进了器官静态冷保存(static cold storage,SCS)技术的迅速发展[3]。随着对移植器官IRI认识的不断深入,对器官保存质量、保存时限要求的不断提高,为适应不断增长的供器官需求和接受扩大标准供者(expanded criteria donor,ECD)器官,针对不同器官的专用保存液如改良的HTK液(HTK-N液)、肺脏保存液(如Steen液)、肾脏灌注液(如KPS1液)等被相继研发[4-6]。目前,SCS仍然是器官移植的标准保存技术[3],但SCS会导致器官冷缺血损伤,且无法在冷保存过程中有效地评估器官功能。机械灌注器官保存技术包括常温机械灌注(normothermic machine perfusion,NMP)(32~37 ℃)、亚常温机械灌注(subnormothermic machine perfusion,SNMP)(20~32 ℃)、低温携氧机械灌注(hypothermic oxygenated machine perfusion,HOPE)(0~12 ℃)和低温机械灌注(hypothermic machine perfusion,HMP)(0~12 ℃)。此外,如超低温保存(supercooling preservation,-6~-4 ℃)等新型保存技术也相继出现[7]。离体灌注系统能够在不同温控条件下,实现在器官保存过程中清除代谢废物、提供满足器官代谢需求的基本物质,不仅能延长器官保存时间,同时也能评估离体器官功能、改善器官质量,减少术后相关并发症的发生,提高边缘器官的利用率。多项发表在高质量期刊上的临床随机对照试验(randomized controlled trial,RCT)研究结果也证实机械灌注能显著修复供器官质量及减少移植后相关并发症的发生率[2,8-12],未来有望强力推动器官移植事业进步。
本共识参考国内外相关领域研究,旨在为器官(肝脏、肾脏、胰腺、小肠、心脏、肺脏)以及复合组织(断肢)保护提供建议及证据支持,共识证据参考2009年牛津证据分级(表1),推荐意见强度主要参考 GRADE(Grades of Recommendation,Assessment,Development and Evaluation)系统:(1)强推荐,指明确显示干预措施利大于弊或弊大于利;(2)弱推荐,不能确定临床决策或干预措施的利弊或无论质量高低的证据均显示利弊相当[13]。
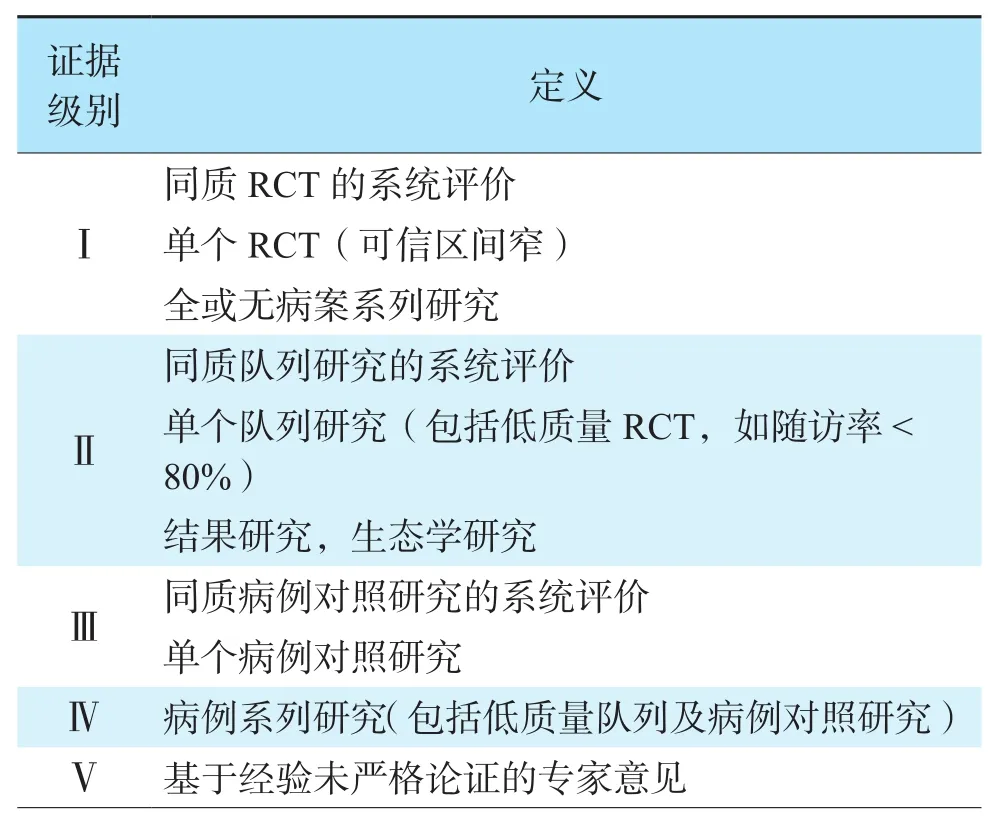
表1 循证医学证据分级Table 1 Grading of evidence based medicine
1 腹部器官获取与供器官保护
不同条件下,各移植中心的腹部器官获取技术有所不同,对于血流动力学相对稳定的脑死亡器官捐献(donation after brain death,DBD)供者,可采用单独切取的方法获取供器官,亦可采用腹部器官联合切取后再进行器官分离。对于心脏死亡器官捐献(donation after cardiac death,DCD)或脑-心双死亡器官捐献(donation after brain death followed by cardiac death,DBCD)供者,为尽量缩短器官热缺血时间,应采取腹部器官联合快速切取法。近来,部分中心采用体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)、常温局部灌注(normothermic regional perfusion,NRP)及NMP进行腹部器官获取,取得不错的临床效果[14-16]。活体供器官移植是缓解供器官短缺的有效途径,供者安全是活体器官移植的重中之重,故须严格筛选供者,并由专业培训的外科医师进行精细操作[17]。在体劈离式肝移植是缓解供肝短缺重要方式,有报道血流不稳定供者在ECMO的支持下进行在体肝脏劈离,并用于肝移植取得良好预后[18]。
1.1 肝脏保存修复
供肝质量直接关系到受者移植手术的成功率及预后。目前临床一般通过供者年龄、体质量、肝功能、重症监护室(intensive care unit,ICU)入住时间、热缺血时间、冷缺血时间及肝脏病理等参数综合评价供肝质量[19]。总热缺血时间是指供者停止治疗至冷灌注开始的时间,功能性热缺血时间是指平均动脉压<60 mmHg(10 mmHg=1.33 kPa)或脉搏血氧饱和度(pulse oxygen saturation,SpO2)<80%时至冷灌注开始的时间[20]。热缺血时间与供器官损伤密切相关,供肝功能性热缺血时间一般不超过30 min[21-22],尤其在高钠血症供者中,应尽量减少供肝缺血时间[23]。
供肝获取过程中应以UW液或HTK液等器官保存液充分灌洗,在体灌注不充分时,可在获取后离体灌洗。获取操作应动作轻柔,注意保护第一肝门。尤其是在劈离式肝移植中,要尽量保护好两侧供肝的血管及胆管[24]。
供肝离体保存效果直接影响供肝质量。SCS是目前供肝保存应用最广泛的方法,UW液和HTK液在国际上应用最广泛,其他保存液如Celsior液、Institute Georges Lopez(IGL)-1液、Leeds液等也有报道[25-26]。一项超过2 000例器官保存的Meta分析显示,不同保存液对于肝移植术后肝功能恢复、原发性无功能(primary nonfunction,PNF)及胆道并发症无显著影响[22]。供肝SCS过程中存在冷缺血损伤,过长冷保存即冷缺血时间延长可以引起胆道并发症、移植物失功甚至受者死亡。理想供肝的冷保存时间不超过8 h,临床实践中供肝的保存时限一般不超过12~15 h[27-28]。近年来,超低温冷保存(-6~-4 ℃)受到关注。临床前研究证实超低温冷保存技术有望延长供肝离体保存时限,但仍需要进一步研究[29-30]。
不同于SCS,机械灌注是通过器官固有血管系统插管予以连续动态灌注以输送养分,同步实现器官保存与修复。该项技术对延长器官保存时限,改善器官质量具有重要价值。目前处于临床研究及验证阶段的机械灌注系统有LifePort肝脏修复系统(Organ Recovery Systems, 美 国)、Liver Perfusor系 统(Lifeperfusor, 中 国)、OrganOx系 统(OrganOx Ltd,英国)及多功能机械灌注Liver Assist系统(Organ Assist BV,荷兰)等。临床RCT研究证实机械灌注对不同类型供肝有一定保护作用[31-34],HOPE可以减少DCD供肝肝移植术后胆道并发症的发生率[2]。但HOPE对脂肪变性供肝的修复作用仍需进一步研究证实[35]。NMP因更符合生理,不仅可以促进移植术后肝功能恢复,还可以减少供肝弃用率[36-37]。
机械灌注为供肝获取、保存及修复提供了新思路,且保存及转运过程中可实时监测肝功能、胆汁分泌等指标,动态评价供肝质量。随着研发技术的进步与完善,机械灌注将具有重要的临床应用前景[38]。腹部器官获取及肝脏保存修复推荐意见见表2。
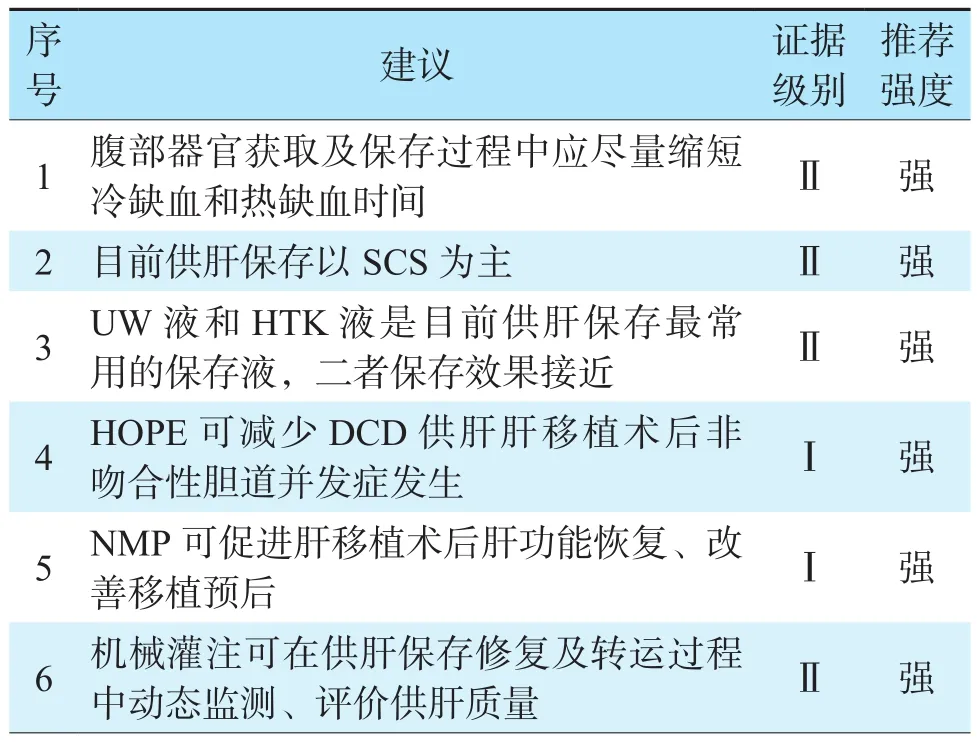
表2 腹部器官获取及肝脏保存修复推荐意见Table 2 Recommendations for abdominal organ acquisition and liver preservation and repair
1.2 肾脏保存修复
由于经济、简便和有效的优势,SCS在移植器官保存中占有主导地位[39]。为弥补供器官短缺,包括ECD与DCD在内的边缘供器官使用比例明显增加,然而这类供肾发生移植肾功能延迟恢复(delayed graft function,DGF)、PNF以及急性排斥反应等并发症的风险较高。这不仅对供肾的保存技术以及移植前的修复工作提出了更高的要求,也极大推动了HMP和NMP等肾脏机械灌注技术的提升与临床应用[40]。
SCS液主要包括:UW液、HTK液、Marshall液、高渗枸橼酸盐嘌呤溶液(hypertonic citrate adenine solution-Ⅱ,HC-A Ⅱ液)、Celsior液、IGL-1液等,其中UW液和HTK液最为常用[3,39]。近期有研究表明,IGL-1液在肾移植中应用可以达到与UW液以及HTK液相当的效果[39,41]。此外,一些研究发现在上述保存液中添加某些成份,例如M101和抗氧化剂等,可以提升供肾保存效果[42-43]。尽管保存液不断得以优化,但冷缺血时间过长仍是导致肾移植术后DGF的独立危险因素,特别是经历过热缺血的供肾,因此,应尽可能缩短供肾冷保存时间以提高肾移植预后[44-45]。
与SCS相比,HMP具有减轻血管痉挛、供给能量与氧气、清除代谢废物和作为供肾评估或修复平台等优势[46]。研究证实,HMP可以显著降低肾移植术后DGF发生风险[47-48]。目前,市面上常用的便携式HMP系统包括LifePort Kidney Transporter(Organ Recovery Systems, 美 国)、RM3(Waters Medical System,美国)、Kidney Assist(Organ Assist BV,荷兰)和WAVES(Institut Georges Lopez,法国)。HMP系统主要参数包括灌注流量、阻力指数、压力和温度,其中阻力指数和流量是肾移植术后重要的预后指标,但不能作为独立评估指标且无统一的标准,灌注压力宜控制在30~40 mmHg,以确保在有效灌注的同时减少血管内皮损伤,最佳灌注温度为4~10 ℃[49-50]。此外,HMP期间虽然监测灌注液中某些指标,如谷胱甘肽转移酶、乳酸脱氢酶、白细胞介素-18和黄素单核苷酸(flavin mononucleotide,FMN)等可以反映供肾的损伤情况,但是,用于判断肾移植预后(如DGF、PNF和移植物存活)的准确性仍然有限,目前临床上尚无公认、可靠的灌注液生物标志物[51-52]。供肾HMP最佳时间目前没有统一标准,但是,临床证据表明HMP可在一定程度上有效延长供肾冷保存时间,并且供肾获取后尽早接受HMP以及连续进行HMP对供肾质量和肾移植预后的改善效果更佳。考虑到冷缺血时间较长是HMP保存供肾发生DGF的独立危险因素,故应尽可能控制HMP保存时间[53-54]。关于HMP是否应该携氧仍然没有定论,虽然有临床证据表明与非携氧HMP组相比,HOPE组严重并发症及急性排斥反应发生率均有所降低,但两组受者的生存率差异无统计学意义,DGF与PNF发生率相似。高浓度输送氧气对供肾的影响有待未来更多的临床研究予以揭示[10,55]。
理论上,接近人体生理环境的NMP是一种较HMP或SCS更为理想的供肾保存、质量评估、损伤修复与治疗平台[56-57]。有研究初步证实NMP有助于供肾功能的恢复,具有一定的临床适用性和安全性[58-59]。目前,尚无公认的肾脏NMP仪器与灌注体系。现有研究中,NMP灌注液基本由晶体溶液(如林格氏液)、胶体溶液(如白蛋白)、红细胞悬液、血管舒张剂、营养成分(如葡萄糖、维生素等)、抗生素以及抗炎药物(如地塞米松)组成。氧合气体多选择95% O2与5% CO2的混合气体,采用70~85 mmHg及37 ℃为NMP的灌注压及温度[57,60]。目前体外NMP保存肾脏时长可达24 h[59]。虽然临床前研究证实,连续长时间NMP相较于SCS或移植前短暂NMP能显著改善供肾质量及肾移植近期预后,但NMP最佳灌注时长尚无临床证据支撑[61-62]。肾脏NMP有助于术前对供肾进行质量评估及靶向干预,从而扩大供者池[63-64]。NMP供肾质量综合评估体系主要包括:灌注参数和代谢指标(包括肾血流量、尿量、氧耗量、电解质、肌酐清除率等),尿液生物标志物(中性粒细胞明胶酶相关脂质运载蛋白-1等),组织学检查(Remuzzi评分等)以及肾脏NMP评分等[57,60,65]。目前肾脏NMP的各方面研究都十分有限,与其他保存方法的优劣对比也缺乏临床证据[65]。
现阶段,新兴供肾保存技术不断涌现,如SNMP、控制性携氧复温(controlled oxygenated rewarming,COR)等,机械灌注联合各类干预手段(例如细胞、基因等)作为治疗平台均展现出一定的临床应用潜力,但是考虑其大多处于临床前研究阶段,相关临床研究资料匮乏,因此临床应用需十分谨慎[66-68]。肾脏保存修复推荐意见见表3。
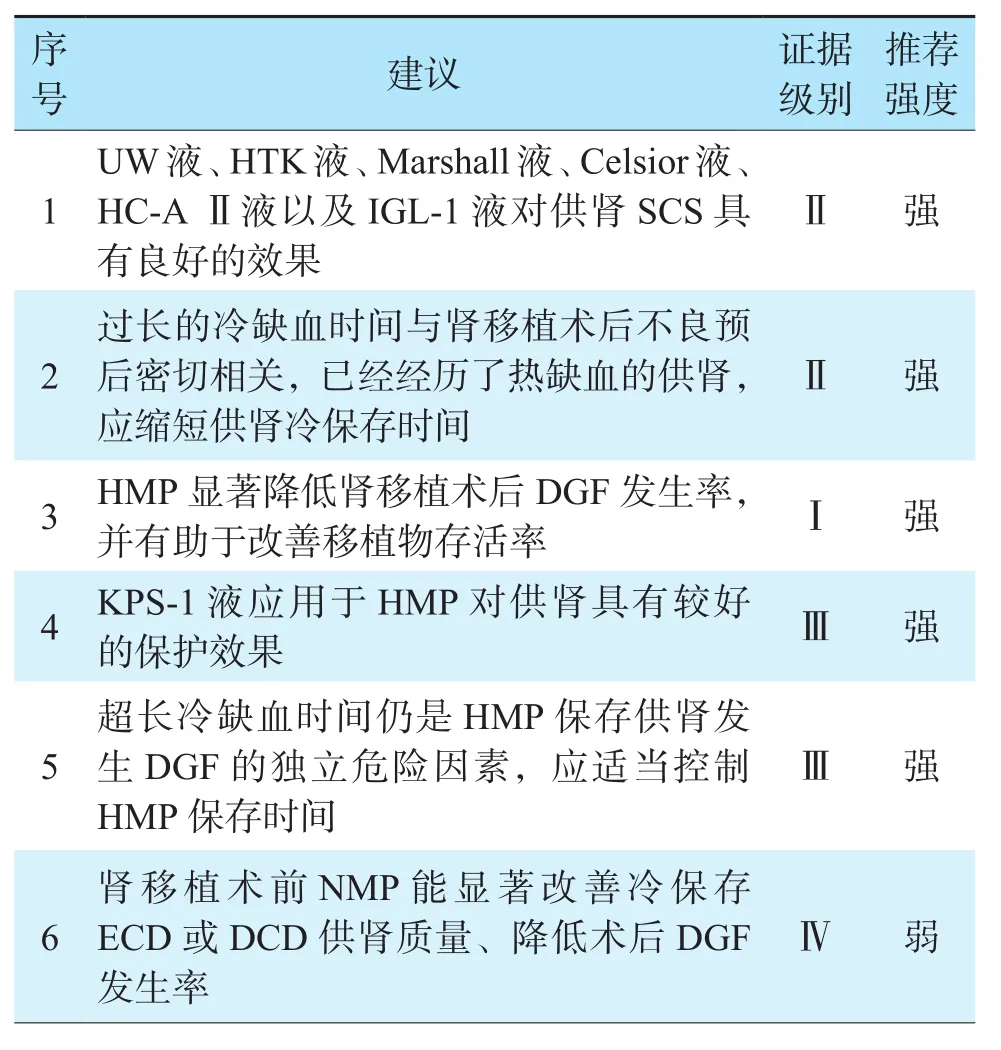
表3 肾脏保存修复推荐意见Table 3 Recommendations for kidney preservation and repair
1.3 胰腺保存修复
目前胰腺移植和胰岛移植手术主要应用于1型及部分2型糖尿病患者[69-71]。胰腺移植分为胰肾联合移植、肾移植后胰腺移植和胰腺单独移植。胰岛移植技术要求简单,手术创伤小,安全性好。胰岛移植受者5年脱离胰岛素治疗的比例已达50%以上,其长期疗效已接近胰腺移植[72]。随着高质量胰腺供者越来越稀缺,ECD逐渐被广泛使用[73-74]。近年来,胰腺移植率呈下降趋势,原因主要包括转诊人数不足,复杂糖尿病的非移植治疗得到改善,移植风险增加(尤其是肥胖和年龄),以及对移植预后的担忧[75]。通过保护和修复技术改善胰腺质量可降低胰腺移植术后早期并发症(如血管并发症和再灌注胰腺炎)的发生[75]。
目前胰腺保存方法主要有SCS、双层保存法和机械灌注。SCS仍是目前胰腺获取后的主要保存方法,可使冷缺血时间延长至12 h[76]。在SCS中,HTK液可能导致胰腺细胞水肿,与移植后早期移植物失功和移植后胰腺炎相关[77],Celsior液可能会增加胰腺IRI,而UW液可有效保护获取后的胰腺组织,因此,胰腺和胰岛的体外保存多选用UW液[78]。双层保存法是指使用含有UW液和全氟化合物的保存体系,将离体胰腺保存在两层不相融的液体中间,为保存的胰腺提供氧气,可延长冷保存时间及提高边缘供胰的利用率[79-80],但近年来研究较少。机械灌注在胰腺保存修复中的应用仍处于实验研究阶段,急需开展不同保存技术的前瞻性临床研究。胰腺是一个低流量器官,血管解剖复杂,与其他器官不同,很难设立理想的血流和压力灌注参数,高灌注压力可导致血管内皮损伤和血栓形成率增加,而过低的灌注压力可导致灌注不足和氧合不足,故在低温和常温灌注中,“低”压力灌注在保护胰腺组织功能方面具一定的优势[81]。HOPE也可有效改善离体胰腺组织[82-83],对离体胰腺进行6 h HOPE,可显著提高废弃DCD胰腺质量,并完全分离出功能性胰岛用于后续移植[84]。胰腺NMP相关研究目前仍处于探索实验阶段,还需进一步的研究。
对于胰岛移植,在胰岛制备过程中,一项单中心随机对照研究发现,富含一氧化碳的培养液可用于分离制备胰岛细胞,提高胰岛细胞的质量及术后移植成功率,并在慢性胰腺炎患者胰岛自体移植中显示出更好的治疗效果[85]。分离纯化后的胰岛细胞建议在培养基中孵育24~72 h,可有助于:(1)在移植前提供充足的时间对移植物进行质量控制,并对受者进行免疫诱导;(2)胰岛内浸润的过客白细胞迁出,减少移植后的急性排斥反应;(3)减少移植物中组织因子的表达,减少移植后经血液介导的即时炎症反应;(4)去除坏死与凋亡的胰岛细胞,并通过多次洗涤减轻损伤相关分子模式(damage associated molecular pattern,DAMP)导致的损伤,减少移植后的固有免疫应答。另外,胰岛细胞的培养技术可确保进行胰岛转运,并及时送达目的地。如运输条件无法满足胰岛培养,可以选择胰岛冷保存。如移植前需要培养,将胰岛细胞悬浮培养于含有10%~15%人血清白蛋白的CMRL1066培养液(葡萄糖浓度为5.5 mmol/L),培养条件为5% CO2、37 ℃悬浮培养24 h,而后在22 ℃条件下继续培养24~48 h,培养总时长不应超过72 h[86]。
总之,胰腺和胰岛移植具有极大的临床应用价值,在胰腺的体外保存方面目前以SCS为主,更多有效的胰腺保存修复技术以及胰岛细胞的分离和培养技术需进一步探索。胰腺保存修复推荐意见见表4。
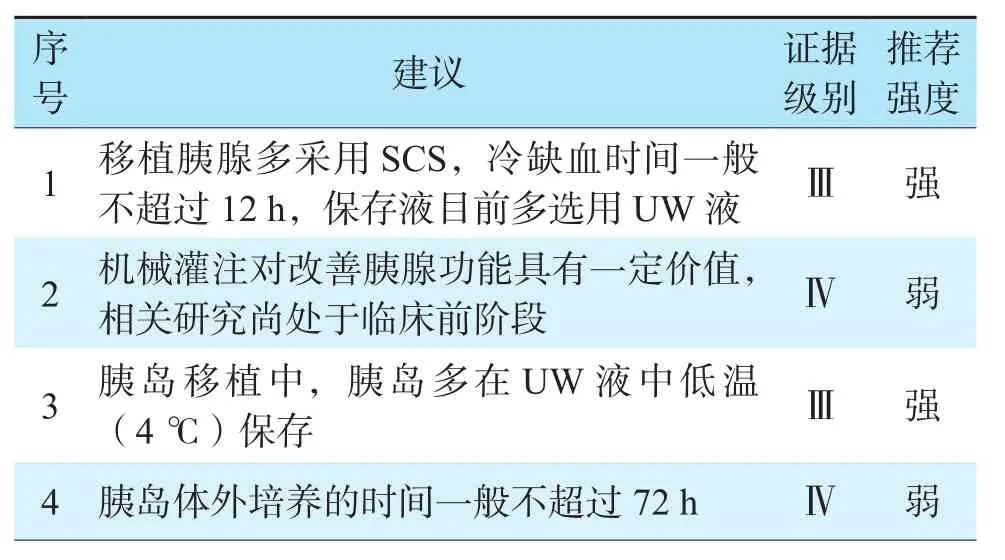
表4 胰腺保存修复推荐意见Table 4 Recommendations for pancreas preservation and repair
1.4 小肠保存修复
小肠移植是治疗肠衰竭最有效的方法[87]。小肠对缺血损伤尤为敏感,缺血损伤可致肠黏膜受损,肠道细菌移位至肝脏、脾脏等肠外器官导致全身感染,且作为一种非特异性损伤会提高移植物免疫原性,加重急、慢性排斥反应[88]。因此,供器官保护在小肠移植中尤其重要。
目前低温灌洗及SCS是小肠获取及保存中减少小肠损伤的重要手段。与其他实质性器官不同,由于肠腔内含有大量消化酶、细菌及毒素,小肠保存时需行血管和肠管双重灌洗。小肠获取时首次血管灌洗是有益的,不推荐保存结束前二次血管灌洗。在供肠获取时,应尽量缩短热缺血时间,最长一般不超过60 min[89]。
在血管灌洗及离体保存中,较多选用UW液,但HTK液亦有应用报道[90]。HTK液与UW液对小肠移植受者早期生存率、肠道功能、并发症发生率的影响差异无统计学意义[91]。HTK液较UW液价格便宜,且粘度低,更利于微血管的灌洗[92]。IGL-1液能够更好地保存肠道[93],已安全地用于临床,且获得了良好的短期效果[94]。但目前何种保存液最利于小肠保存尚无定论。冷保存时间是影响小肠移植预后的重要因素,目前小肠移植冷缺血时间尽量控制在9 h以内[95]。临床及动物实验证实多数小肠保存液可有效保存小肠6~8 h[96]。
冷保存期间的肠道腔内干预可减轻IRI。研究表明,含有聚乙二醇的腔内保存液可用于肠道的保存,其可与上皮细胞结合改变黏膜屏障功能特性[97-98]。Søfteland等[97]发现低钠的聚乙二醇腔内保存液可更好地保存肠道且不加重细胞水肿。尽管IGL-1含有聚乙二醇,但其钠含量相对较高,被证明不适合腔内保存[94]。有研究发现使用HTK液或HTK-N液作为肠腔内保存液能够更好地保护肠黏膜结构和移植物活力[98]。
目前机械灌注在小肠移植领域仍处于临床前阶段。2003年,Zhu等[99]开展了首例低温氧合肠腔机械灌注,发现与SCS相比,机械灌注能更好地保存小肠。2015年美国耶鲁大学报道了一种新型的小肠保存装置,首次采用了血管与肠腔双腔灌注,使供肠病理学表现得到进一步改善[100]。2020年,Guo等[101]发现短期ECMO能够减轻小肠的IRI,改善移植术后早期肠道吸收功能。2021年,Hamed等[102]首次通过NMP来保存小肠,保存期间小肠蠕动功能、葡萄糖吸收功能及胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)的分泌功能均得到有效维持,组织病理学无恶化。小肠保存修复推荐意见表5。
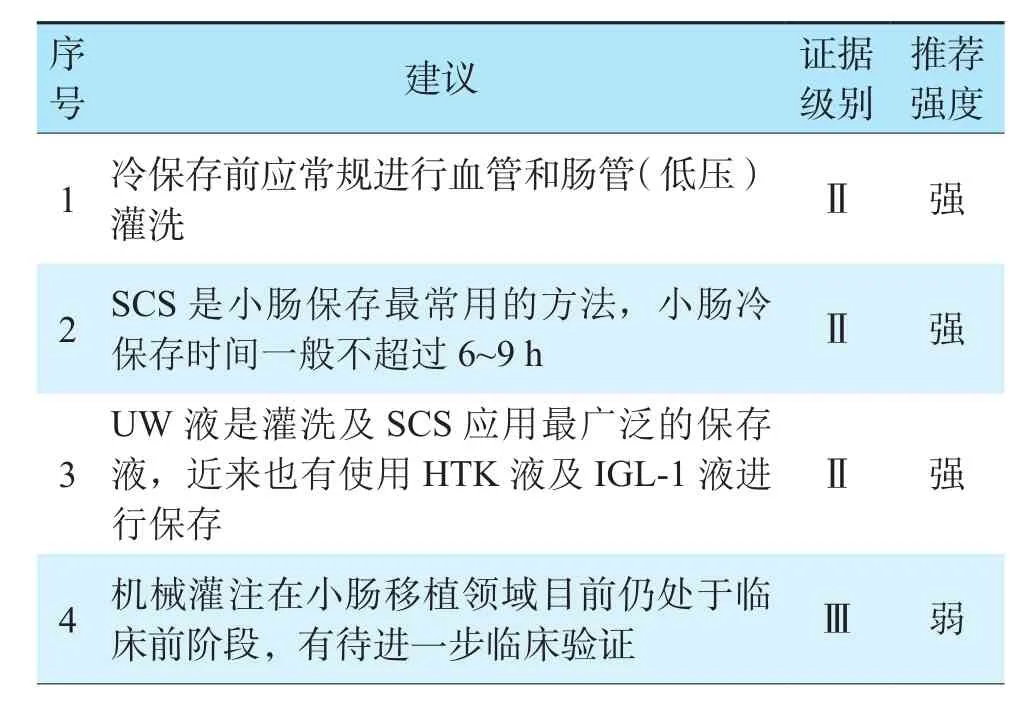
表5 小肠保存修复推荐意见Table 5 Recommendations for small intestine preservation and repair
2 胸部器官获取与供器官保护
2.1 心脏保存及修复
全球心力衰竭患者超过2千万,5年病死率高达50%。心脏移植是终末期心力衰竭最有效的治疗手段[103],但供心短缺严重影响心脏移植的开展。供需之间的巨大矛盾促使临床不断寻求各种解决途径来扩大供器官来源。人们把目光转向边缘供心,目前澳大利亚和英国已经完成了200多例DCD供心移植,但是DCD供心移植还需要更多临床实践及更先进的供心保存和修复技术来降低风险[103-106]。
目前心脏移植供者主要选择DBD供者,DCD供者被认为是非常重要的潜在供者来源[103,105-106]。供心获取过程与供心质量密切相关,供者脑死亡后,选择正中切口,劈开胸骨,剪开心包,阻断升主动脉,主动脉根部加压灌注4~8 ℃心肌保存液(1~3 L)进行停跳和冲洗,表面置冰屑使心脏快速降温,同时迅速剪断上腔静脉和下腔静脉,给心脏减容减压,然后依次切断肺静脉、主肺动脉和主动脉,停跳液的灌注压维持于50~70 mmHg。如心肺联合获取,则建议心肺胸内整体获取,不离断肺静脉,获取后根据需要整体移植或在体外行心肺分离。研究发现供心质量与冷缺血时间相关,冷缺血时间一般不超过6 h,最佳时间为4 h以内[103-104]。DCD供心的热缺血时间一般少于30 min[107-108]。
离体供心保存与修复技术包括SCS、HMP和NMP,其中SCS应用最广泛。SCS是将供心浸泡于含0~4 ℃保存液的容器中,在低温条件下保存并转运。HMP是将供心保存于4~8 ℃,并为冠状动脉循环持续低流量灌注,为心肌组织供应代谢所需充足的氧气与营养物质,清除代谢产物,降低冷缺血对心肌细胞和上皮细胞造成的损伤。并使心脏始终处于均匀的低温环境中。Brant等[109]研究表明,无论经主动脉顺行持续机械灌注还是经冠状静脉窦口逆行机械灌注,Celsior液对供心的保存效果接近SCS。但是长时间低温灌注引起的心肌水肿问题限制了该方法的临床应用[103]。NMP是一种接近生理状态的保存方法,离体供心保存时间可达12 h或以上[104,110]。目前,美国的Organ Care System已经进入临床试验阶段[111]。最近一项随机对照临床试验中比较了常温不停跳灌注系统和传统的SCS,发现术后30 d两组受者存活和移植物功能差异无统计学意义,术后2年生存率相似[112]。在最近一项小规模临床试验证实常温离体心脏灌注效果优于传统的SCS[113]。
虽然离体心脏机械灌注具有潜在的供心保护能力,可一定程度促进DCD供心复苏[114],但在灌注液的选择、灌注参数的优化上还需深入研究。如何利用常温离体心脏灌注技术对供心进行有效的功能评估也是一个重要问题[115]。在Organ Care System中,乳酸含量对心脏移植效果的预测有很大的局限性。此外,White等[116]在一组大型动物实验中证明了收缩性参数可能比代谢参数在预测供心功能方面意义更大。然而,目前尚未确定最佳的供心评估方法。
在供心保存液方面,应用最普遍的有UW液、HTK液以及Celsior液。UW液是具有较高渗透压和粘度的高钾溶液,应用于机械灌注时,组织水肿发生率比Celsior液低,但易导致心脏血管异常收缩;HTK液是一种低钠、低钙、微高钾且富含组氨酸的器官保存液,具有较强的缓冲能力,可减轻心肌细胞水肿;Celsior液兼具UW液的渗透功效和HTK液的缓冲能力,但是长时间保存易导致心肌水肿。目前尚无一种心肌保存液有绝对的优势[117]。近来新型心肌保存液或改良保存液,如细胞外液型保存液Somah液、在Celsior液基础上发展起来的CRMB液以及HTK液基础上发展而来的Custodiol-N液,虽然从理论上有着更多的优势和心肌保护效果,但目前仍处于实验研究阶段,需进一步得到临床验证[118]。心脏保存修复推荐意见见表6。
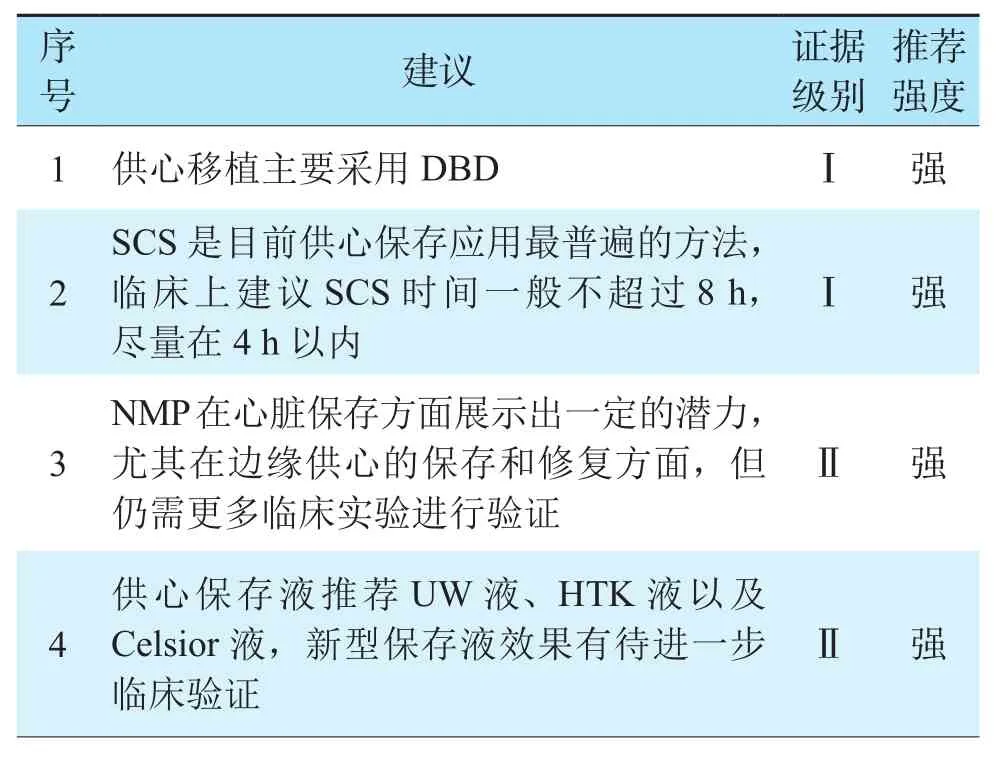
表6 心脏保存修复推荐意见Table 6 Recommendations for heart preservation and repair
2.2 肺脏保存及修复
肺移植是治疗终末期肺病的唯一有效手段。供肺的获取和保存直接影响供肺质量,从而关系着移植成败。根据2015年至2018年的肺移植数据,我国供肺利用率仅为5.5%[119]。近年来,随着肺移植需求日益增加,以及相应保存与修复技术的发展,越来越多的边缘供肺应用于临床,并取得与理想供肺相似的效果[120-123]。
严格的供肺质量评估有助于提高移植成功率,移植前须判定供肺是否符合移植要求以及是否需行供肺离体修复。供者评估主要包括:氧合指数、年龄、吸烟史、胸部影像、支气管镜检查及痰涂片镜检,同时予以供者各系统的支持措施[124]。
供肺获取直接影响供肺质量,在供肺获取过程中应尽量缩短热缺血时间。有回顾性研究发现热缺血时间在60 min以内的供肺对受者的生存无显著影响[125]。供肺冷缺血时间的长短与预后相关,目前研究建议供肺冷缺血时间应小于8 h[126-127]。若使用离体肺灌注修复系统(ex vivolung perfusion,EVLP),则冷缺血时间不宜超过287 min[128]。供肺离体时,推荐保存温度4~8 ℃。总缺血时间<4 h能够显著改善受者术后30 d内总体生存率[129]。
SCS作为目前广泛应用的离体肺保存技术,有多种适用于SCS的保存液在供肺保存方面已取得较满意的效果。相比细胞内液型,细胞外液型保存液中低钾浓度避免了肺动脉收缩,延长冷缺血保存时间,有更佳的动脉血氧分压(arterial partial pressure of oxygen,PaO2)/吸入氧浓度(fraction of inspired oxygen,FiO2)值、更短的机械通气时间及术后ICU入住时间,故目前临床首选细胞外液型供肺保存液,其中最常用的为Perfadex液[130]。
肺的充分灌注可最大限度地保护供肺。肺动脉顺行灌注加肺静脉逆行灌注方便可行,低温灌注下(4~8 ℃),参数设置使肺动脉的灌注压力维持在10~15 mmHg,灌注流量60 mL/kg。肺静脉逆行灌注时,每根肺静脉灌注流量为250 mL,6 h后予以再次灌注。灌注时予以呼吸机供肺通气,FiO2维持在50%,呼气末正压通气(positive end expiratory pressure,PEEP)为5 cmH2O(1 cmH2O=0.098 kPa),压力<20 cmH2O,潮气量10 mL/kg[126]。
供肺离体机械灌注技术可修复、改善供肺质量、增加边缘供肺利用率,已显示出其广阔的应用前景。目前主要为离体常温、不含红细胞的肺灌注保存修复技术,其中最有代表性的技术为EVLP。研究表明EVLP可以使高风险的供肺取得与理想供肺相似的移植效果[131]。此外,Organ Care System Lung(OCS Lung)作为首个便携式体外肺灌注和通气设备,临床研究证明可安全、有效地应用,并已在一些国家和地区上市[11,132]。肺脏保存修复推荐意见见表7。
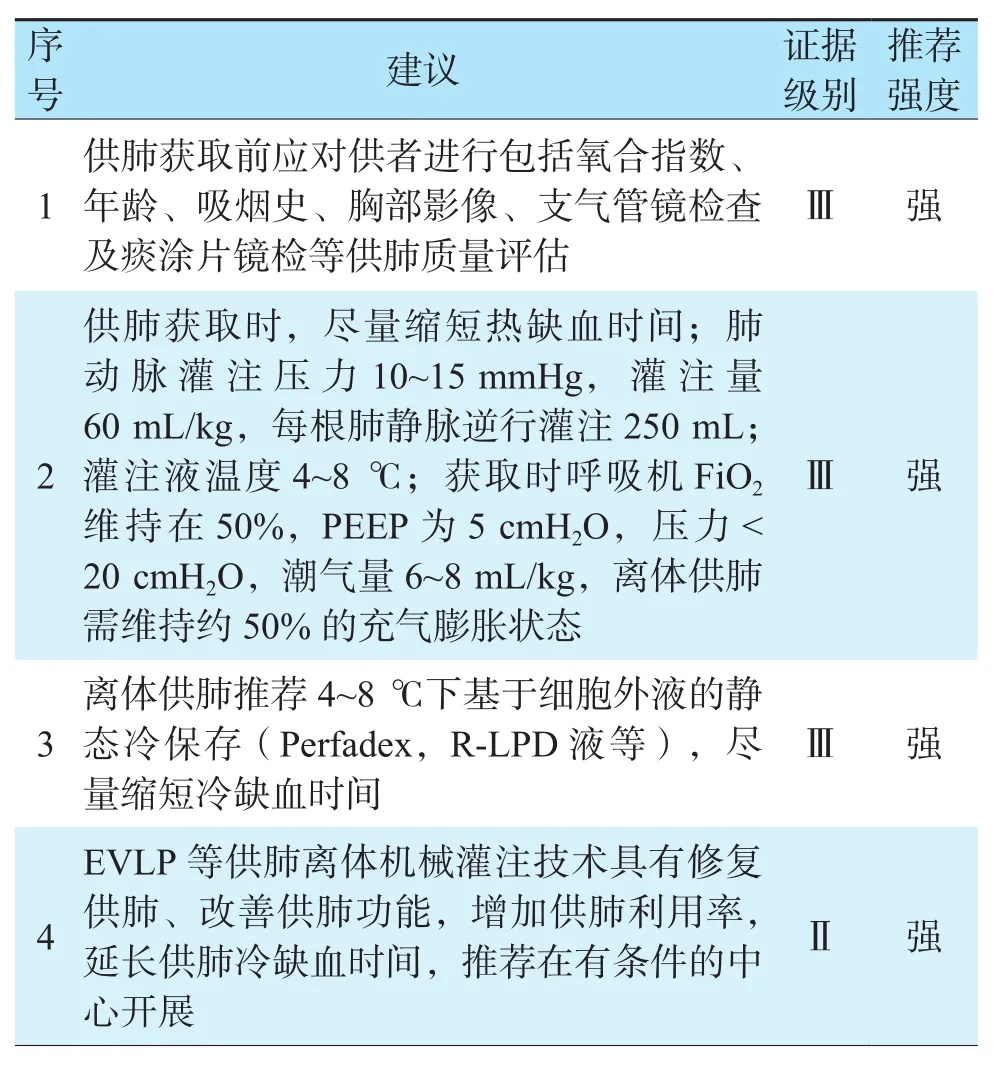
表7 肺脏保存修复推荐意见Table 7 Recommendations for lung preservation and repair
3 移植肢体的保存修复
肢体再植是将自身肢体离断后通过直接或者间接的方法再植入原位。断肢须在6 h内进行血运重建,以防止永久性组织损伤,尤其含有大量肌肉高位离断伤的断肢。目前常用的保存方法为SCS,但效果有限。同种异体肢体移植指同种属不同基因型个体之间的肢体移植。肢体组织结构来源于不同的胚层,具有不同的解剖结构。不同的组织形态和不同功能的血管化复合组织移植是带血管复合组织同种异体移植的一种。由于非维持生命所必需和较强的皮肤免疫原性等因素,异体肢体移植的临床应用远不及单一结构的内脏器官(如肾脏、肝脏等)。但肢体组织的获取、保存与修复技术与器官移植相应技术类似[133]。自Dubernard等1998年在法国里昂第一次成功完成异体上肢移植以来,中国、美国、意大利、德国和马来西亚等10余个国家开展相关移植手术超76例,有不少于113侧的上肢进行异体移植,肢体移植成为了一个新的有前景的移植医学领域[134]。文献报道肢体移植后所有患者获得保护性疼痛反射,90.0%的患者获得触觉,82.3%的患者获得两点辨别觉,75.0%的患者感觉生活质量得到改善[135]。20年随访发现上臂移植患者具有良好的手部功能、精神状态和社会交往能力[136]。不同于内脏器官移植,同种异体肢体移植仍然被认为处于临床前阶段。随着肢体保存、转运、灌注与免疫抑制的基础研究进展,同种异体肢体移植将显示出其广阔的应用前景[137]。
移植肢体的获取技术直接关系到肢体移植手术的成功率及预后。肢体获取时应轻柔操作,避免机械损伤和减少热缺血时间。供者截肢平面应尽量保留足够长的血管蒂和尽量少的皮肤组织,以保护血管吻合口和减少免疫排斥反应。供肢的灌注常在离断前进行,以前臂供肢为例,在肘关节以上5 cm平面做环形皮肤切口,将肱动脉游离后插管,应用低温UW液(4 ℃)进行灌注,随后行前臂离断,灌注至回流液清亮后拔管,采用低温灌注保存供肢的方法可以有效简化手术操作,保证灌注质量,同时也保证了无菌原则[138]。
SCS是最常用的肢体保存技术,能够显著降低细胞代谢[139]。采用的肢体在移植前必须经过复温和再灌注,避免引起IRI和活性氧自由基损伤[140]。根据国际手部移植登记处的数据显示,手同种异体移植的冷缺血时间在30 min~13.5 h(平均5.5 h),这可能是导致移植后功能和长期存活差异的主要原因[141]。
机械灌注技术保存移植肢体仍处在临床前阶段。研究报道含氧脱细胞灌流液、血红蛋白灌注液、无细胞平衡液等肢体灌注液均能够明显延长肢体保存时间。Haug等[142]发现,与SCS相比,应用含氧脱细胞灌流液的HMP可使肢体体外保存时间延长4~6倍;Said等[143]报道,血红蛋白灌注氧载体能够保持肌肉收缩性10.6 h;Krezdorn等[144]报道,使用低钾右旋糖酐灌注液能够使肢体保存24 h。肢体获取与保存修复推荐意见见表8。
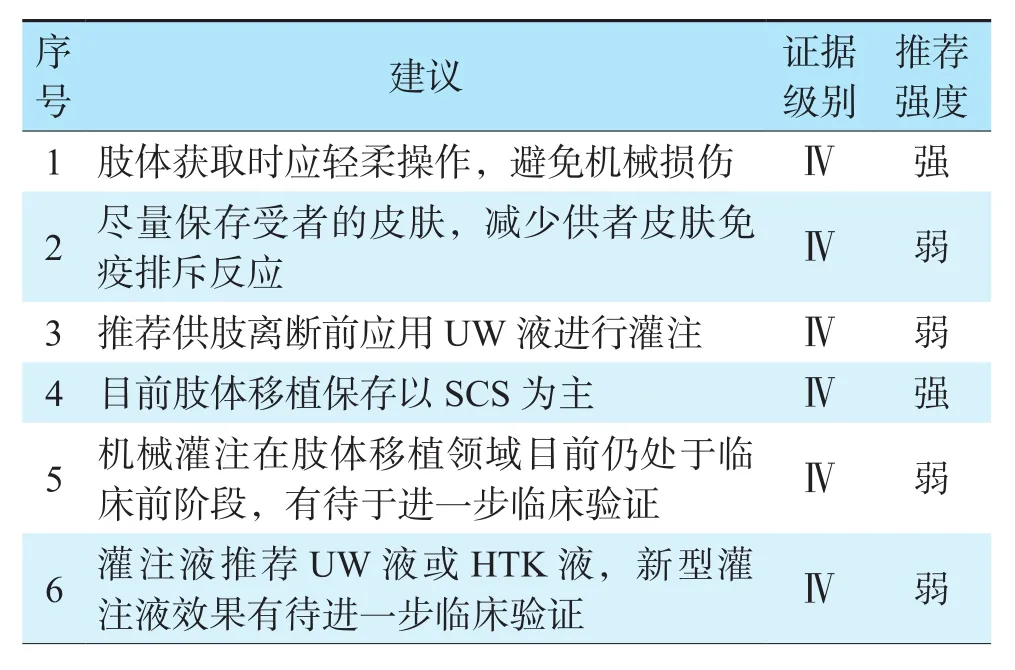
表8 肢体获取与保存修复推荐意见Table 8 Recommendations for limb acquisition,preservation and repair
编写组组长:
郑树森 院士 树兰(杭州)医院
编写组副组长:
叶啟发 教授 武汉大学中南医院
唐佩福 教授 中国人民解放军总医院第四医学中心
徐 骁 教授 浙江大学医学院附属杭州市第一人民医院
李建辉 教授 树兰(杭州)医院
编审专家(按汉语拼音字母排序):
蔡金贞 青岛大学附属医院
陈静瑜 无锡市人民医院
陈 峻 浙江大学医学院附属杭州市第一人民医院
陈 正 广州医科大学附属第二医院
柴 伟 中国人民解放军总医院第四医学中心
邓振宇 深圳市松岗人民医院
董念国 华中科技大学同济医学院附属协和医院
董建辉 中国人民解放军联勤保障部队第九二三医院
范晓礼 武汉大学中南医院
丰贵文 郑州大学第一附属医院
傅红星 树兰(杭州)医院
高 杰 北京大学人民医院
高良辉 海南医学院第一附属医院
郭 华 树兰(杭州)医院
耿 磊 浙江大学医学院附属第一医院
韩威力 浙江大学医学院附属第一医院
胡三元 山东第一医科大学第一附属医院
霍 枫 中国人民解放军南部战区总医院
姜 楠 深圳市第三人民医院
蒋国平 树兰(杭州)医院
李建辉 树兰(杭州)医院
李光兵 山东省立医院
李 立 昆明市第一人民医院
李启勇 树兰(杭州)医院
李绍光 中国人民解放军总医院第四医学中心
林国领 树兰(杭州)医院
刘连新 中国科学技术大学附属第一医院
刘 军 山东省立医院
刘 隽 贵州省人民医院
刘治坤 浙江大学医学院附属杭州市第一人民医院
陆才德 宁波市李惠利医院
吕国悦 吉林大学白求恩第一医院
门同义 山东第一医科大学第一附属医院
Mitesh Badiwala Toronto General Hospital(加拿大)
彭志海 厦门大学附属翔安医院
泮 辉 浙江大学医学院附属第一医院
冉江华 昆明市第一人民医院
冉 勋 贵州医科大学附属医院
任建安 中国人民解放军东部战区总医院
Roberto Vanin Pinto Ribeiro Toronto General Hospital(加拿大)
沈 岩 浙江大学医学院第一附属医院
石炳毅 中国人民解放军总医院第八医学中心
时 军 南昌大学附属第一医院
寿张飞 树兰(杭州)医院
司 伟 山东省立医院
宋朋红 浙江大学医学院附属第一医院
孙煦勇 广西医科大学第二附属医院
孙玉岭 郑州大学第一附属医院
谭晓宇 中国人民解放军南部战区总医院
唐佩福 中国人民解放军总医院第四医学中心
田普训 西安交通大学医学院第一附属医院
屠振华 浙江大学医学院附属第一医院
王彦峰 武汉大学中南医院
汪 恺 浙江大学医学院附属杭州市第一人民医院
温 浩 新疆医科大学第一附属医院
卫 强 浙江大学医学院附属杭州市第一人民医院
魏绪勇 浙江大学医学院附属杭州市第一人民医院
吴 健 浙江大学医学院附属第一医院
吴向未 石河子大学医学院附属第一医院
吴忠均 重庆医科大学附属第一医院
武小桐 山西省第二人民医院
彭心宇 石河子大学医学院附属第一医院
夏 强 上海交通大学医学院附属仁济医院
谢海洋 浙江大学医学院附属第一医院
谢琴芬 树兰(杭州)医院
辛立明 上海大学
许美芳 树兰(杭州)医院
徐 骁 浙江大学医学院附属杭州市第一人民医院
薛武军 西安交通大学第一附属医院
严律南 四川大学华西医院
杨广顺 海军军医大学东方肝胆外科医院
杨洪吉 四川省人民医院
杨家印 四川大学华西医院
杨 扬 中山大学附属第三医院
杨 岳 常州市第一人民医院
杨 喆 树兰(杭州)医院
姚建民 树兰(杭州)医院
叶啟发 武汉大学中南医院
叶少军 武汉大学中南医院
殷 浩 海军军医大学附属长征医院
于光圣 山东省立医院
俞 军 浙江大学医学院附属第一医院
张 峰 江苏省人民医院
张 浩 中国人民解放军总医院第四医学中心
张建政 中国人民解放军总医院第四医学中心
张 珉 浙江大学医学院附属第一医院
张水军 郑州大学第一附属医院
张 武 树兰(杭州)医院
赵海格 浙江大学医学院附属第一医院
赵闻雨 海军军医大学附属长海医院
郑树森 树兰(杭州)医院
钟 林 上海交通大学医学院附属第一医院
钟自彪 武汉大学中南医院
周江桥 武汉大学人民医院
周 琳 浙江大学医学院附属第一医院
周 俭 复旦大学附属中山医院
朱继业 北京大学人民医院
朱 理 树兰(杭州)医院
朱有华 海军军医大学附属长海医院
朱志军 首都医科大学附属北京友谊医院
庄 莉 树兰(杭州)医院
执笔作者:
李建辉 徐 骁 谢海洋 王彦峰 陈静瑜 董念国Mitesh Badiwala(加拿大)
Roberto Vanin Pinto Ribeiro(加拿大)
殷 浩 辛立明 张 浩 张建政 霍 枫 杨家印
杨洪吉 泮 辉 李绍光 贾俊君 俞 浩 梁 涵
杨思佳 乔银标 罗 佳 李浩宇 王 浩 刘鐘阳
张里程 胡潇逸 吴 昊 胡逸青

