移植胰腺病理学诊断标准及其进展
郭晖 明长生 陈实
胰腺移植和胰肾联合移植是治疗1型糖尿病和部分2型糖尿病及其并发症导致的肾衰竭的最佳方法。胰腺移植的类型主要包括同期胰肾联合移植(simultaneous pancreas-kidney transplantation,SPK)、肾移植后胰腺移植(pancreas transplantation after kidney transplantation,PAK)和单纯胰腺移植(pancreas transplantation alone,PTA)。胰腺移植中对外分泌胰液的处理有不同的术式即胰液膀胱引流和胰液肠道引流,这些不同的移植类型及其术式,不仅形成了多种不同的移植胰腺活组织检查(活检)方法,而且也增加了移植胰腺排斥反应诊断的不确定性,均需要予以更多的关注和研究[1]。
1 移植胰腺活检的方法及其相关的研究进展
首先需要明确的是,移植胰腺发生排斥反应时其血清淀粉酶(amylase)、脂肪酶(lipase)、血糖(glucose)和血清C肽(C-peptide)等血生化指标的变化均缺乏特异性,而且多数急性排斥反应呈隐匿发生,仅有5%~20%的移植受者出现较为明显的临床症状与体征。即便SPK中可以借助移植肾血清肌酐升高等临床指标的异常来判断是否发生了排斥反应,但移植肾的临床指标同样缺乏特异性;PAK中移植胰腺和移植肾往往来自于不同的供者,无法借助移植肾反映移植胰腺的排斥反应情况;而PTA中单纯的移植胰腺出现排斥反应时也常常缺乏临床表现,因此在所有的胰腺移植类型中,对移植胰腺的活检仍然是明确诊断其排斥反应并与其他并发症进行鉴别的最佳方法[2-3]。
1.1 移植胰腺活检的方法
针对上述不同的胰腺移植类型以及其不同的术式,进行了多种不同的移植胰腺活检方法的探索研究,目前移植胰腺活检的方法包括经皮穿刺活检、膀胱镜活检、腹腔镜活检、经十二指肠的内窥镜活检和开放式活检。对于这些不同的活检方法,国际上主要的胰腺移植中心在临床胰腺移植的同时,相应进行了较大例数的活检方法比较研究和组织病理学研究。其中总体上首选经皮穿刺活检;如果失败或标本无法满足诊断需要,再考虑对接受胰液膀胱引流者施行膀胱镜活检;对接受肠道引流者实施内窥镜活检。近年来,部分胰腺移植中心在详细的比较研究的基础上,推荐由移植外科医师采用腹腔镜活检,其可以不必依赖影像科或消化科医师的辅助,不仅适用于不同的胰液引流术式者,而且可以同时进行移植胰腺和移植肾活检;而在上述这些活检方法均不适宜的情况下,不得已再考虑采用开放式活检。以下就移植胰腺的活检方法予以简要介绍。
1.1.1 经皮穿刺活检 移植胰腺经皮穿刺活检(percutaneous biopsy)包括超声引导下移植胰腺活检(ultrasoundguided percutaneous pancreatic allograft biopsy) 或CT引导下移植胰腺活检(CT-guided percutaneous pancreatic allograft biopsy)[4],采用18 G或20 G的穿刺活检针,对移植胰腺进行粗针穿刺活检(core needle biopsy)[5-14]。穿刺标本的合格标准为活检组织内含有至少2个外分泌腺泡小叶的结构且其中含有小血管和胰腺导管结构。穿刺活检方法获取得到适合于病理诊断的标本获取率基本可以达到90%,其活检并发症的发生率约为2.8%,主要包括出血、胰漏以及误穿刺至肝脏、肾脏以及小肠等,但均未出现严重的临床表现,证明在影像学引导下经皮穿刺活检是安全有效的诊断方法。由于其直接活检获取到移植胰腺组织,适于移植胰腺急性排斥反应、慢性排斥反应、移植胰腺炎和复发性疾病等并发症的病理学诊断。
1.1.2 膀胱镜活检 膀胱镜活检(transcystoscopic biopsy)亦称膀胱镜经十二指肠移植胰腺活检(cystoscopic transduodenal pancreatic allograft biopsy)[15],对于接受胰液膀胱内引流术的胰腺移植受者,由于全胰十二指肠节段或十二指肠周围组织片与受者膀胱吻合,可以通过膀胱镜进入移植的十二指肠节段或十二指肠组织片内取得移植十二指肠组织,进而也可以直接取胰管Vater壶腹周围组织或移植胰腺组织进行组织病理学观察。这也是膀胱引流术式中可以进行移植十二指肠以及移植胰腺活检以诊断排斥反应的重要优势之一。膀胱镜经十二指肠活检基本可以取得包括黏膜、黏膜下层以及黏膜肌层在内的移植肠壁组织,其中黏膜肌层内的血管对于明确诊断急性排斥反应非常有利。目前已知,十二指肠的排斥反应与胰腺的排斥反应具有一定的相关性,其可以在一定程度上反映移植胰腺排斥反应的发生、进展及其治疗后的转归。膀胱镜活检的并发症少,发生率<10%,常见的并发症主要为镜下或肉眼血尿,其次偶尔可见胰腺炎,临床常仅仅表现为血清淀粉酶的一过性升高。对于获取到移植十二指肠组织者,仅能在一定程度上间接反映移植胰腺的急性排斥反应情况,对于移植胰腺的慢性排斥反应等多种并发症则缺乏诊断意义。
1.1.3 腹腔镜活检 腹腔镜活检(laparoscopic biopsy)适用于经皮穿刺活检或膀胱镜活检难以实施或难以取得满意的移植胰腺组织者。腹腔镜活检具有安全、腹腔镜下直视观察移植胰腺及其周围组织观察清晰、活检取材准确和可以良好止血的优势;另一个优势是可以直接由移植外科医师实施,而不必依赖影像科或者消化科的辅助,便于在有活检需要时随时地、单独地进行操作;可以同时进行移植胰腺和移植肾的活检,同时精确诊断两个移植器官的排斥反应。该方法可以在腹腔镜直视下进行经皮移植肾穿刺活检,随后进行移植胰腺楔形活检,以及在移植胰腺楔形活检较为浅表的情况下再进行移植胰腺的穿刺活检,以取材到深部的胰腺组织用于诊断。腹腔镜活检总体上具有活检安全、准确和有效的多种优势,因此近年来逐渐受到部分胰腺移植中心的推崇[5]。其可以直接活检获取到移植胰腺组织和移植肾,适于移植胰腺和移植肾的急性排斥反应、慢性排斥反应、感染和复发性疾病等并发症的病理学诊断。
1.1.4 内窥镜活检 内窥镜活检即经十二指肠的内窥镜活检(transduodenal enteroscopic biopsy)。其作用类似膀胱镜活检中获取到移植十二指肠节段的肠黏膜组织,仅能在一定程度上间接反映移植胰腺的急性排斥反应情况,对于移植胰腺的慢性排斥反应等多种并发症则缺乏诊断意义。
1.1.5 开放式活检 移植胰腺的开放式活检(open biopsy)包括剖腹小切口后直接切取楔形胰腺组织或剖腹后采用活检穿刺针穿刺胰腺组织两种方式。既往由于穿刺活检设备相对落后,尤其是缺乏直径小而针体长的穿刺活检针,同时缺乏CT和MRI等现代影像学设备和技术,盲目地经皮粗针穿刺活检非常容易造成移植胰腺以及腹腔脏器的损伤及出血等严重并发症,一度使得开放式活检成为当时移植胰腺的主要活检方法,一直为部分移植中心长期采用。但其缺点是手术创伤大、并发症多和难以进行连续多次的活检,随着活检技术以及医学影像学技术的飞速发展,开放式活检目前已经极少应用,只在其它方法难以奏效的情况下才考虑选择使用。目前,经皮穿刺活检以及腹腔镜活检逐渐成为移植胰腺活检的首选方法。
1.2 移植胰腺活检的相关问题
随着胰腺移植的深入开展和移植胰腺活检经验的不断积累,急性排斥反应对移植胰腺和受者存活的影响日益明确,因此胰腺移植术后急性排斥反应的及时和准确诊断得到更多的关注。关于移植胰腺不同活检方法的优劣及其比较研究,尤其是胰肾联合移植中移植肾的活检及其急性排斥反应是否能体现移植胰腺的急性排斥反应,成为移植胰腺活检方法研究中的焦点及其主要的进展内容。
1.2.1 急性排斥反应对移植胰腺存活的影响 在胰腺移植中,无论是SPK、PAK或PTA,急性排斥反应均是导致移植术后早期移植胰腺失功的主要因素之一[6-8]。随着目前免疫诱导治疗和以他克莫司为主的免疫抑制方案在胰腺移植中广泛应用,在基于胰腺活检病理学明确诊断的基础上,已初步明确移植胰腺急性排斥反应的发生率较高,总体约为29%[9]。在不同的胰腺移植类型中,以PTA中移植胰腺的急性排斥反应发生率最高。胰腺移植术后早期(3个月内)发生的急性排斥反应是导致移植胰腺完全失功的主要因素,而术后3个月至12个月内或24个月内发生的急性排斥反应是导致移植胰腺部分失功的重要因素。在因慢性排斥反应所致的移植胰腺失功的受者中,91%既往均发生过显著的急性排斥反应,可见急性排斥反应也是直接导致慢性排斥反应及移植胰腺慢性失功的主要因素[10]。
1.2.2 关于胰腺活检中标本的获取率 对于移植胰腺最主要的活检方式即经皮穿刺活检,来自美国明尼苏达大学组、马里兰大学组和威斯康星大学组的较大例数的经皮穿刺移植胰腺活检的标本获取率分别可以达到73%、88%和94%[11-13]。目前来自阿根廷布宜诺斯艾利斯肾脏病研究所与美国威斯康星大学联合进行的、最大例数的腹腔镜活检研究则显示其移植胰腺活检标本获取率可以达到91.6%[5],单独移植胰腺的活检并发症的发生率仅为1.25%。而且腹腔镜活检可以同时获取移植胰腺和移植肾组织标本,同时分别对两者的急性排斥反应情况予以明确诊断以及观察两个移植器官排斥反应的协同发生情况。
1.2.3 关于胰肾联合移植的活检及其急性排斥反应的协同性问题 SPK是目前治疗糖尿病及其并发症的最佳方法,由于胰腺和肾脏绝大多数情况下均是来自于同一供者,两者在抗原性以及排斥反应方面有很大的相似性,既往的临床观察及其活检病理学研究认为,绝大多数排斥反应常同时累及移植胰腺和移植肾,单独发生于移植胰腺或者移植肾的排斥反应较为少见,因此,在胰腺活检较为困难的情况下,移植肾的活检及其急性排斥反应成为预示移植胰腺排斥反应并指导治疗的替代指标。但对于少数SPK采用尸体供者胰腺和亲属活体供肾的移植(simultaneous cadaveric pancreas and living-donor kidney transplantation,SPLK),即移植的胰腺和肾脏分别来自于不同的供者,或者PAK中移植胰腺和移植肾来自于不同的供者,其明确诊断则必须进行移植胰腺活检。SPK中移植胰腺和移植肾协同发生急性排斥反应的研究包括两个方面的内容,即两者是否协同发生急性排斥反应和两者是否具有相同的急性排斥反应程度。只有明确了这两个问题,才能明确是否可以在SPK中用移植肾活检代替移植胰腺活检,以及是否可以在抗排斥反应治疗中仅依据移植肾的急性排斥反应程度来治疗移植胰腺的急性排斥反应。 早期的研究也报道,以十二指肠活检作为移植胰腺急性排斥反应的替代指标时,仅有36%的病理标本同时出现了胰腺和十二指肠的排斥反应[14-16]。近年Uva等[11]在对其70例SPK的101例次同时进行的移植胰腺和移植肾的共同活检研究中发现,移植胰腺和移植肾协同发生急性排斥反应的发生率仅为40.0%,而单独的移植肾急性排斥反应发生率为33.5%,单独的移植胰腺急性排斥反应发生率为26.5%,协同发生急性排斥反应的病例中,56.5%的病例其急性排斥反应的程度和类型是不同的。可见移植胰腺和移植肾的急性排斥反应及其程度并非协同发生,更需要针对移植胰腺展开直接的活检病理学诊断。
2 移植胰腺活检排斥反应诊断标准及其进展
对于移植胰腺排斥反应的病理学特征及其活检病理学诊断,美国明尼苏达大学的Nakhleh和Sutherland进行了开创性的研究,他们在1992年率先提出了移植胰腺活检的病理学诊断标准[17],所采用的方法主要为开放式活检。随后,随着移植胰腺经皮穿刺活检方法日益成熟,其安全性以及有效性日益明确,经皮穿刺活检方法已经为多数胰腺移植中心所采用,其可以获得高达89%的活检标本适于进行明确的组织病理学诊断。1997年美国马里兰大学的Drachenberg等[18]在移植胰腺经皮穿刺活检病理学研究的基础上,提出了移植胰腺急性排斥反应的病理组织学诊断的分级体系,其依据急性排斥反应及其病变程度分别分为0~Ⅴ 6个级别。这一活检诊断体系逐渐为大多数胰腺移植中心所接受和采用,包括后续的腹腔镜活检等获取的移植胰腺组织均参考和依据这一诊断标准予以诊断。2005年在第8届Banff移植病理学会议上,借鉴移植肾和移植肝的Banff移植病理学诊断标准,展开了对移植胰腺活检病理学诊断和分级标准的深入研讨。在会后2年内持续的、详细而深入的研讨交流的基础上,于2007年在第9届Banff移植病理学会议上,在由包括移植病理医师、移植外科医师和肾脏内科医师组成的多学科研讨的基础上,正式提出了Banff移植胰腺活检病理学诊断及分级标准(以下简称“Banff标准”)并于2008年发表公布[19]。2008年Banff标准中明确制订了合格的活检胰腺组织标本的标准:就经皮穿刺胰腺活检方法而言,合格的活检胰腺组织必须包括3个胰腺小叶结构以及包含微血管和末梢胰腺导管的小叶间隔部位,如果未能穿刺获取到小动脉分支需要予以注明。同时,其不仅对移植胰腺急性细胞性排斥反应和抗体介导的排斥反应(antibody-mediated rejection,AMR)予以明确诊断及分级,也对慢性排斥反应和排斥反应以外的其它并发症予以界定。随着移植胰腺活检的更广泛开展,尤其是对于移植胰腺AMR和慢性排斥反应的认识逐渐深入,在2011年第10届Banff移植病理学会议更新了Banff标准,主要是进一步完善了移植胰腺AMR的组织病理学诊断、C4d染色和抗体检测等综合诊断的内容,进而提出了2011年Banff标准并为国际上多个胰腺移植中心采用和沿用至今[20]。
2011年Banff标准中将移植胰腺的排斥反应明确地划分为急性T细胞介导的排斥反应(T cellmediated rejection,TCMR)、AMR和慢性排斥反应3种类型;其它方面的病理类型包括移植胰腺正常、不能确定的病变或极为轻微的病变、慢性移植胰腺动脉血管病、胰岛炎和包涵多种非免疫因素和免疫抑制剂药物毒性病变等在内的其它病变。2011年Banff标准见表1。
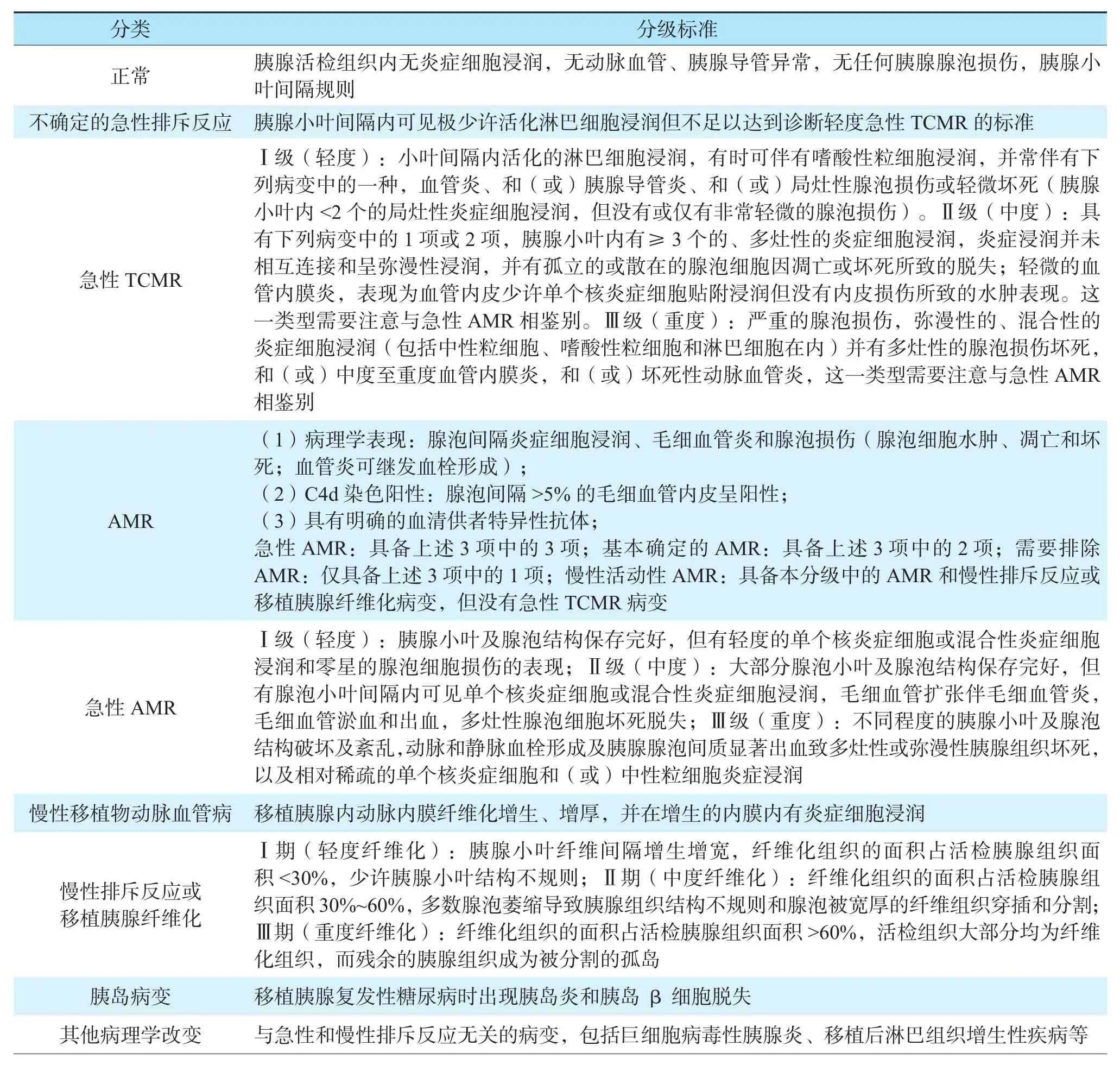
表1 2011年Banff移植胰腺排斥反应分级标准Table 1 2011 Banff schema for grading pancreas allograft rejection
3 移植胰腺主要的并发症及其病理学表现
3.1 移植胰腺血栓栓塞
在胰腺移植术后围手术期内尤其是术后2周内,血栓栓塞是导致移植胰腺失功最主要的原因,术后血栓栓塞的发生率为12%~20%,移植胰腺血栓形成的原因主要包括:(1)胰腺在切取、保存过程中处于缺血状态,以及再灌注损伤激活了凝血系统;(2)供者胰腺在切取、移植手术等操作过程中所致的机械性损伤可以促进胰腺水肿;(3)胰腺血供的压力低,流速缓慢,血液易于停滞;(4)糖尿病患者血小板功能亢进,血小板聚集,凝血因子水平增高;(5)急性排斥反应所致的血管内皮损伤、基膜暴露,促进了纤维素沉积导致血栓形成。血栓栓塞可见于胰腺的脾动脉系统和脾静脉,动脉系统的血栓较静脉发展快,最终导致胰腺广泛的缺血性坏死。
围手术期以后发生的血栓栓塞可能是急性排斥反应的结果,因严重的急性排斥反应形成血管内膜炎,导致内皮损伤、基膜暴露而促进纤维素沉积形成血栓栓塞。对于疑为血栓栓塞导致胰腺失功而切除的移植胰腺,必须进行仔细的病理解剖学检查。在具体检查步骤上应将所有的大血管即脾动脉、脾静脉主干连续多个横断面切开观察,同时对于胰腺也应进行多个断面切开取材,以发现胰腺实质内的细小血管分支内的血栓。对切除的移植胰腺的病理解剖学检查中,肉眼观可见移植胰腺呈灰红色,胰腺实质呈广泛的灰白色即缺血性坏死的改变;沿主干动脉管壁纵行剖开,可见动脉及其分支内血栓样物栓塞(图1)。急性排斥反应所致的内膜损伤以及慢性排斥反应所致的内膜增生甚至管腔闭锁,亦可导致胰腺栓塞、缺血损伤甚至坏死,需要与单纯的血栓栓塞相鉴别。
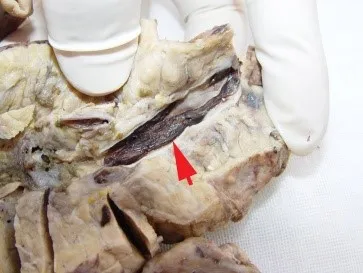
图1 移植胰腺动脉血栓栓塞的病理解剖学表现Figure 1 Pathoanatomical findings of arterial thromboembolism in pancreas allograft
3.2 移植胰腺的排斥反应
排斥反应是导致移植胰腺失功的主要原因,移植胰腺排斥反应也依据免疫损伤机制分为急性TCMR、AMR和这两种机制共同导致的、以慢性移植物动脉血管病为特征的慢性排斥反应3种类型。
3.2.1 急性T细胞介导的排斥反应 移植胰腺急性TCMR免疫攻击的靶部位为胰腺外分泌部的腺泡上皮细胞、胰腺导管上皮细胞以及血管内皮细胞,而胰岛内的β细胞并非急性排斥反应攻击的主要靶细胞,因此急性TCMR主要的特征性组织病理学表现为移植胰腺外分泌部的腺泡组织内淋巴细胞为主的单个核炎症细胞浸润以及胰腺导管炎病变和血管病变两个方面,也借此对移植胰腺活检组织内的急性TCMR予以诊断和程度分级。
3.2.1.1 移植胰腺急性T细胞介导的排斥反应的腺泡及胰腺导管炎病变 移植胰腺实质内炎症细胞浸润是胰腺急性细胞性排斥反应最基本的组织学特征,浸润的炎症细胞绝大多数为单个核炎症细胞(图2A),以区别于急性感染时大量的中性粒细胞浸润。浸润的单个核炎症细胞中主要为淋巴细胞,其次为B细胞和巨噬细胞等,而随着急性排斥反应程度的加重,也伴随出现中性粒细胞和嗜酸性粒细胞的浸润(图2B),嗜酸性粒细胞的出现以及数量增加,常常预示着这一排斥反应程度较为严重而且临床治疗较难以逆转。炎症浸润的部位主要位于胰腺外分泌部的胰腺小叶间隔的纤维组织内、腺泡间和腺泡上皮内,以及各级胰腺导管上皮呈胰腺导管上皮炎(图2C)。随着急性排斥反应程度的加重,出现胰腺腺泡多灶性的甚至弥漫性的溶解性坏死。
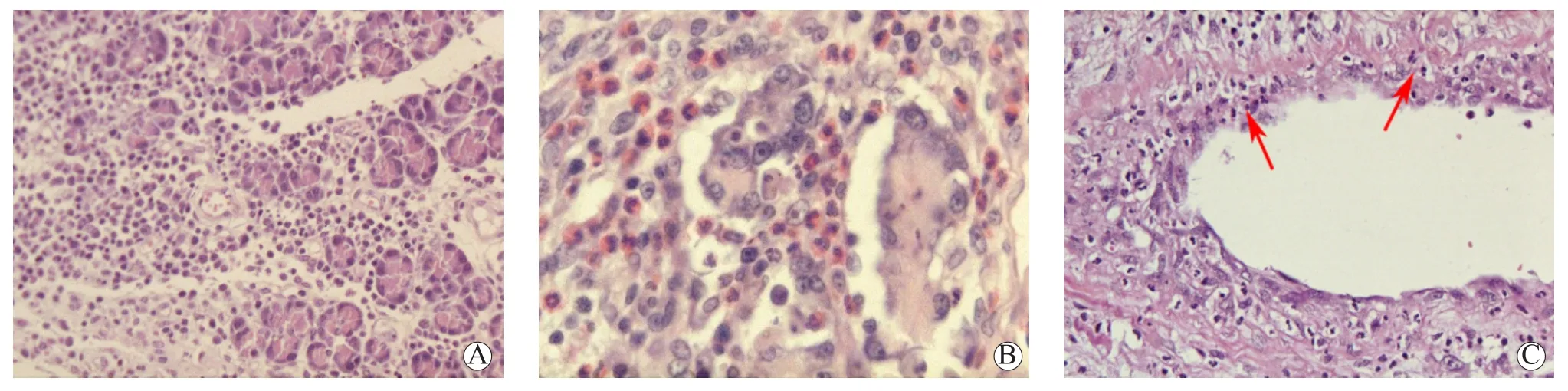
图2 移植胰腺急性TCMR的腺泡及胰腺导管炎病变的病理学表现Figure 2 Pathological findings of acinar and pancreatic duct inflammatory lesions of acute TCMR in pancreas allograft
3.2.1.2 移植胰腺急性T细胞介导的排斥反应的血管病变 血管病变是诊断急性排斥反应最具特异性的病理学特征,可见于严重的急性TCMR或者AMR,血管炎病变的出现提示急性排斥反应程度较重。移植胰腺急性TCMR的血管病变可以表现为动脉血管分支的动脉内皮炎(endothelialitis)以及动脉血管分支全层被累及的动脉炎(arteritis)或血管炎(vasculitis)两种形式。动脉内皮炎常常是轻度急性血管性排斥反应的表现,可见动脉血管分支内皮表面有淋巴细胞贴附,损伤的内皮细胞可出现水肿、与内膜剥离甚至全层内皮细胞明显肿胀呈明显的泡沫细胞致使内膜层明显水肿增厚,形成动脉内膜炎(图3A),水肿增厚的内膜以及呈泡沫样变的内皮细胞层内有不等数量的淋巴细胞浸润;血管炎或动脉炎是严重的急性排斥反应的特异性病理学表现,表现为病变不仅仅局限于动脉内皮或内膜层,而是管壁全层均有病变,表现为管壁全层淋巴细胞浸润,内膜水肿,动脉中层平滑肌呈局部纤维素样坏死(图3B)。
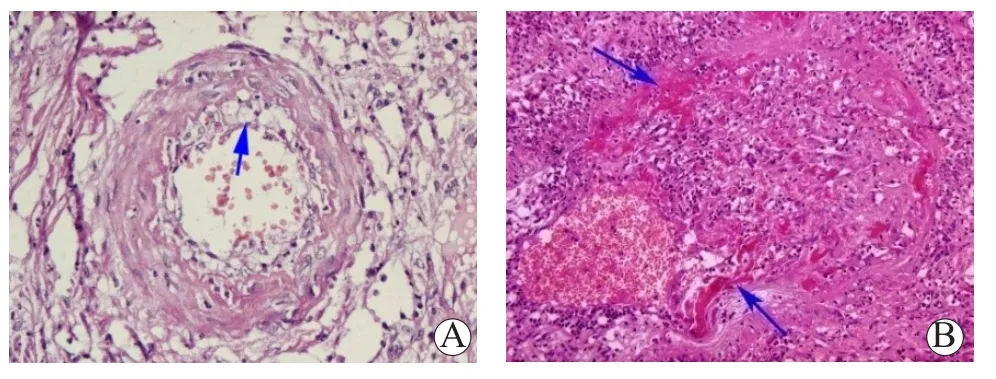
图3 移植胰腺急性TCMR的血管病变的病理学表现Figure 3 Pathological findings of vascular lesions of acute TCMR in pancreas allograft
移植胰腺急性TCMR时,胰腺组织内的神经组织如神经节也可被浸润的淋巴细胞累及,这也是胰腺急性排斥反应的重要特点之一。虽然在急性排斥反应中胰岛炎(insulitis)并非主要的病变,但有部分病例表现为胰岛内淋巴细胞及巨噬细胞浸润呈胰岛炎表现,若此时供、受者双方人类白细胞抗原(human leukocyte antigen,HLA)基因相同(孪生或亲属),那么这种胰岛炎首先提示复发性糖尿病因素所致;若为非亲属间的胰腺移植,则有可能是急性TCMR甚至急性AMR因素所致,这时的胰岛炎是整体急性TCMR或急性AMR损伤的一部分,是相应的急性排斥反应在胰岛局部的表现。
3.2.1.3 移植胰腺急性T细胞介导的排斥反应的分级依据急性TCMR中炎症细胞浸润、是否出现血管炎以及胰腺实质坏死改变,其分为5个级别:(1)0级,正常或无排斥反应,移植胰腺活检组织正常,胰腺小叶间隔内没有或仅有极少许小淋巴细胞和浆细胞浸润,胰腺腺泡、导管、血管和神经节等结构均未见异常。(2)不确定的急性排斥反应,胰腺小叶间隔内稀疏、活化的淋巴细胞和(或)嗜酸性粒细胞浸润,此外无任何提示急性细胞性排斥反应的病理组织学表现。(3)Ⅰ级,轻微急性排斥反应,小叶间隔内活化的淋巴细胞,有时可以伴有嗜酸性粒细胞的炎症浸润,并常伴有下列病变中的一种,血管炎、胰腺导管炎或胰腺间质内的神经节炎;这时可以出现局部腺泡的损伤或轻微坏死。(4)Ⅱ级,中度急性排斥反应,具有下列病变中的1项或2项,(a)胰腺小叶内有3个或3个以上的局灶性炎症细胞浸润(多灶性炎症浸润)并形成孤立或多灶性的腺泡细胞因凋亡或坏死所致的脱失;(b)轻微的血管内膜炎,表现为血管内皮少许单个核炎症细胞贴附浸润但没有内皮的水肿等。(5)Ⅲ级,重度急性排斥反应,具有以下病理表现中的1项或多项,(a)严重的腺泡损伤,多灶性的腺泡损伤,包括中性粒细胞、嗜酸性粒细胞和淋巴细胞在内的混合性的炎症细胞浸润,胰腺间质水肿和出血;(b)中度至重度的血管内膜炎;(c)坏死性动脉血管炎。
3.2.2 抗体介导的排斥反应 移植胰腺AMR广义上包括超急性排斥反应、加速性排斥反应、术后任何时间均可发生的急性AMR和慢性AMR。但目前随着术前组织配型技术的进步,超急性排斥反应和加速性排斥反应极少发生,主要是急性AMR和慢性AMR。移植胰腺AMR的明确诊断是综合性诊断,其包括胰腺活检组织内AMR相应的组织病理学表现、C4d免疫荧光或者免疫组织化学(免疫组化)染色呈阳性和抗供者特异性抗体(donor specific antibody,DSA)阳性[21-22]。
3.2.2.1 急性抗体介导的排斥反应 移植胰腺急性AMR的病理学特征包括3个方面:(1)胰腺腺泡和腺泡间隔内的炎症细胞浸润,浸润的炎症细胞包括中性粒细胞、淋巴细胞和巨噬细胞,这一点与急性TCMR的病理学表现非常类似。其中,由于移植免疫机制中抗体和免疫细胞的协同参与,部分病例中出现混合性排斥反应(mixed rejection),即在活检组织内同时具有急性AMR和急性TCMR的病理学特征。(2)血管病变,包括动脉血管和静脉血管分支的血管内膜炎。严重的急性AMR可累及动脉、静脉血管分支形成严重的动脉内膜炎及动脉内膜显著水肿,导致胰腺实质显著的凝固性坏死。(3)近年来确定对于急性AMR更有特异性的病理学表现——胰腺腺泡间隔毛细血管炎(interacinar capillaritis),即类似于移植肾的肾小管周毛细血管炎,可见毛细血管腔内不同数量的中性粒细胞和单个核炎症细胞浸润。这一微血管损伤可以进一步导致胰腺间质水肿和出血。在上述损伤的基础上,腺泡细胞和胰腺实质出现腺泡细胞水肿、空泡变、凋亡和坏死。而移植胰腺功能减退并不作为诊断急性AMR的必要条件,可见活检病理学诊断具有更重要的意义。
3.2.2.2 急性抗体介导的排斥反应的分级 2011年Banff标准中将急性AMR分级为3级:(1)Ⅰ级(轻微急性AMR),镜下可见移植胰腺的整体结构保持正常,但移植胰腺小叶间隔和腺泡内轻微的、少数的单个核细胞浸润或单个核炎症细胞与少许中性粒细胞混合性的炎症浸润,零星的腺泡细胞损伤 ;(2)Ⅱ级(中度急性AMR),镜下可见移植胰腺的整体结构仍基本保存,胰腺小叶间隔内有明显的单个核炎症细胞或单个核炎症细胞与中性粒细胞混合性的炎症浸润,腺泡间隔内毛细血管扩张和毛细血管炎、毛细血管淤血和局部漏出性出血,多个局灶性的腺泡细胞脱失或坏死;(3)Ⅲ级(重度急性AMR),镜下可见移植胰腺的结构紊乱,胰腺小叶间隔内出血、多灶性或连片的胰腺实质坏死,小静脉和小动脉内血栓或血管纤维素样坏死,单个核炎症细胞或单个核炎症细胞与中性粒细胞混合性的炎症浸润,多个局灶性或片状的腺泡坏死[20]。
3.2.2.3 移植胰腺急性抗体介导的排斥反应中C4d阳性的判定 移植胰腺中C4d的免疫组化染色是诊断AMR的关键依据,所有疑似AMR的病例都应进行C4d免疫组化染色[20-22]。在C4d染色阳性的判定中,只有外分泌部胰腺小叶实质中腺泡间隔内的毛细血管内皮线性或细颗粒样沉积才认为是C4d阳性,动脉或静脉、间质结缔组织或胰腺外组织的C4d染色均为非特异性,只能作为判定染色技术的对照。2008年Banff标准中确定C4d阳性染色的阈值为≥5%[23-24]。因此,C4d染色的推荐判定方案为:阴性,外分泌部的小叶内毛细血管无C4d阳性染色或<5%;阳性,移植胰腺外分泌部的腺泡间隔毛细血管内皮阳性≥5%,其中局部阳性为5%~50%的毛细血管染色,弥漫性阳性为>50%的毛细血管染色。
3.2.2.4 移植胰腺急性抗体介导的排斥反应的病理学报告模式 鉴于急性AMR的诊断包括了病理学表现、C4d免疫组化染色阳性和移植受者外周血DSA阳性在内的3项基本指标的综合性诊断[25-26],因此推荐的诊断报告模式为:(1)急性AMR,即具备了3个方面的诊断依据;(2)比较确定的急性AMR,即满足了上述3个诊断标准中的2项;(3)须排除急性AMR,即仅具有上述3项中的1项。
3.2.3 慢性排斥反应 移植胰腺的慢性排斥反应往往是慢性TCMR和慢性AMR共同损伤的终末病变。早期慢性排斥反应常与反复发生的急性排斥反应叠加在一起。慢性排斥反应的定义为出现慢性移植物动脉血管病(chronic transplant arteriopathy,CTA)及纤维增生使胰腺实质萎缩和纤维化。移植胰腺CTA的特征性病变为胰腺动脉及其各级分支的内膜因大量的成纤维母细胞、肌纤维母细胞和平滑肌细胞增生而致纤维性增厚导致管腔狭窄甚至完全闭塞(图4)。在此基础上,因持续的缺血逐渐导致胰腺实质出现不同程度的纤维化。病理学上可以将慢性排斥反应分为慢性活动性TCMR和慢性活动性AMR,前者表现为CTA和未完全纤维化的胰腺实质组织内不同程度的淋巴细胞浸润;后者表现为出现CTA和胰腺纤维化的同时C4d免疫组化染色和DSA呈阳性。因活检取材的局限性,CTA在移植胰腺活检中往往难以见到,更多见于手术切除的胰腺。早期的慢性排斥反应时,胰岛通常不受影响而基本保持正常,而严重慢性排斥反应则导致胰腺广泛纤维化,胰岛由于严重的缺血而萎缩、消失且难以辨认。
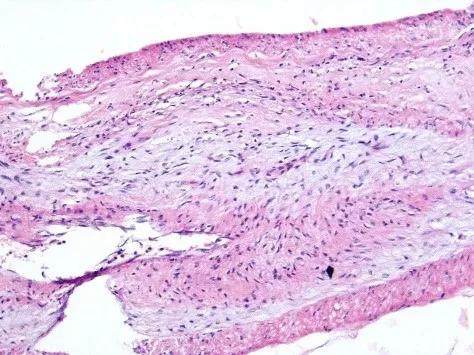
图4 移植胰腺CTA的病理学表现Figure 4 Pathological findings of CTA in pancreas allograft
移植胰腺慢性排斥反应在病理学上依据活检胰腺组织内纤维化的面积范围分为0~Ⅲ4期:(1)0期,正常,移植胰腺外分泌部的小叶及腺泡结构正常,小叶间隔纤维组织无增生及扩展,大血管及胰腺导管外周仅少许正常的纤维组织环绕;(2)Ⅰ期,轻度慢性排斥反应,移植胰腺小叶间隔的纤维组织增生和向外扩张但仅占据活检胰腺组织面积<30%,大多数胰腺腺泡小叶结构保存,但有少许局灶性腺泡不规则的萎缩消失;(3)Ⅱ期,中度慢性排斥反应移植胰腺小叶间隔的纤维组织增生和向外扩张占据了活检胰腺组织面积的30%~60%,增生的纤维组织穿插分割胰腺腺泡组织形成许多新的、不规则的分隔,所有的胰腺腺泡小叶被分割为片块状,其中部分片块状的胰腺腺泡出现萎缩消失;(4)Ⅲ期,重度慢性排斥反应,增生的纤维组织占据活检胰腺组织面积>60%,移植胰腺的大多数小叶明显萎缩消失,仅残留少许腺泡组织。
3.3 移植胰腺的胰腺炎
3.3.1 移植胰腺急性胰腺炎 移植胰腺急性胰腺炎的发生率为1%~16%,其发生原因包括胰腺的缺血-再灌注损伤、外科手术创伤、术后大量糖皮质激素的应用以及感染等,也可以因为严重的腹腔感染而波及胰腺。临床表现为发热、移植物局部疼痛、血淀粉酶及血糖明显增高。
肉眼上,早期可见胰腺轻度水肿、充血,稍后出现出血、坏死,其暗红色出血灶常与灰黄色坏死灶交杂在一起,脂肪坏死最为突出,可以在胰腺周围、肠系膜等部位出现细小点状或灶状混浊的灰黄色脂肪坏死灶,如果有钙盐沉着则形成质地松脆的白垩质样小灶,与周围正常光泽油亮黄色的脂肪组织形成鲜明对比。镜下,早期仅有间质充血水肿以及少数中性粒细胞浸润,严重者则以出血、坏死为特点,大片出血以及密集的混合性炎症细胞浸润可导致腺泡小叶结构模糊不清;脂肪组织呈灶状坏死,产生的脂肪酸与钙结合形成局部钙化。
3.3.2 移植胰腺慢性胰腺炎 持续的、反复发作的急性胰腺炎可逐渐转变为慢性胰腺炎,典型的移植胰腺慢性胰腺炎呈胰腺体积缩小,重量减轻,小叶结构紊乱,小叶间隔宽窄不一。胰腺常与周围脏器和组织粘连而难以剥离。镜下可见早期胰腺间质内以淋巴细胞为主的炎症细胞浸润,间质纤维组织轻度增生,小叶内腺泡部分受累。而晚期,由于大量纤维组织增生以及转化为瘢痕组织并累及大多数小叶腺泡,多数腺泡为纤维组织取代,多数胰岛萎缩消失。
3.4 移植胰腺胰岛炎与糖尿病复发
胰腺移植后胰岛炎(insulitis)与糖尿病复发有密切关系[27],尤其是在供、受者之间为孪生兄弟姐妹以及HLA相同的亲属活体胰腺移植者,也正是由于这一原因,移植术后免疫抑制剂剂量低导致术后糖尿病的复发率非常高,同卵双生的孪生之间胰腺移植后在不应用免疫抑制剂时,糖尿病的复发率为100%。胰腺移植后糖尿病复发的病例表现为移植胰腺的胰岛炎,其是指胰岛内不同程度的炎症细胞浸润以及由此造成胰岛β细胞的破坏与消失[28]。其基本的发病机制可能是由于导致糖尿病的自身免疫性因素仍然存在。移植胰腺胰岛炎根据胰岛内浸润的炎症细胞数量的多少分为轻度、中度和重度3个级别,其中轻度为每个胰岛内浸润的炎症细胞<10个;中度为每个胰岛内浸润的炎症细胞为10~55个;重度为每个胰岛内浸润的炎症细胞达到>55个。免疫组化显示胰岛炎时胰岛内细胞HLAⅠ类抗原表达明显增加,胰岛内浸润的炎症细胞以CD8+为主。胰岛炎时损伤与消失的主要为胰岛素(insulin,I)产生细胞,而高血糖素(glucagon,G)产生细胞则基本正常,两种细胞的比例即I/G比在胰岛炎及其进展阶段明显降低,而如果I/G比低于1则可以作为移植胰腺复发性糖尿病胰岛炎的组织学诊断依据之一。
移植胰腺胰岛炎与急性排斥反应的鉴别主要依据各自的靶部位以及各自主要的组织学特点,急性排斥反应主要累及胰腺外分泌部以及其中的血管等,表现为胰腺外分泌部明显的炎症细胞浸润以及血管内皮炎等特点,而胰岛炎的靶部位在胰腺内分泌部即胰岛,即主要表现为胰岛的炎症细胞浸润。
3.5 移植胰腺巨细胞病毒感染
胰腺移植后由于大量免疫抑制剂的应用常合并巨细胞病毒(cytomegalovirus,CMV)感染,形成CMV感染性胰腺炎,其组织学表现仅为胰腺间质内淋巴细胞浸润,有时可在血管内皮细胞以及导管上皮细胞内形成CMV包涵体(CMV inclusion body),在局灶性坏死灶内可见少数中性粒细胞浸润。因此如果CMV感染合并急性排斥反应时,两者的鉴别诊断非常困难,连续切片进行仔细的观察以寻找CMV包涵体以及进一步的免疫组化染色和寻找急性排斥反应的血管表现成为鉴别诊断的必然途径。
3.6 移植后淋巴组织增生性疾病
移植后淋巴组织增生性疾病(posttransplant lymphoproliferative disease,PTLD)与免疫抑制剂的应用和爱泼斯坦-巴尔病毒(Epstein-Barr virus,EBV)感染有关[29-30],肿瘤细胞绝大多数为B细胞源性,应用免疫组化检测T细胞及B细胞表面标志物有助于诊断。PTLD通常发生于移植胰腺原位,也可能发生于移植胰腺以外的消化道以及中枢神经系统。对于单形性PTLD淋巴瘤,组织学上表现为胰腺实质内大量单一的、异型性B细胞表型阳性的淋巴细胞浸润,同时可有不规则灶状坏死。多形性PTLD淋巴瘤的细胞为不同分化阶段的B细胞,其中异型性的细胞占10%~70%。由于EBV在PTLD的发病机制中发挥重要作用,绝大多数PTLD的肿瘤组织中均可呈EBV阳性。PTLD中由于大量淋巴细胞浸润,静脉血管分支的内皮细胞也常有B细胞浸润,可形成与急性排斥反应类似的血管内皮炎样表现,而动脉内皮炎罕见,除非PTLD同时合并有以动脉内皮炎为特点的急性排斥反应。
移植胰腺PTLD病理学诊断中最关键的问题是与急性排斥反应的鉴别,主要因为两者在病理组织学的表现上非常类似,而诊断后的治疗策略却完全相反。在鉴别诊断上,由于PTLD主要为B细胞来源,而急性排斥反应主要的效应细胞为T细胞,因此T细胞与B细胞表型的免疫组化染色非常有助于初步的诊断,当然,动脉内皮炎等排斥反应特征性病变的观察也是重要的方面。
3.7 免疫抑制剂对移植胰腺的影响
胰腺移植术后常规应用的免疫抑制剂一方面可以积极地预防和治疗排斥反应,但另一方面也会造成移植胰腺胰岛细胞损伤,从而增加移植后糖尿病的发生风险,由环孢素和他克莫司导致的糖尿病仍是限制移植受者长期存活的一个重要障碍。环孢素和他克莫司对于移植胰腺内分泌部即胰岛具有毒性损伤作用,进而导致移植胰腺的胰岛细胞损伤及糖尿病的发生,其中他克莫司的作用尤为显著。
在移植胰腺活检组织中可以通过观察胰岛细胞形态学变化予以诊断。光镜下可见,通常的胰腺穿刺活检组织内可检见1~10个(平均4个)胰岛,环孢素和他克莫司毒性损伤的胰岛细胞,轻微损伤时表现为胰岛细胞轻微肿大,细胞内可见细小空泡变甚至明显的大空泡变,使得整个胰岛细胞胞浆呈空亮状,这一变化尤其见于应用他克莫司者。随着毒性损伤的进一步加重,胰岛细胞出现核碎裂以及以核嗜酸性固缩为特点的凋亡,进而部分胰岛细胞缺失。应用胰岛素的免疫组化染色可见毒性损伤的胰岛内阳性细胞明显减弱。电镜下,可见正常的胰岛细胞内含有大量的内分泌颗粒、线粒体以及少数粗面内质网和高尔基复合体,而没有胞浆肿胀以及空泡变。环孢素尤其是他克莫司毒性损伤时的胰岛细胞内可见胞浆明显肿胀以及空泡变,细胞内分泌颗粒明显减少。
4 小 结
胰腺移植不仅包括SPK、PAK和PTA等多种移植类型,还包括胰液膀胱引流或肠道引流等不同术式。移植胰腺的排斥反应是导致移植胰腺失功的主要因素,且其缺乏特异性的临床表现和检测指标,同时SPK中移植肾和移植胰腺的急性排斥反应缺乏协同性,因此直接针对移植胰腺的活检是明确诊断其排斥反应的最佳方式。移植胰腺的活检包括经皮穿刺活检、膀胱镜活检、腹腔镜活检和开放式活检等多种方法,其中经皮穿刺活检是最首选的活检方法,近年来腹腔镜活检也是值得采用的活检途径,其可以同时取得移植胰腺和移植肾组织进行明确诊断。希望通过安全、及时的活检对移植胰腺急性排斥反应等并发症予以准确诊断,良好地保障移植胰腺和受者的长期存活。

