黄精组培常见问题讨论*
马菁华,欧明烛,刘 芳,陈云飞,任启飞
(贵州省植物园,贵州 贵阳 550004)
黄精是百合科黄精属(Polygonatum)多年生草本植物,也称老虎姜、黄鸡菜、鸡头黄精。黄精是我国传统中药材之一,以其干燥根茎入药,味甘性平,用于脾胃气虚、口干食少、体倦乏力、肺虚燥咳、腰膝酸软等病症[1]。黄精的化学成分包括多糖、皂苷、生物碱、氨基酸、挥发油等[2-3],除药用外还加工成保健品、护肤品、饮料、蜜饯、饲料添加剂等[4-5]。随着黄精应用价值的开发,市场需求急剧增加,野生黄精的采挖远远不能满足需求,同时也造成野生资源的枯竭和生态环境的破坏,急需开展黄精人工培育。
组培繁殖是以植物生理学为基础发展起来的新兴技术,在离体条件下利用植物的器官、组织、细胞、原生质体等培养出新的植株。组培繁殖不受自然条件限制,节省空间,繁殖快、繁殖系数高,是解决黄精种源匮乏、繁殖效率低的有效手段。
1 黄精组培快繁进展
对多花黄精(Polygonatumcyrtonema)的组培研究较多。周新华等以多花黄精根茎芽培养的无菌苗为研究对象,发现3~4月采集的外植体有利于植株生长和腋芽萌发,将根茎芽切成1份的无菌块茎培养45天的效果最好[6]。沈宝明等以多花黄精顶芽为外植体开展组培,一个顶芽可在6个月后获得80株组培苗[7]。饶宝蓉等以多花黄精的种子为试材,成功开展黄精组培实生苗生长影响研究[8]。吕煜梦通过优化外植体消毒和诱导不定芽条件,建立了黄精离体无菌体系,并研究了不定芽增殖影响因素[9]。刘剑东等研究初步确定了pH值、温度、光照等环境影响因子[10]。王辉等以多花黄精种子无菌萌发后形成的幼芽为材料建立多花黄精高效再生体系,完成了从愈伤组织到生苗炼苗的完整环节,可为黄精产业开发提供技术支持[11]。
也有少量其他种黄精的组培研究。钟华等探索不同栽培基质对滇黄精(P.kingianumColl.et Hemsl.)组培苗生长的影响[12]。陆静等以四川主载品种大叶黄精(P.kingianumColl.et Hemsl.var.grancd folium D.M.Liu et W.Z.Zeng,var.nov.)地下根茎芽为外植体进行组培快繁体系的初步研究,能够获得大量组培苗,并发现6-BA在组培中起重要作用[13]。
2 黄精组培常见问题讨论
由上文可知,利用黄精不同部位作为外植体研究黄精组培的成功案例很多,组培快繁技术已十分成熟。但不可否认组培仍然面临选择哪个部位作为外植体,如何处理,怎样搭配生长调节物质,炼苗条件等诸多问题,如何提高组培的效率,降低组培成本,仍需进一步探索。目前,影响黄精组培效率的问题主要包括外植体污染、植物生长调节剂的选择、组培苗炼苗等。
2.1 外植体污染
2.1.1 污染现象的发生
组培首先面对的选择是外植体。细胞分生能力、消毒难度、分化时间等影响到外植体的选择,黄精可用作外植体进行组培的部位包括根状茎[14-15]、叶片[16-17]、嫩芽[7]、荚果[18]、种子[19-20]、种子萌发形成的初生根茎[10]、种子萌发的幼芽[11]等。无论用哪个部位来进行组培,都有污染现象的发生。程强强等试验发现根茎芽包片的细菌不易消除,极易产生细菌污染[21]。根据孙骏威统计,以根状茎为外植体进行组培,处理4 d后开始细菌污染,之后开始真菌污染,6~10 d为污染高峰期[14]。不同外植体的污染程度也有差异,种子污染率在16%~64%[8],根状茎污染达34.6%~89.1%[9],带芽根状茎污染率22%~53%[13]。
2.1.2 污染控制
组培建立在无菌条件之上,污染率严重影响组培进行,因而外植体的消毒效果极为重要。研究人员开展了多种方式的消毒试验,前处理包括用洗洁精、洗衣粉、多菌灵等浸泡,流水冲洗,消毒程序包括酒精、升汞、次氯酸钠、过氧化氢等试剂浸泡、无菌水涮洗等。经过不同试验处理对比,分别找到针对不同部位的消毒方法。研究发现,经过洗衣粉和多菌灵处理后根状茎的污染率降低至34.6%,使用升汞消毒能进一步降低污染率至14.0%,但褐化加重(67.2%)[22]。选择新鲜黄精种子进行组培繁殖时,外果皮是污染的主要来源,将果皮去除干净,再用洗衣粉、多菌灵等浸泡、冲洗,之后转入超净工作台消毒。选用70%酒精1 min,8% NaClO 10~15 min,0.1%HgCl210~15 min可将污染率控制在8%~12%[20],或75%酒精30 s,0.1% HgCl25 min,隔天重复消毒一次,污染率也降低至11.6%[23]。表1对多种消毒方式及其效果进行了统计,可为外植体处理提供参考。

表1 外植体消毒方法及效果Tab.1 Disinfection methods and effects of explant
2.2 植物生长调节剂的选择
2.2.1 植物生长调节剂的作用
激素的使用可以刺激外植体分化形成愈伤组织或不定芽,又可以刺激无根苗生根,合理的激素搭配可以加速组培速率并增加繁殖系数,通过调整激素配比来控制培养物芽或根的形成以达到组培目的,几乎是组培必须手段。细胞分裂素(6-BA、ZT、KT等)和生长素(NAA、2,4-D等)是黄精组培中使用较多的激素。
王辉研究发现2,4-D对愈伤组织的诱导十分必要[11];吕煜梦研究表明一定浓度的6-BA能促进三明野生黄精不定芽的诱导[9];刘剑东研究发现单独使用细胞分裂素不利于丛生芽增殖和生长,与生长素组合使用效果更好[10];程强强研究发现TDZ有利于诱导不定芽的增殖[21];但激素使用浓度不可过高,否则易诱导出玻璃化的不定芽[14]。
2.2.2 植物生长调节剂组合的选择
多数研究(表2)表明,适合黄精愈伤组织诱导及不定芽分化的激素配比为6-BA 2~4 mg/L+NAA 0.2~0.5 mg/L,或适量添加TDZ、2,4-D或GA3;不定芽增殖激素为6-BA 1~3 mg/L+NAA 0.2~0.4 mg/L,或适量添加2,4-D、GA3或IAA;生根激素为NAA 0.1~0.5 mg/L,或适量添加IBA、AC等[7-11,13-16,18,19]。

表2 黄精组培合适的激素配比Tab.2 Appropriate hormone proportions for tissueculture of Polygonatum
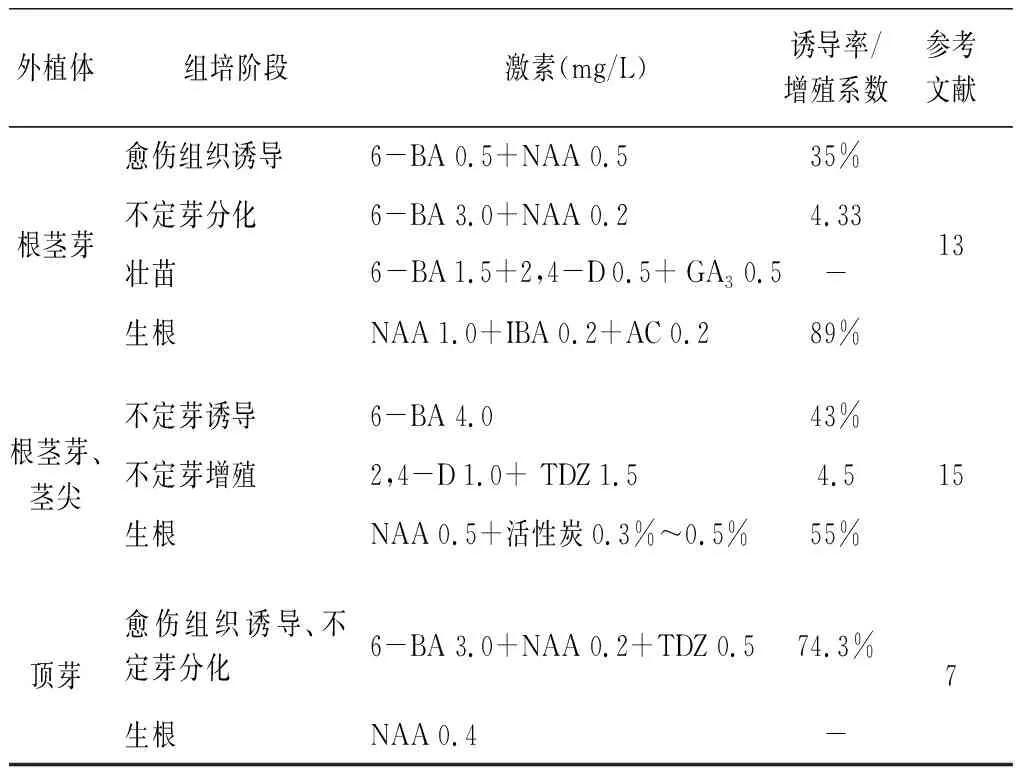
续表2
2.3 组培苗移栽炼苗
2.3.1 移栽炼苗必要性
组培苗生根后已是完整的植株,但组培为实际生产服务,仍需进一步关注组培苗对环境的适应能力。由于组培苗一直培养在人为设定的较为适宜的环境中,且保持无菌状态,生境单一,对外界环境的适应能力很弱,为提高组培苗适应性,应将组培苗移栽至苗盘或室外进行驯化炼苗。
2.3.2 移栽炼苗探索
研究者从组培苗出瓶状态、栽培基质、环境条件控制等多个方面对黄精组培苗炼苗进行了试验(表3)。另外,炼苗还应注意组培操作、瓶苗选择及种植管理。继代培养的次数通过影响芽体生根及根系长势进一步可能影响炼苗成活率[6],出新芽快生长健壮的瓶苗更易成活[20],种植深度以基质表层为好,可提高多花黄精组培苗块茎的成活率[8]。陆静对组培苗设置了按天驯化的步骤,分5天逐步移至树荫下[13];田怀研究发现根数过少或过多均不利于炼苗[19]。

表3 出苗情况及炼苗基质对组培苗成活率影响Tab.3 Survival rate of tissue cultured seedlings
3 总结与建议
3.1 根据外植体不同,污染控制方法不尽相同,不同消毒试剂作用效力和针对性不同,单独使用一种消毒试剂效果不佳。消毒时间同样影响到消毒效果,时间短则污染率高,时间长容易影响外植体活力,同时会伴随褐化率升高。根茎芽、种芽、嫩芽、新叶等新生部位相对容易消毒,且易受消毒试剂影响而降低活力,因而采取2种试剂搭配消毒即可,但具体浓度和时间需要试验探索。而根茎、种子等外植体因为生长在地下或存储时间较长,沾染微生物较多而不易消毒,则应进行一定前处理再选择消毒试剂消毒,才能达到理想效果。
3.2 6-BA和NAA在黄精组培中几乎不可或缺,由于植物不同部位及不同生长阶段对激素的响应不同,激素合理搭配才更有利于组培苗生长。细胞分裂素、生长素以及赤霉素的使用诱导外植体在较短时间内分化达到理想状态,但试验条件的不同导致诱导率不尽相同,对比分析可知激素的使用暂未达到理想水平,植物生长调节剂的探索道路依然较长。
3.3 炼苗成功与否直接关系到组培苗能否进行大规模产业化生产,是非常重要的环节。炼苗之前应将根部培养基洗净,以防止营养过度造成微生物繁殖过快对植株造成影响,初期还要喷洒多菌灵进一步防止微生物。从上述文献资料中可以看出炼苗成活率都在83%以上,且沙土搭配有机类物质成活率更高。常用的栽培基质主要有河沙、蛭石、珍珠岩、椰糠、草炭等。沙土松软利于根系向下生长,是炼苗的首选固定植株的载体,但沙土缺乏营养,在基质中还应搭配椰糠、腐殖质等有机类物质可提高植株成活率,必要时还应注意添加肥料元素。
影响组培苗驯化的因素还包括炼苗季节、温湿度、光照度、光质等。冬季气温低,组培苗生长缓慢,需在人工可控的温室进行炼苗,夏季气温高则应根据植物的习性选择合适的遮光条件并注意补水。温度以25 ℃左右为好,湿度需保持在80%以上,黄精是阴生型植物,光照不宜过强。

