俄罗斯杨树新品种N2组培苗生根相关生理生化指标变化分析
梁立东
(黑河市林业科学院,黑龙江 黑河 164300)
俄罗斯杨树新品种N2(Populusnigra×P.pyramidaeis)适用于我国高纬度寒冷地区营造速生丰产林、农田防护林及城市绿化等,具有适应性强、生长迅速、深根窄冠、材质优良、抗逆性强等诸多特性[1~8]。黑河市林业科学院于2004年从俄联邦科学院西伯利亚分院中心植物园引进了该品种,并对其开展了组织培养技术[1-4]、嫩枝扦插技术[5]、区域化试验[6]、硬枝扦插生根能力[7]、硬枝扦插苗生长[8]情况等方面研究。目前,对俄罗斯杨树新品种N2组培苗生根研究已有相关报道[1,4],但对其组培苗生根过程中相关生理生化指标变化还未见报道。本研究在以建立腋芽组织培养体系的基础上,测定分析了组培苗生根过程中可溶性糖含量、可溶性蛋白含量、POD活性、PPO活性和IAAO活性变化,旨在探讨这些相关生理生化指标变化与组培苗不定根形成的关系,为建立俄罗斯杨树新品种N2组培苗高效生根技术体系提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为俄罗斯杨树新品种N2当年萌生嫩枝,去叶剪成2 cm带芽茎段,流水冲净后,75%乙醇消毒30 s,再0.1%氯化汞消毒12 min,无菌水冲洗5~8次,接种到附加6-BA 0.5 mgL-1和NAA 0.05 mgL-1的1/2MS培养基上培养,获得均匀一致的组培苗为试验材料。
1.2 试验方法
1.2.1 生根培养方法 选择去叶约为2 cm组培苗茎尖,将其接种到生根培养基(MS+IBA0.04 mgL-1+蔗糖30 gL-1+琼脂8 gL-1,pH5.8)上,培养温度25 ℃,光照强度20 μmolm-2s-1,光照周期18 hd-1
1.2.2 生理生化指标测定 从组培苗生根0 d开始取样,每天取样1次,共取8次样。所取样品用于生根过程中可溶性糖、可溶性蛋白、POD、PPO和IAAO活性测定。可溶性糖含量测定采用苯酚法;可溶性蛋白含量测定采用考马斯亮蓝法;POD活性测定采用愈创木酚比色法;PPO活性测定采用邻苯二酚比色法;IAAO活性测定采用二氯酚比色法。
1.3 数据处理
试验获得数据应用SPSS19.0软件进行统计分析,采用Sigma Plot 12.5进行作图。
2 结果与分析
俄罗斯杨树新品种N2组培苗在生根过程中相关生理生化指标存在着较大差异,在可溶性糖、可溶性蛋白、POD活性、PPO活性和IAAO活性方面的差异见表1。
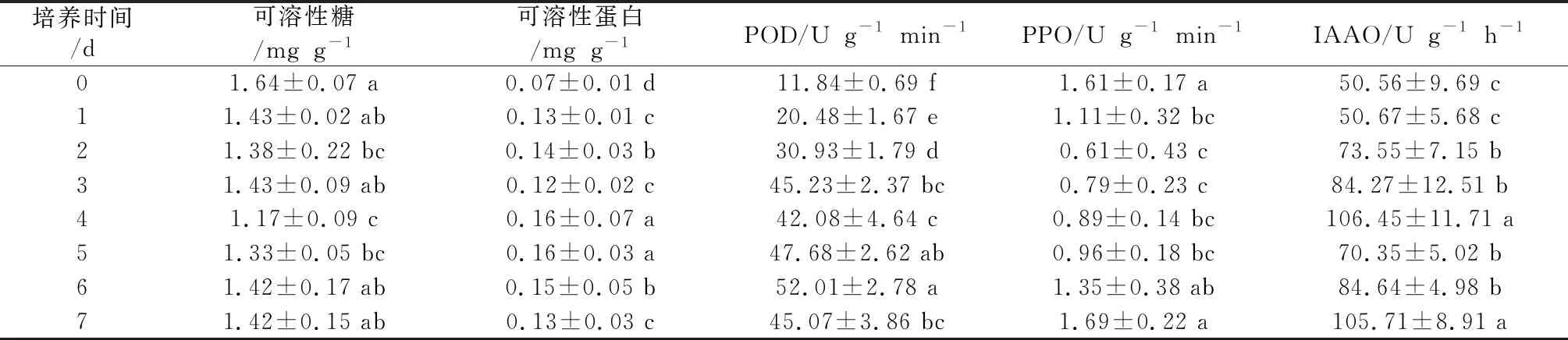
表1 俄罗斯杨树新品种组培苗生根过程中相关生理生化指标变化
注:同一列中相同小字母表示在P﹤0.05水平差异不显著
2.1 可溶性糖含量变化
由图1可知,可溶性糖含量随着生根时间的增加,呈现出前期减小后期增加的趋势,在组培苗生根过程中可溶性糖含量变化幅度较大。在组培苗生根前期的0~4 d内,可溶性糖含量呈显著下降趋势,由1.64 mgg-1下降到1.17 mgg-1。在组培苗生根第4天时可溶性糖含量达到最低点。
图1俄罗斯杨树新品种组培苗生根过程中可溶性糖含量变化分析
随后在组培苗生根的第4~7天,可溶性糖含量呈显著上升趋势,由1.17 mgg-1上升到1.42 mgg-1。可溶性糖为组培苗不定根形成的主要营养物质,在不定根形成前期需要消耗大量可溶性糖,造成组培苗体内可溶性糖含量的迅速下降,而随着不定根形成后,组培苗恢复正常生长合成了大量可溶性糖,致使组培苗体内可溶性糖含量迅速增加,恢复到组培苗正常生长所需水平。
2.2 可溶性蛋白含量变化
由图2可知,可溶性蛋白含量随着生根时间的增加,呈现出先增加后减小再增加再减小的趋势,在组培苗生根过程中可溶性蛋白含量变化幅度较大。在组培苗生根的0~2 d内,可溶性蛋白含量呈显著上升趋势,由0.07 mgg-1上升到0.14 mgg-1。在组培苗生根的第2~3天,可溶性蛋白含量呈显著下降趋势,由0.14 mgg-1下降到0.12 mgg-1。在组培苗生根第3天时可溶性蛋白含量达到最低点。在组培苗生根的第3~4天,可溶性蛋白含量再次呈显著上升趋势,由0.12 mgg-1上升到0.16 mgg-1。在组培苗生根第4天时可溶性蛋白含量最高点。随后在组培苗生根的第4~7天,可溶性蛋白含量再次呈显著下降趋势,由0.16 mgg-1下降到0.13 mgg-1。可溶性蛋白在组培苗不定根形成过程中起着重要的作用,在不定根形成前期需要某些特定酶的大量合成,促使组培苗体内可溶性蛋白含量不断增大,而在不定根形成后这些酶减少合成量,使组培苗体内可溶性蛋白含量迅速下降,恢复到组培苗正常生长所需水平。
2.3 POD活性变化
由图3可知,POD活性随着生根时间的增加,呈现出先增加后减小再增加再减小的趋势,在组培苗生根过程中POD活性变化幅度较大。在组培苗生根的第0~3天,POD活性呈显著上升趋势,由11.84 Ug-1min-1上升到45.23 Ug-1min-1。在组培苗生根的第3~4天,POD活性呈显著下降趋势,由45.23 Ug-1min-1下降到42.08 Ug-1min-1。在组培苗生根的第4~6天,POD活性再次呈显著上升趋势,由42.08 Ug-1min-1上升到52.01 Ug-1min-1。在组培苗生根第6 d时POD活性达到最高点。随后在组培苗生根的6~7 d内,POD活性再次呈显著下降趋势,由52.0 1 Ug-1min-1下降到45.07 Ug-1min-1。POD活性已被作为生根的重要生理生化指标,在组培苗生根过程中POD活性会出现2个高峰,分别参与不定根诱导和表达,促进组培苗不定根形成[9,10]。俄罗斯杨树新品种N2组培苗在生根过程中POD活性变化也出现了2个高峰,也进一步证实POD活性变化与组培苗不定根形成有密切关系。
2.4 PPO活性变化
由图4可知,PPO活性随着生根时间的增加,呈现出前期减小后期增加的趋势,在组培苗生根过程中PPO活性变化幅度较大。在组培苗生根前期的0~3天,PPO活性呈显著下降趋势,由1.61 Ug-1min-1下降到0.61 Ug-1min-1。在组培苗生根第3天时PPO活性达到最低点。随后在组培苗生根的第3~7天,PPO活性呈显著上升趋势,由0.61 Ug-1min-1上升到1.69 Ug-1min-1。PPO活性与组培苗生根有着密切关系,在组培苗生根过程中PPO活性急剧上升,催化酚类物质与IAA形成一种促进不定根形成的物质,促进组培苗不定根形成[11,12]。俄罗斯杨树新品种N2组培苗在生根过程中PPO活性变化与之不同,这可能是由于树种不同及其不定根形成所需酚类物质含量不同所导致。
2.5 IAAO活性变化
由图5可知,IAAO活性随着生根时间的增加,呈现出先增加后减小再增加的趋势,在组培苗生根过程中IAAO活性变化幅度较大。在组培苗生根的第0~4天,IAAO活性呈显著上升趋势,由50.56 Ug-1h-1上升到106.45 Ug-1h-1。在组培苗生根第4天时IAAO活性达到最高点。在组培苗生根的第4~5天,IAAO活性呈显著下降趋势,由106.45U꽂g-1꽁h-1下降到70.35U꽀g-1꼿h-1。随后在组培苗生根的第5~7天,IAAO活性再次呈显著上升趋势,由70.35U꼾g-1꼽h-1上升到105.71U꼼g-1꼻h-1。IAAO活性与组培苗生根有重要关系,在组培苗生根前期IAAO活性相对较低,有利于不定根形成分化,而随着不定根形成后,IAAO活性急剧上升,降低组培苗体内IAA含量,促进不定根生长[13]。俄罗斯杨树新品种组培苗N2在生根过程中IAAO活性与之相同,也进一步证实了这一点。
3 讨论与结果
俄罗斯杨树新品种N2组培苗生根与可溶性糖含量、可溶性蛋白含量、POD活性、PPO活性和IAAO活性具有密切相关性。在组培苗不定根形成过程中,可溶性糖含量呈现出前期减小后期增加的趋势;可溶性蛋白含量呈现出先增加后减小再增加再减小的趋势;POD活性呈现出先增加后减小再增加再减小的趋势;PPO活性呈现出前期减小后期增加的趋势;IAAO活性呈现出先增加后减小再增加的趋势。在组培苗不定根形成高峰期左右达到最高值或最低值。这些结果与很多相似试验研究结果是基本相同的,从而进一步证实不定根形成与相关生理生化指标具有相关性,可以采用相关生理生化指标作为不定根形态分化指标。

