白及块茎与须根多糖提取及止血作用研究*
刘 霜,刘林莉,刘 琴,彭文海,麻秀萍,徐 剑,张永萍,杨雅欣
(贵州中医药大学,贵州 贵阳 550025)
白及为兰科植物白及属白及Bletillastriata(Thunb.)Reichb.f.的块茎,收载于《中国药典》2020版,具有收敛止血、消肿生肌的功效,常应用于吐血, 咯血,外伤出血,疮疡肿毒,皮肤皲裂[1]。白及药用部位为块茎,须根为废弃部位,为了合理开发利用资源,对白及须根进行研究极有意义。
白及多糖有较好的促进止血、凝血作用[2-3],其白及须根与白及块茎成分相似[4],白及须根具抗氧化、抗肿瘤、抗菌等作用,且白及须根醇提物抗菌活性优于白及块茎[5-9];白及块茎多糖含量高于须根[10];白及须根总酚含量高于白及块茎[11],说明白及须根存在开发价值。王玮[12]经过单因素、正交试验优选出白及多糖提取的最佳工艺技术参数,料液比(药材质量g/所用溶剂的体积mL)为1∶15,在90 ℃水浴下提取2次,每次1.5 h。张媛媛等[13]在茶多糖测定中,发现苯酚-硫酸法在反应产物的稳定性、测定精确度以及样品回收率方面均优于蒽酮-硫酸法。
目前未见比较白及须根粗多糖与白及块茎粗多糖止血研究,因此提取白及须根与块茎粗多糖,用苯酚硫酸法测其多糖含量,并比较其体外凝血实验结果,考察白及须根粗多糖是否具有体外凝血作用。期望须根成为白及的药用部位,为白及的开发与质量控制奠定基础。
1 实验材料和统计方法
1.1 仪器
紫外可见分光光度计(上海佑科仪器仪表有限公司,型号:UV756CRT),分析天平(上海菁海仪器有限公司,型号:FA2204N;瑞士梅特勒公司,型号:AG285),打粉机(永康市久品工贸有限公司,型号:JP-500C),鼓风干燥箱(上海慧泰仪器制造有限公司,型号:DHG-9035A),离心机(长沙平凡仪器仪表有限公司,型号:TD4A;盐城市凯特实验仪器有限公司,型号:TD5A),水浴锅(上海双捷实验设备有限公司,型号:DRHH-2),微量采血吸管(姜堰市健华医疗器械有限公司,140908),扁形称量瓶。
1.2 药品和试剂
D-无水葡萄糖(中国食品药品检定研究院,批号:ESAV-3WNK),硫酸(重庆川东化工(集团)有限公司,试剂类型:分析纯),苯酚(国药集团化学试剂有限公司,试剂类型:分析纯),云南白药(云南白药集团股份有限公司,ZHA2003),柠檬酸二钠(上海麦克林生化科技有限公司,C11499087),CaCl2(国药集团化学试剂有限公司,20171023),蒸馏水。
1.3 样品来源
所购白及片及须根由贵州中医药大学孙庆文教授鉴定为兰科植物白及属白及Bletillastriata(Thunb.)Reichb.f.的植物,样品来源如表1。

表1 样品来源Tab.1 Sources of samples
1.4 实验动物
SD大鼠,由长沙市天勤生物技术有限公司提供,动物生产许可证SCXK(湘)2019-0014,饲养于贵州中医药大学实验中心动物室内。
1.5 统计方法
使用IBM SPSS Statistics 21.0对数据进行显著性差异分析,显著水平P=0.05。结果用平均值±标准差表示。
2 白及多糖含量测定方法与结果
2.1 白及粗多糖的提取
称定过40目白及粉10 g(白及须根粉20 g),料液比1∶15(g/mL),以蒸馏水为提取溶剂,在90 ℃水浴下提取两次,每次1.5 h,提取液于离心机3500 r/min转速下,离心20 min,得上清液后浓缩,加入浓缩液3倍量95%乙醇醇沉,放置一晚,滤过,60 ℃干燥,得白及粗多糖,称量,计算白及粗多糖得率,粉碎后备用。
按上述方法提取白及粗多糖,并计算粗多糖得率,结果见表2。

表2 40目白及块茎与白及须根粗多糖得率(n=3)Tab.2 Yield of crude polysaccharide from the tuber andthe fibrous root of Bletilla striata(n=3)
白及粗多糖得率=(W2/W1)*100%
其中,W1为扣除药材水分的白及粉重量,W2为白及粗多糖重量。
2.2 对照品溶液的配制
精密称取D-无水葡萄糖1.65 mg,于10 mL棕色容量瓶中,加水定容即得165 μg/mL的阳性对照溶液,冰箱冷藏备用。
2.3 供试品溶液的配制
2.3.1 白及块茎粗多糖供试液的制备
精密称取白及块茎粗多糖0.1 g,置50 mL容量瓶中,加热水溶解(加热水后若不溶则于水浴锅中90 ℃水浴溶解),放冷加水至刻度,取1 mL置15 mL离心管中,加无水乙醇5 mL,摇匀,冷藏1 h取出,3500 r/min离心20 min,弃去上清液,沉淀加80%乙醇洗涤两次,每次4 mL,3500 r/min离心20 min,离心弃去上清液,沉淀加热水溶解,转移至25 mL容量瓶中,冷却后定容至刻度,即得白及块茎粗多糖供试液。
2.3.2 白及须根粗多糖供试液的制备
精密称取白及须根粗多糖0.1 g,置25 mL容量瓶中,加热水溶解(加热水后若不溶则于水浴锅中90 ℃水浴溶解),放冷加水定容至刻度,后续步骤同2.3.1。
2.4 检测波长的确定
取适当浓度供试品和对照品溶液各1 mL,分别置于不同具塞玻璃试管中,按苯酚-硫酸法显色[12],以相应试剂为空白,分别于200~800 nm波长范围内进行扫描。结果如图1、图2、图3,将488 nm作为检测波长。

图1 白及须根粗多糖紫外吸收图谱Fig.1 Ultraviolet absorption spectrum of crude polysaccharidefrom the fibrous root of Bletilla striata
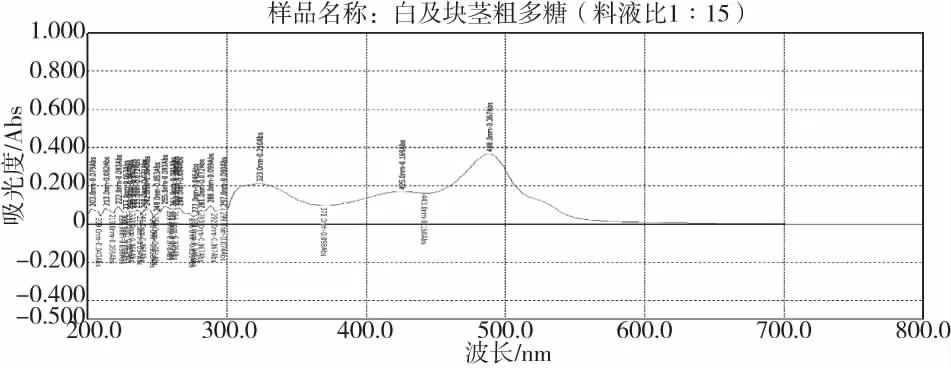
图2 白及块茎粗多糖紫外吸收图谱Fig.2 Ultraviolet absorption spectrum of crude polysaccharidefrom the tuber of Bletilla striata
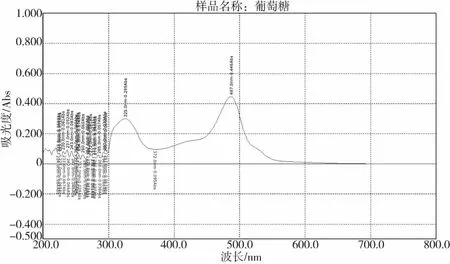
图3 D-无水葡萄糖紫外吸收图谱Fig.3 Ultraviolet absorption spectrum of D-anhydrous glucose
2.5 多糖含量测定
2.5.1 线性关系
精密取D-无水葡萄糖溶液0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL至具塞试管中,依次加水补足1 mL,以相应试剂为空白,同2.4显色后,测定吸光度,以吸光度对浓度回归,得方程,如表3。结果表明葡萄糖浓度在16.5~99.0 μg/mL范围内线性关系良好(线性曲线如图4)。

表3 葡萄糖线性关系结果Tab.3 Linear relation results of glucose

图4 葡萄糖标准曲线图Fig.4 Standard curve of glucose
2.5.2 白及块茎粗多糖与须根粗多糖中多糖的含量
将配制好的供试液显色后,测定其吸光度,结果如表4。

表4 白及块茎粗多糖与白及须根粗多糖中多糖含量测定结果(n=3)Tab.4 The content of polysaccharide from the tuber andthe fibrous root of Bletilla striata(n=3)
3 白及块茎和须根粗多糖体外凝血实验结果
分别取白及块茎粗多糖、白及须根粗多糖、云南白药10 mg各一组,置于5 mL的离心管中,将粉末尽量铺开均匀分布于离心管底部,离心管中分别加入3滴3.8%的柠檬酸二钠溶液。大鼠进行目内眦眼圈取血,分别加入1 mL血液于上述离心管中,再加入25 μL 0.2 mol/L CaCl2溶液用来络合之前加入的抗凝剂,并立即混匀,从加入CaCl2溶液后开始计时。先静置1 min,每隔30 s倾斜试管,至血液凝聚不能流动,立即停止计时,记录各组凝血时间,以不加被研究药物为阴性对照组,以云南白药为阳性对照组,每组测8个样品(注:此处所用白及粗多糖来源于BJ012,BJ012-1),结果见表5。

表5 白及块茎粗多糖与须根粗多糖体外凝血时间分析结果(n=8)Tab.5 In vitro blood coagulation time of the crude polysaccharidefrom the tuber and the fibrous root of Bletilla striata(n=8)
4 结论与讨论
白及药材水分均<15.0%,符合药典规定[14],白及提取物粗多糖水分(按白及药材算)<15.0%。
在预实验中过40目的粗多糖得率均高于过24目的,因此粉碎粒度选为过40目,经多糖含量测定得白及块茎粗多糖得率及多糖含量均高于白及须根。
经显著性差异分析得阴性对照组与阳性对照组、白及块茎粗多糖组、白及须根粗多糖组,有显著性差异(P<0.05);阳性对照组与白及块茎粗多糖组和白及须根粗多糖组,无显著性差异(P>0.05);白及块茎粗多糖组和白及须根粗多糖组,无显著性差异(P>0.05)。表明白及块茎粗多糖和白及须根粗多糖均具有体外凝血作用,初步研究表明两者体外凝血作用可能相当,又因水提醇沉还可提取出其他非多糖物质,说明白及须根粗多糖中可能含有其他止血成分,需要进一步研究。

