TKI联合重组人血管内皮抑制素在TKI治疗后局部进展晚期肺腺癌患者的疗效
赵悦 谢赟 贾殿军 张煦涵 卢会杰 李宝辉 石亮
化疗是治疗肺癌的主要方法。众所周知,化疗药物不仅能够杀死肿瘤细胞,同时对人体正常组织细胞也会有损害作用,每种化疗药物都会具有不同的毒性。化疗在临床的应用分为治疗性用药和辅助性用药。EGFR酪氨酸激酶抑制剂(EGFR-TKI)主要通过竞争性结合受体ATP,从而抑制EGFR胞内酪氨酸激酶的去磷化过程,进而抑制肿瘤细胞的增殖和侵袭。对于EGFR敏感突变阳性的晚期肺腺癌患者,EGFR-TKI药物治疗目前成为标准的一线治疗模式,而TKI药物耐药后T790M+的患者可考虑应用奥希替尼,未检测到T790M+的局部进展晚期肺腺癌患者目前NCCN指南推荐继续应用TKI类药物,同时进行局部治疗。然而相当一部分患者可能存在局部治疗控制不佳或很快出现全身转移,如何让此类患者获得更好的局部控制和延长疾病进展时间至关重要。重组血管内皮抑素(恩度)是血管内皮抑制剂,是由我国自主研发的血管生成抑制剂,它主要通过特异性作用于血管内皮细胞发挥作用,进而发挥抑制肿瘤血管生成的作用。恩度作为血管生成抑制剂在NSCLC治疗中取得了一定的疗效[1]。已有研究证实,对于不可切除的Ⅲ期NSCLC患者,恩度联合放化疗,获得了较好的OS[2]。与单独使用厄洛替尼相比,贝伐珠单抗加厄洛替尼联合治疗可提高EGFR阳性ⅢB-Ⅳ期NSCLC患者的PFS[3]。同时,与其他抗血管生成药物相比,恩度具有不良反应更小,患者的耐受性更强的特点。本研究通过恩度联合EGFR-TKI在TKI治疗后局部进展晚期肺腺癌患者中临床疗效进行观察,评价该治疗方案的有效性和不良反应的可耐受性。
1 资料与方法
1.1 一般资料 选取我院2018年1月至2019年8月收治的EGFR敏感突变阳性,一线TKI治疗后局部进展且未检测到T790M+的ⅢB~Ⅳ期肺腺癌患者18例,其中男7例,女11例;年龄46~90岁,中位年龄62岁,患者均为病理学或细胞学确诊为肺腺癌,19外显子缺失或21外显子L858R点突变,临床分期为ⅢB~Ⅳ(第7版AJCC),一线应用TKI药物后出现局部进展且未检测到T790M+,进展部位为骨和脑,其中骨转移2例,脑转移16例。
1.2 治疗方法 所有患者随访中发现局部进展后,继续给予原TKI药物治疗[吉非替尼(易瑞沙,阿斯利康公司)和埃克替尼(凯美纳,贝达药业有限公司],同时给予重组人血管内皮抑制素注射液(恩度,先声药业)30 mg 静脉点滴d1~7,21 d,1周期,共用6个周期,局部进展部位给予局部放疗,骨转移患者放疗剂量40Gy/20F,脑转移患者放疗剂量60Gy/15F。
1.3 治疗效果及毒副作用评价 采用RTOG标准评价放疗毒副反应,采用RECIST标准评价治疗效果,分为完全缓解(CR),部分缓解(PR),稳定(SD)及病变进展(PD)。用药前检测血压和尿常规,医嘱患者每日监测血压,每周检查尿常规,并密切观察咳嗽、咯血及手足皮肤情况。每2周期进行疗效评价。主要观察终点为PFS(无进展时间)。
1.4 统计学分析 应用SPSS 22.0统计软件,通过Kaplan-Meier法分析患者PFS。
2 结果
2.1 疗效评价 18例患者中有1例患者首次复查即出现进展,1例患者4周期恩度后复查出现进展,其余患者均按治疗计划完成。6例患者至随访截止时间尚未出现进展,其中PR 1例,SD 5例。中位PFS为10.5个月(95%CI 7.7~13.2)。12例进展患者中,11例为局部进展部位以外进展,其中2例患者出现多部位进展,1例为局部进展部位治疗后进展。见图1,表1。
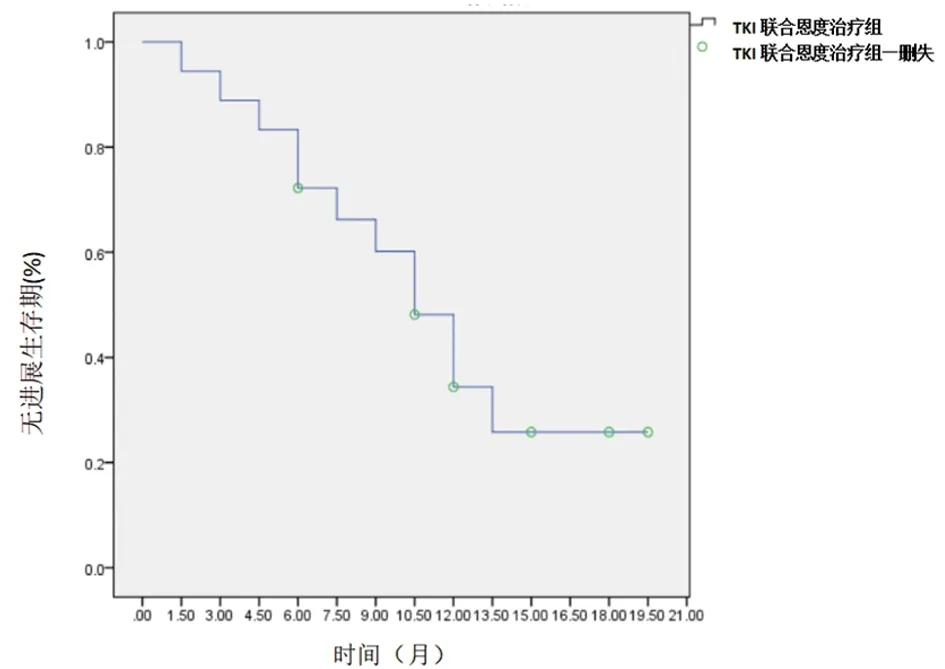
图1 TKI联合恩度治疗组患者的生存曲线

表1 肿瘤进展情况分析
2.2 不良反应 所有患者未发生不可耐受的不良反应,出现皮疹Ⅱ级2例,出现乏力Ⅱ3例,出现蛋白尿2+1例,出现2度骨髓抑制2例,未见Ⅲ~Ⅳ级不良反应发生。见表2。

表2 二级以上不良反应发生情况
2.3 放射性脑损伤及认知障碍发生情况 所有局部进展为脑转移的16例患者中,患者发生放射性脑损伤2例,其中1例为放疗后3个月出现,1个为放疗后6个月出现,患者均未出现认知功能障碍。见表3。

表3 放射性脑损伤发生情况
3 讨论
目前临床中对EGFR敏感突变的晚期肺腺癌患者首先考虑应用TKI类药物治疗,较既往含铂双药化疗的治疗模式明显延长了患者的无进展生存时时间和总生存时间,驱动基因阳性的非小细胞肺癌患者的一线治疗已经由传统的化学治疗向分子靶向治疗方向转变,每种靶向药物具有独自的敏感人群,需要根据肿瘤组织驱动基因的突变情况,来选择相应的靶向治疗药物,目前研究比较透彻的是EGFR基因、ALK 基因、ROS基因,针对EGFR突变的靶向药物主要包括一代的吉非替尼、厄洛替尼以及埃克替尼,二代的阿法替尼和达克替尼以及三代的阿美替尼,奥希替尼等目前临床上均表现出很好的治疗效果,延长了患者的生存时间,降低了不良反应发生率,目前多项研究确立了EGFR-TKI在EGFR 突变晚期NSCLC一线治疗中的地位,同时在一些特殊类型的患者中证实,靶向药物与抗血管药物联合可以增加临床疗效。然而TKI类药物耐药是一个无法回避的问题,最常见的耐药方式包括T790M突变,出现该突变可以选则三代TKI类药物,然而还有相当一部分TKI耐药患者没法继续使用TKI类药物,需要联合其他药物的使用[4-8]。血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是一种能够控制内皮细胞增殖、迁移、浸润及生存的重要的血管生成因子,常在NSCLC内过度表达,已成为一重要的治疗靶点,VEGF和血管内皮生长因子受体(VEGFR)在NSCLC的血管生成和肿瘤进展过程中扮演着重要角色,可能促进肿瘤血管的生成,进而促进肿瘤的生长[9,10]。在临床前研究中证实,同时抑制EGFR和VEGF/VEGFR两条路径具有协同作用,较单独使用效果叠加具有更好的疗效[11],在临床研究中也证实TKI联合贝伐珠单抗较单纯TKI治疗具有更好的生存获益,显著地延长了PFS和OS,目前在相应的指南中也做出了推荐[12,13]。然而贝伐珠单抗存在出血、高血压、蛋白尿等不良反应,限制了其临床应用,阿帕替尼是由我国自主研发的一种新型小分子口服抗血管生成药物,其主要作用机制是抑制肿瘤的新生血管生成,同时改善了肿瘤细胞存在的微环境,进而能够使肿瘤血管正常化[14]。阿帕替尼通过作用于靶向VEGFR-2并抑制细胞内VEGFR-2介导的信号传导途径发挥着作用,其机制是对VEGFR以及细胞内EGFR介导的信号转导产生更广泛的作用,Li等[15]进行了相关的临床以及临床前的研究,在体外异种移植模型试验中证实,通过吉非替尼与阿帕替尼进行联合治疗比单一药物治疗可以延迟肿瘤的生长;同时在一项回顾性研究中对16例晚期NSCLC患者进行分析,经EGFR-TKI治疗超过6个月后出现疾病进展的患者中,如果继续应用原药EGFR-TKI同时联合口服阿帕替尼(250 mg,1次/d),研究结果显示,mPFS以及0RR和DCR均取得了较好的结果,可见阿帕替尼的加入逆转了吉非替尼的耐药性。目前包括NCCN及CSCO指南推荐敏感突变的晚期肺腺癌患者依然是以TKI单药治疗为主的治疗方案。恩度是一种通过人工修饰的血管内皮抑制剂,在基础研究以及临床研究中证实,血管内皮抑素能够发挥使肿瘤血管结构及功能正常化的功能,主要表现在以下几个方面:首先可以杀灭分化不成熟的新生肿瘤血管,同时保留了分化成熟的正常血管;另外,它可以改善血管的渗透性,减轻肿瘤的水肿,进而降低了组织间隙间的压力,肿瘤血管功能的正常化是通过肿瘤组织间隙压力的下降以及跨血管压力梯度的出现来实现的。因此,血管内皮抑素可以改善肿瘤的乏氧状态,提高放疗和化疗的敏感性[16]。恩度与贝伐单抗均作用于血管内皮,但与贝伐单抗相比出血风险更低,同时,高血压,蛋白尿等不良反应也相对较轻。
在一线厄洛替尼出现PD后继续应用厄洛替尼是可行的,可以延缓挽救性治疗的时间,同时没有增加明显的毒性,其中位PFS1为11.0 (95% CI,9.2~11.1),PFS2为14.1 (95% CI,12.2~15.9),继续应用厄洛替尼的患者再次出现进展的中位PFS被延长了3.1个月[17]。另有一项研究证实在一线应用TKI类药物进展后,继续应用原方案靶向治疗,同时对局部进展病变给予放疗或手术治疗,其中位PFS延长了6.2个月[18]。同时,在应用TKI治疗后出现颅外进展的寡转移灶的EGFR突变的非小细胞肺癌患者中,继续给予TKI治疗同时对转移灶给予热消融治疗可以增加10个月的中位PFS[19]。可见,在应用TKI类药物治疗的晚期肺腺癌患者,如果出现局部进展,继续再应用原TKI类药物进行治疗,同时给予局部治疗,仍然可以使患者获得PFS的延长。
放射性脑损伤是恶性肿瘤放疗后的较为常见的严重不良反应,在放疗后期可能出现认知功能障碍,进而严重影响患者的生命质量和生存时间。为脑瘤患者选择合适的放疗管理模式,规律进行认知测试,并在适当的时机提供治疗措施对改善患者的生命质量至关重要[20,21]。通常认为放射性脑损伤可以根据临床症状出现的早晚分为急性型、早迟发反应型和晚迟发反应型三种亚型,急性型一般常发生于放疗开始后的数天至数周内,多数以头痛、恶心、呕吐、意识障碍等为主要临床表现,目前认为此种类型是临床可逆的;早迟发反应型一般发生于照射结束后1~6个月内,临床主要表现为食欲不振、嗜睡、记忆力减退、易怒以及兴奋性提高等,有些时候也可能出现脑干脑炎、肿瘤假性进展等临床亚型,上述症状大多也是可以通过及时有效的临床治疗得到恢复的;晚迟发反应型:该型出现于放疗结束6个月以后,是放射性脑损伤最常见的临床类型,又称晚发性放射性脑损伤,这型损伤一般是不可逆的,常见于脑部照射剂量>50 Gy者,可出现脑萎缩、脑白质病、内分泌功能障碍、认知能力降低等表现,最后导致痴呆或死亡[22]。恩度是一种人工合成的抗肿瘤血管生成类药物,具有广谱抗血管生成的活性,其作用机制是通过抑制形成血管的内皮细胞迁移而抑制肿瘤新生血管的生成,能够改善血管内皮渗透性,实现肿瘤血管及其微环境正常化,保证血脑屏障的完整性,使血管回流通畅,减少渗出,从而减轻脑水肿的发生[23]。
本研究在延长TKI类药物全身控制的同时,通过恩度的放疗增敏效果,增加了局部进展部位的放疗疗效,达到了较好的治疗效果,同时未出现不可耐受的毒副反应,并且放射性脑损伤发生率较低,未出现认知功能障碍情况,因此可以作为一种新的治疗方法进行探讨。在肿瘤进展部位中,以原发灶进展为主要的进展模式,考虑与EGFT-TKI耐药有关。

