微生物中一碳代谢网络构建的进展与挑战
郭姝媛,吴良焕,刘香健,王博,于涛
(1 中国科学院深圳先进技术研究院,深圳合成生物学创新研究院,合成生物化学研究中心,广东 深圳 518055; 2 中国科学院深圳先进技术研究院,深圳合成生物学创新研究院,中国科学院定量工程生物学重点实验室,广东 深圳 518055)

当前,随着工业制造技术的进步,全球的精细化工产品已达7万多种[1],不仅能够满足人们的日常所需,同时也推动了经济的飞速发展。但是,大规模的化工生产导致化石资源(如煤炭、石油等)短缺,环境污染(如温室效应、空气污染等)加重,极大限制了未来经济的快速、绿色、可持续发展,打破了地球原有的生态平衡,威胁到人类的正常生活。因此,迫切需要发展绿色制造手段,弥补化工生产的不足,辅助推动传统工业制造大变革[2]。20 世纪伊始,生物制造被广泛应用于化工、医药领域,已经能够实现乙醇、丙酮等常见化工产品或抗生素等药品的生物转化。随着分子生物学技术和发酵工程领域的发展,利用常规生物系统,结合基因工程化改造和多样化的发酵手段,高效利用一碳化合物(甲烷、甲酸、甲醇与二氧化碳等)生物合成高附加值化学品,逐渐成为生物制造领域的研究热点。
一碳底物(one-carbon,C1)是一类具有单个碳原子的化合物,可分为:气态C1化合物,包括甲 烷(methane, CH4)、 二 氧 化 碳(carbon dioxide, CO2)、 一 氧 化 碳(carbon monoxide,CO);液态C1化合物,包括甲醇(methanol,CH3OH)、 甲 醛(formaldehyde,HCOH)、甲 酸(formate,HCOOH)[3]。上述一碳底物都具有来源广泛、制备容易、价格低廉的特点,各自的特点决定了其在生物制造领域的应用前景。首先,基于CO 的研究,大多聚焦以合成气作为底物(CO 为主,含有H2、CO2等的混合气体),利用气态有氧或无氧发酵,实现化合物的生产[4]。但是,目前该方式存在的问题有产品种类较少(如乙醇、乙酸、2,3-丁二醇),产量较低,所用菌株多为杨氏梭菌(Clostridium ljungdahlii),不利于工程化改造[5],因此本文不做重点讨论。CH4和CO2作为温室效应的主要气体,高效利用二者不仅可以缓解能源问题,还可以缓解温室效应,是当前研究的热点。但是,由于CO2本身较弱的亲电性而不易被激活,非自养生物在以CO2作为C1底物进行生物转化时,面临着能量供应缺乏、代谢供应不足、转化效率低、高能耗等多种问题[3],因此,当前的研究大多聚焦于提高固碳效率[6-7],CO2的催还还原[8],CO2和甲酸的共应用[7-8]等方面,力求实现非自养微生物能够高效利用CO2生长,而仅以CO2作为碳源和能源进行化学品的高效生产鲜有报道。与CO2相比,甲烷作为天然气的主要成分,其本身富含能量、具有更强的还原性,在生物转化过程中能够获得更高的产量和转化率,美中不足,气态的甲烷不易存储和运输,且生物发酵过程中,气液界面物质交换的低速传递限制了其高效的生物利用。甲酸和甲醇均可来源于甲烷的氧化、劣质煤炭和生物废料的转化、CO2的还原等方式,二者来源丰富且富含高能,是生物转化的理想原材料[8-9]。相比于价格较为昂贵的甲酸,甲醇作为全球五大商品之一,其制备方式容易且多样化[10],使得其成本日渐低廉,逐渐成为上述C1化合物中最具工业化应用潜力的底物原材料,因而大量研究聚焦于甲醇的生物转化。因此,针对丰富的C1底物,挖掘并构建高效的微生物细胞工厂,是推进C1化合物生物利用的关键。
甲基营养型微生物(methylotrophs)是一类能够利用C1化合物(甲醇、甲烷、甲酸和其他甲基化物质)作为唯一碳源和能源进行生长的微生物[11],大致可分为两类:天然甲基营养型微生物和合成甲基营养型微生物。天然甲基营养型微生物可以通过自身的代谢途径实现对C1化合物的利用,而合成甲基营养型微生物是结合丰富的基因编辑手段,改造模式微生物,使其利用C1化合物高效生产目标产物。因此,探寻并发掘天然的甲基营养型微生物,解析其C1化合物的代谢途径,不仅有利于化合物的生产,也为后续打造合成甲基营养型微生物奠定基础;打造合成甲基营养型微生物,不仅有利于拓宽C1底物的利用范围,增强C1底物的利用率,而且有利于增加C1底物生物制造可行性,二者相辅相成。
因此,本文结合现有的研究成果,介绍了天然甲基营养型微生物利用甲醇、甲烷、甲酸和二氧化碳作为底物进行生物转化的关键酶和代谢途径,并概括了据此形成的多种化学品。其次,介绍了基于大肠杆菌(Escherichia coli)、谷氨酸棒状杆菌(Corynebacterium glutamicum)、酿酒酵母(Saccharomyces cerevisiae)3 种常见的微生物构建合成甲基营养型微生物的多种形式及相应产物;最后,探讨了当前重点研究的CO2、CH3OH、HCOOH 3 种C1底物进行生物转化所面临的瓶颈与挑战,以期为后续的研究提供方向。
1 天然甲基营养型微生物的代谢网络
目前,研究发现多种天然甲基营养型微生物,通过自身的代谢途径实现对一碳化合物的利用。整体代谢网络大致上可分为3个模块:一碳底物的氧化模块(即甲烷、甲醇、甲醛的氧化)、同化模块(即C1化合物进入中心代谢的途径)、异化模块(即甲烷等一碳物质最终转变为CO2)[12]。甲烷、甲醇、甲酸和CO24 种一碳底物的代谢网络一脉相承,甲烷和甲醇经相应的氧化酶(如甲烷氧化酶、甲醇氧化酶等)转变后,均会形成甲醛,甲醛作为大多数甲基营养型微生物一碳代谢网络的中心代谢物,既可介导同化途径实现C1底物的生物利用,也可氧化形成甲酸,并经过甲酸脱氢酶生成CO2,有助于微生物脱毒(图1)。其中,同化途径作为主要的C1代谢模式,有氧条件下,主要包括

图1 天然C1利用途径Fig.1 C1 metabolic networks of native methylotrophs

续表

续表
1.1 一碳化合物的氧化模块
1.1.1 甲烷的氧化
甲烷氧化菌中存在的甲烷氧化酶(methane monooxygenase,MMO)可以转变甲烷为甲醇,主要有两种形式:微粒型MMO(particulate MMO,pMMO)和可溶型MMO(soluble MMO,sMMO)[54]。前者广泛存在于甲烷营养菌中,是一种膜结合蛋白,但是该酶反应所需的辅因子尚未清晰;后者仅存在于特定类型的甲烷氧化菌中,需要NADH作为辅因子提供还原力;同时具有两种MMO 的甲烷氧化菌,其MMO 的表达受到胞内铜离子浓度的影响,铜离子浓度高,主要表达pMMO,铜离子浓度低,主要表达sMMO[55]。研究表明在细胞中表达pMMO 和sMMO 后,pMMO 对甲烷的氧化效率更高,细胞生长率强于sMMO[54]。
1.1.2 甲醇的氧化
甲醇氧化为甲醛是甲醇生物利用的限速步骤。前期研究表明,天然的甲基营养型微生物将甲醇转变为甲醛,主要有4 种甲醇利用酶:NAD 依赖的甲醇脱氢酶(methanol dehydrogenase,MDH)、吡咯喹啉醌(pyrroloquinoline quinone,PQQ)依赖的MDH、N,N-二甲基-4-亚硝基苯胺-氧化还原酶(N,N-dimethyl-4-nitrosoaniline oxidoreductase,MNO)及醇氧化酶(alcohol oxidase,AOX)[11]。前3 种存在于细菌中,AOX 主要存在于甲醇酵母当中。PQQ 依赖的MDH 主要存在于革兰氏阴性菌中(如Methylophilus methylotrophus),还原型PQQ(PQQH2)首先转移2 个电子至呼吸链上的细胞色素CL,然后经由细胞色素CL 传递2 个电子至最终电子受体,即氧化酶[56],此时该酶转化O2为水。天然甲醇酵母利用AOX 将甲醇转化为甲醛,在此过程中,O2转变为副产物过氧化氢,有毒的过氧化氢被催化酶(catalase,CTA)分解成水和O2;值得注意的是AOX 和CTA 均定位在过氧化物酶体中,甲醇氧化过程也发生在过氧化物酶体中[57]。甲醇氧化酶-MNO 存在于部分革兰氏阳性甲基营养菌(如Amycolatopsis、Mycobacterium)中[58],与NADPH 结合紧密[59],结构与Ⅲ型乙醇脱氢酶类似[60]。NAD 依赖的MDH 主要来自于革兰氏阳性甲基营养菌(如Bacillus),转化过程中产生NADH,可存储于细胞中用于其他的代谢活动[56]。此外,当细胞内甲醛被快速消耗并维持在较低水平时,NAD-MDH 活性更佳,对甲醇的氧化能力更 强[56]。因 此,相 比 于PQQ-MDH 和AOX,NAD-MDH 在有氧和无氧条件下均具有氧化活性且反应机制容易,具有更加高效的能量转化能力[61],已被广泛应用于合成甲基营养型微生物代谢底盘的构建。
当前,来自于B.methanolicus的NAD-MDH[62]已被成功用于E.coli甲醇代谢底盘的构建[63-64]。该酶活性依赖于内源的激活蛋白(anendogenousactivator,ACT),它可促进MDH 对甲醇的利用,但酶本身对于甲醇的亲和力较低,而对乙醇的亲和力更高[56],因而所构建的工程菌甲醇转化率较低。为了进一步提高甲醇转化率,众多研究聚焦于该酶的筛选、挖掘、工程化改造,以期得到高效的NAD-MDH。James C.Liao 实 验 室[65]2016 年 报 道 了 来 源 于Cupriavidus necatorN-1 的NAD 依赖的甲醇脱氢酶(Mdh2),该酶来源于革兰氏阴性菌,可产生NADH,对甲醇的亲和力明显高于B.methanolicus,且不依赖于内源激活蛋白,特异性较强;随后,作者通过多轮易错PCR 构建Mdh2突变体文库,结合高通量筛选的方式,得到的Mdh2 CT4-1 对甲醇的亲和力比原先提高6 倍,Kcat/Km[L/(mol·s)]达到9.3(野生型为1.6),具有更好的催化活性和转化效率。Whitaker 等[66]2017 年在E.coli中分别引入来自革兰氏阳性菌B.stearothermophilus的BsMdh和B.methanolicus的BmMdh2,发现BsMdh具有更强的甲醇转化能力,通过体内实验表明BsMdh 的活性大约为16 mU/mg,而BmMdh2 的活性仅为8 mU/mg。此外,David R.Liu 实验室[67]利用噬菌体辅助的非连续进化的方式筛选BmMdh2 突变体,最终得到的BmMdh2 Q5L-A164P-A363L 突变体活性提高了3.5 倍,Kcat/Km[L/(mol·s)]达到1.08(野生型为0.23),但是低于CnMdh2 CT4(4.77);随后,作者进一步通过体内同位素标记实验证明,在该酶的作用下,经过13C 标记的甲醇进入中心碳代谢的比例高于对照菌株(BmMdh wt、CnMdh2 CT4-1)2 倍多,说明虽然突变体活性低于Mdh2CT4-1,但是体内的甲醇利用率明显提高。
1.1.3 甲醛的氧化
甲醛是甲醇和甲烷作为C1底物进入中心代谢进行生物合成的中间代谢物,高浓度甲醛会抑制细胞生长,因此高效的甲醛代谢系统可以促进细胞对甲醇和甲烷的利用。大多细胞具有自身的甲醛氧化酶(formaldehyde dehydrogenase,FADH),可氧化甲醛形成甲酸,再经由甲酸脱氢酶形成CO2,完成甲醛代谢,促进微生物有效脱毒[61]。根据所需的辅助因子,FADH 可分为4 类:①需要NAD 作为辅助因子,包括仅以NAD 作为辅因子的FADH[68]、NAD-GSH 双 辅 因 子FADH[57,69]、NAD-硫醇依赖性FADH[70];②不需要辅因子,可直接氧化甲醛;③细胞色素辅助的FADH(如PQQ-FADH),该类FADH 通常不是甲醛特异性酶,源自甲基营养菌,活性较低[70];④四氢叶酸(tetetrahydrofolate,THF)、四氢甲氨蝶呤(tetrahydromethanopterin,H4MPT)作为辅助因子,该途径是最常见的甲醛氧化途径,广泛存在于多种甲基营养菌中。此过程中,以THF 或H4MPT 作为辅因子的微生物,甲醛经过亚甲基-THF(H4MPT)-脱 氢 酶[methylene-THF(H4MPT)dehydrogenase,Mtd]、亚甲基-THF(H4MPT)-环化酶[methenyl-H4MPT cyclohydrolase,Mch],分别形成带有THF和H4MPT 的甲酰基化合物;前者经过甲酰-THF合成酶(formyl-THF synthase,Fhs)形成甲酸;后者经过甲酰-H4MPT 转移/水解复合体[formyl-THF(H4MPT)transferase/hydrolase-complex, Fhc]形成甲酸[70]。总之,由于甲醛毒性对微生物正常生长的影响,其体内均形成多种代谢甲醛的形式,为C1底物的生物利用提供了更多有效的研究策略。
1.1.4 甲酸的氧化
甲酸脱氢酶(formate dehydrogenase,FDH)广泛存在于多种微生物中,可氧化甲酸为CO2,是细胞脱毒的最后一步,也是C1底物异化途径的最后一步。目前发现的甲酸脱氢酶可利用THF、NAD、NADP[71]、细胞色素等作为辅助因子,所生成的NADH或NADPH 可用于细胞其他的生命活动;以THF 作为辅因子的甲酸营养菌,通过rACoA途径即可实现微生物利用甲酸进行生长。
1.2 天然甲基营养型微生物的代谢途径
1.2.1 RuMP和XuMP途径
RuMP、XuMP 虽然存在于不同类型的甲基营养型微生物中,但本质上十分相似,都是甲醛结合五碳糖进行碳原子重排,一碳分子经由糖酵解途径完成碳流向下传递的过程,而五碳糖再生保证循环持续运转[61]。前者利用5-磷酸核酮糖(ribulose 5-phosphate,Ru5P)作为底物,甲醛经由己糖磷酸合成酶(hexulose phosphate synthase,HPS)转变为6-磷酸己酮糖(hexulose 6-phosphate,H6P)后,再通过磷酸己糖异构酶(phosphohexulose isomerase,PHI)转变为6-磷酸果糖(fructose-6-phosphate,F6P)进入中枢碳代谢。后者利用5-磷酸木酮糖(xylulose 5-phophate,Xu5P)作为底物,二羟丙酮合成酶(dihydroxyacetone synthase,DAS)可将甲醛和Xu5P 转变为3-磷酸甘油醛(glyceraldehyde-3-phosphate,G3P)和二羟丙酮(dihydroxyacetone,DHA),DHA 可利用二羟丙酮激酶(dihydroxyacetone kinase,DHAK)进一步转化成DHAP,从而进入中心代谢。
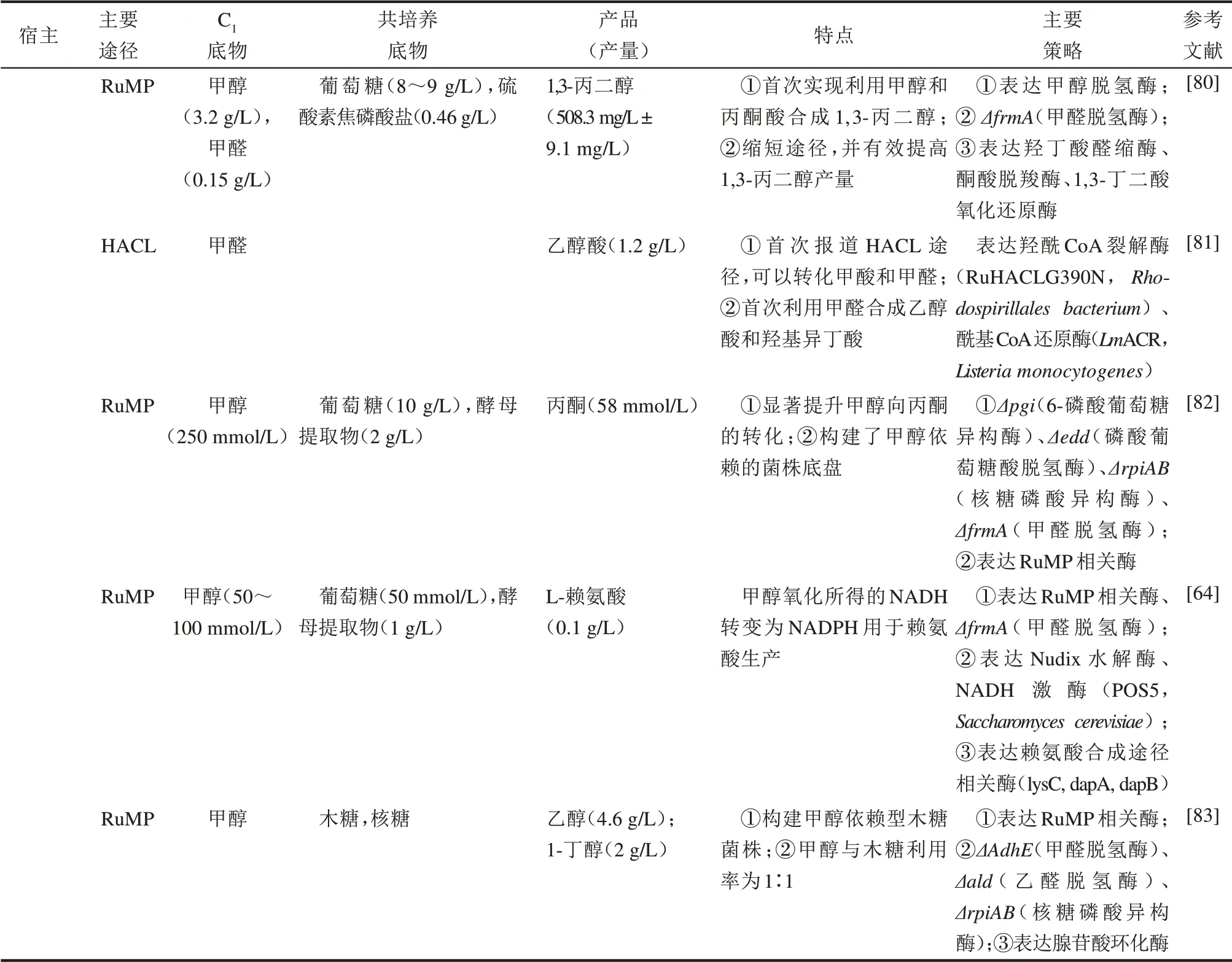
RuMP途径中,3 mol甲醛形成1 mol丙酮酸时,伴随G3P、Xu5P 和4-磷酸赤藓糖(erythrose-4-phosphate,E4P)的形成;此外,已有研究报道,B.methanolicus[72]和P.pastoris[73]中均 存 在两 种酶,1,7-双磷酸景天庚糖酶(sedoheptulose 1,7-bisphosphatase,SBP) 和 转 醛 酶(transaldolase,TAL),前者可将1,7-双磷酸景天庚糖转变为7-磷酸景天庚糖(sedoheptulose-7-phosphate,S7P),后者将F6P 和E4P 转变为S7P 和G3P;S7P 和G3P 经由转酮酶(transketolase,TKL)重新转变为Xu5P 和5-磷酸核糖(ribose 5-phosphate,R5P),从而完成五碳糖的再生循环。因此,将磷酸戊糖途径(pentose phosphate pathway, PPP) 与RuMP 或XuMP相结合,加速五碳糖的再生,是提高C1底物利用率的常用策略,如Bennett等[74]通过表达多个PPP途径的酶提高内源Ru5P的含量,详见表2。

表2 合成甲基营养型细胞工厂及其产物Tab.2 Chemicals produced by synthetic methylotrophs
续表
XuMP 途径是甲醇酵母的主要甲醇代谢途径,其中涉及的AOX、CTA 及DAS 均定位在过氧化酶体中,DAS 活性可被葡萄糖抑制,被甲醇所诱导[57]。由于甲醇酵母中,甲醇代谢主要发生在过氧化物酶体中,区室化作用有利于降低甲醛毒性,可显著提高化合物产量,如番茄红素[84]。当前,P.pastoris已被用于多种化合物和蛋白质的生物合成(表1),如洛伐他汀[20]、透明质酸[17]等;关于汉逊酵母的研究较少,如利用汉逊酵母生产青霉素[22]。最近,大连化物所的周雍进研究组[85]开发了高效的汉逊酵母基因编辑工具,能够有效提高其同源重组效率,并利用其进行脂肪醇的生物合成研究。
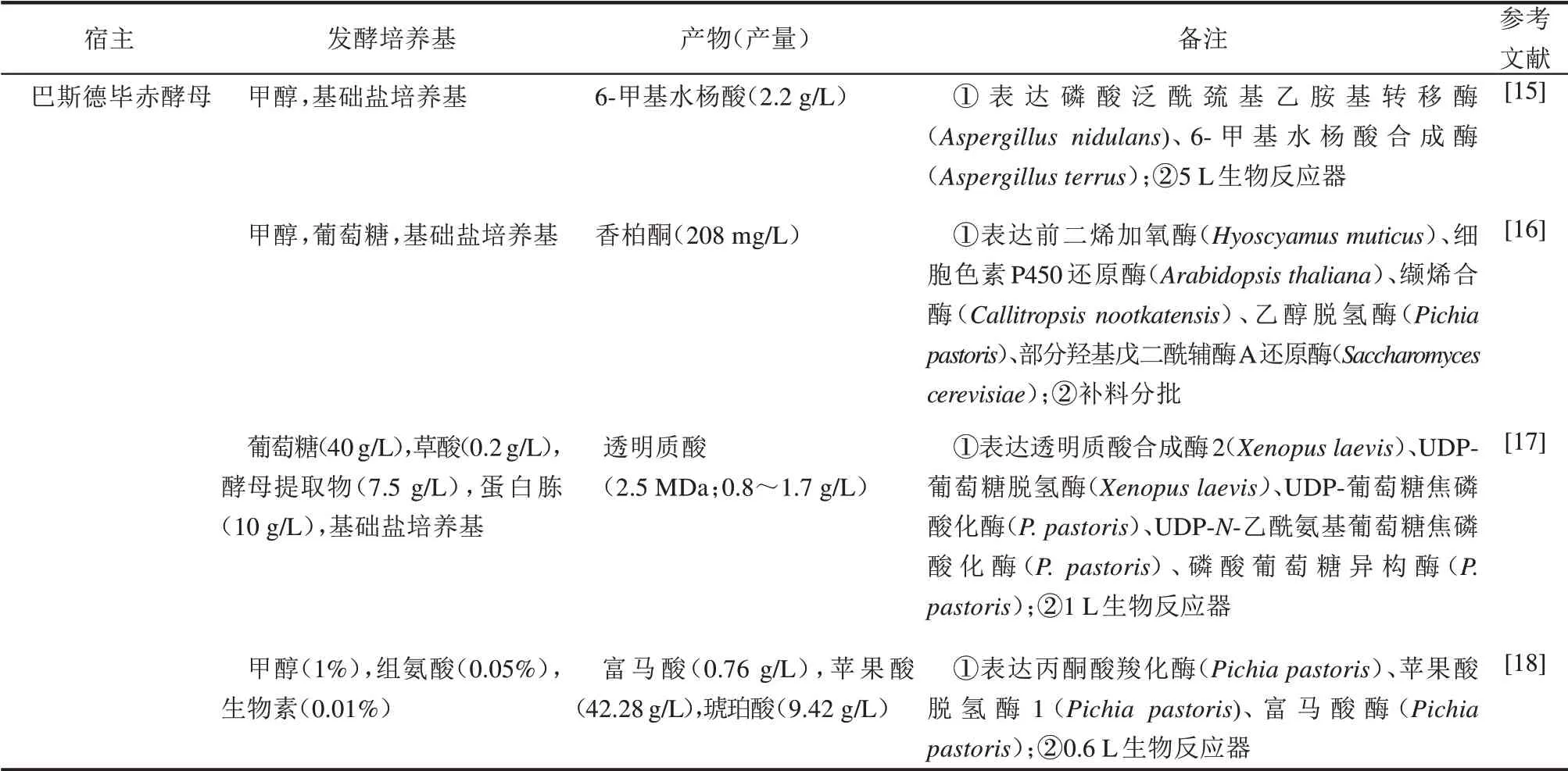
表1 天然甲基营养型细胞工厂及其产物Tab.1 Chemicals produced by native methylotrophs
1.2.2 Serine途径和GLRP途径
广义的丝氨酸途径主要包括3 个部分:第1 部分是以C1化合物(甲烷、甲醇或甲醛)起始,经过多级氧化反应,形成亚甲基-THF(CH2-THF)的中间产物。第2 部分是以甘氨酸(C2)起始,结合1 分子CH2-THF,形成丝氨酸(C3),C3化合物经过一系列转化后,形成磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP),随后羧化引入1 分子CO2,形成C4化合物草酰乙酸(oxaloacetate,OAA),OAA 经过苹果酸脱氢酶转变为苹果酸(C4)(malate,MAL)。经过上述两部分后,完成两种C1化合物的利用。第3部分主要是乙醛酸的再生过程。MAL在苹果酸硫激酶(malate thiokinase,MTK)的作用下,形成苹果酸单酰-CoA。随后苹果酸单酰-CoA 被分解为C2化合物乙醛酸和乙酰CoA,乙醛酸经过丝氨酸-乙醛酸氨基转移酶(serine glyoxylate aminotransferase,SGA)形成甘氨酸,从而构成完整的丝氨酸循环[11]。
细胞中,乙酰CoA 参与多种生命活动,而经典的乙醛酸循环[86]可以利用乙酰CoA 和OAA 作为底物,经过柠檬酸合酶(citrate synthase,CS)、顺乌头酸酶(aconitase,AT)和异柠檬酸裂解酶(isocitrate lyase,ICL),再生成琥珀酸和乙醛酸。但是,部分甲基营养菌(如M.extorquens)中缺乏异柠檬酸裂解酶,乙醛酸的再生是通过乙基丙二酰CoA 途径(ethylmalonyl-CoA,EMC)完成的,该途径也被称为GLRP[11,86]。EMC 途径不仅存在于天然甲基营养菌中,部分非甲基营养菌也拥有该途径,如红杆菌(Rhodobacter)和链霉菌(Streptomyces)。该途径大约有10 步反应,中间产物涉及C2、C3、C4化合物,包括多种独特的辅酶A中间体,可用于多种工业化合物的生产[87],如聚羟基烷酸酯(polyhydroxyalkanoate,PHA)、3-羟基丁酸(3-hydroxybutyrate,3-HB)[30]、3-羟基丙酸(3-hydroxypropionic acid,3-HP)[36]等,见表1。
1.2.3 rACoAP途径
许多天然的甲酸和甲烷营养菌中均存在还原型乙酰CoA 途径,即Wood-Ljungdahl pathway,该类菌株可以利用甲酸作为唯一碳源和能源进行生长。该途径中,以THF 作为辅助因子,甲酸转变为CH2-THF 后,可以进一步转化为5-甲基-THF。随后,结合CO 和CoA 直接形成乙酰CoA,乙酰CoA 在丙酮酸合酶(pyruvate synthase,PC)的作用下,羧化结合1 分子CO2,最终形成丙酮酸[88]。在此过程中,不仅可以利用甲酸,同时可以结合2分子CO2(CO 可来源于CO2),具有充分的一碳利用能力。能量方面,虽然该过程第1步(甲酸转化为甲酰-THF)需要消耗1分子ATP,但是随后可产生NADPH 用于后续能量供应。目前,已有研究报道利用该途径进行香叶醇的生物合成[53]。
1.2.4 CBB途径和rPPC途径
存在另一种广义的CBB循环,又称为还原型磷酸戊糖循环(reductive pentose phosphate cycle,rPPC),是甲酸营养菌(Cupriavidus necator)[8]和少数甲烷营养菌[89]的另一种固碳形式。甲酸氧化形成CO2后,结合1,5-二磷酸核酮糖(ribulose-1,5-bisphosphate,RuBP)在1,5-二磷酸核酮糖羧化/加氧酶(ribulose-1,5-bisphosphate carboxylase/oxygenase,RuBisCo)的作用下,转变为G3P进入中心碳代谢途径。但是,该途径需要消耗过多的还原力和ATP,既不经济,也不利于微生物生长[88]。最近有研究报道,在P.pastoris中引入RuBisCO 和磷酸核酮糖激酶(phosphoribulokinase,PRK),首次实现天然甲醇酵母利用CO2作为唯一碳源即可生长[90]。
2 合成甲基营养型微生物的代谢网络
天然的甲基营养型微生物具有丰富的C1代谢酶和代谢途径,理论上,据此构建下游的生物合成途径,即可实现微生物利用C1底物作为唯一的碳源和能源支撑生长并高产目标化合物。但是,由于天然的甲基营养型微生物存在数据库资源和遗传信息不完善、基因编辑工具缺乏与产物转化率低下等问题,使C1底物大规模应用于工业生产这一目标至今没有实现。因此,结合天然甲基营养型微生物中发现的C1代谢途径,如RuMP、丝氨酸途径,赋予模式微生物对C1化合物的高效利用能力,从头构建合成型甲基营养微生物,并实现目标化合物的高产,逐渐成为研究热点。此外,近几年的研究中,通过计算机设计全新的酶蛋白,打造人造C1代谢途径,亦成为高效利用C1底物的又一有效策略。当前,大多数研究均在E.coli当中开展,仅有少量研究以C.glutamicum和S.cerevisiae作为研究对象,研究的主要内容包括两个:①以C1底物作为唯一碳源和能源支撑微生物快速生长,涉及的C1底物为甲醇、甲酸和CO2;②高效利用甲醇和CO2(甲酸辅助)进行生物合成。因此,本部分概括了上述3种模式生物作为研究对象,针对两个主要研究内容,所进行的代谢网络构建和生物合成探究。
2.1 大肠杆菌
目前,E.coli是研究最深入的原核模式生物,多种C1底物(甲醇、甲酸、CO2)的生物利用已经在E.coli中陆续开展。其中,关于甲醇的研究成果最为丰富,涉及代谢途径的挖掘、代谢底盘的改造与优化、共培养底物的优化、生物合成化合物等多个方面,并且已有研究报道E.coli可以利用甲醇作为唯一碳源和能源正常生长[91]。关于甲酸和CO2的研究成果相对较少,研究侧重于甲酸或CO2的充分利用、已知代谢途径的改造及新途径的挖掘[92],当前已经实现E.coli可以利用甲酸[93]或CO2[94-95]作为唯一碳源生长,但是生长情况较弱,有待进一步提高。
2.1.1 甲醇
工程化改造E.coli,形成合成型甲醇营养菌的研究策略可以分为两种:引入天然甲醇利用通路和打造全新的甲醇代谢途径。前一种主要是通过引入或塑造天然存在的甲醇利用途径(如RuMP、XuMP),结合代谢底盘的辅助改造,代谢流微调,底物和发酵条件优化,目标产物合成途径的构建等,最终实现E.coli能够在含有甲醇的培养基中生长并合成目标产物;后一种主要是结合计算机辅助设计和蛋白质工程,发现能够提升甲醇代谢能力或缩短已知代谢途径的酶,从而打造全新的甲醇代谢途径,弥补天然途径中的不足,以期实现更高的甲醇利用效率,包括甲醇缩合循环(methanol condensation cycle, MCC)、 甲 醛 酶途径(formolase,FLS)、合成型乙酰CoA 途径(synthetic acetyl-CoA,SACA)、羟酰辅酶A裂解酶途径(2-hydroxyacyl-CoA lyase,HACL)、修饰丝氨酸循环(modified serine cycle,MSC)(图2)。

图2 合成C1利用途径Fig.2 C1 metabolic networks of synthetic methylotrophs
天然甲醇利用途径在前面已经有详细的介绍,不再赘述。当前,大量研究聚焦于整合RuMP 于E.coli中,以期实现E.coli利用甲醇作为唯一碳源和能源支撑微生物生长;2015 年的研究通过在E.coli中整合多种不同来源的RuMP 中的关键基因,发现来源于B.methanolicus菌株的MDH2、HPS、PHI能够更好地利用甲醇[63];2018 年的研究表明,通过增强甲醛的消耗,降低TCA 代谢,减少NADH 的产生可以促进甲醇利用[96];随后,通过在E.coli中加入甲醛感应元件,降低NADH 的产生,并加强Ru5P 的再生,进一步提高甲醇的利用[97];2020 年8 月,Liao 团队[91]发表在Cell上的文章,首次实现了甲醇作为唯一碳源支持E.coli生长,并且在8.5 h 中OD 值可达到2。上述研究从“零”到有实现了E.coli利用甲醇作为唯一碳源支撑微生物生长的能力。此外,已有众多研究报道E.coli利用甲醇(葡萄糖或酵母提取物作为辅助碳源)进行生物合成,对底盘的改造均以RuMP途径为基础,包括柚皮素、乙醇、丙酮、琥珀酸、赖氨酸等,见表2,但是均未实现甲醇作为唯一碳源。值得关注的是,2018年Nature Communications首次报道了基于MSC 构建合成型甲醇营养菌生成乙醇,此前大多改造均利用RuMP途径,因而该文章是天然甲醇利用途径的应用突破[79]。
最早的合成途径来自Liao 实验室的MCC 途径,其将非氧化糖酵解(nonoxidative glycolysis,NOG)途径和RuMP 途径结合,利用体外无细胞体系实现甲醇的利用。该途径中,F6P或X5P可通过一步反应直接生成乙酰磷酸,随后转化为乙酰CoA,不仅避免丙酮酸脱羧所造成的碳损失,同时减少ATP 的消耗;但是至今没有研究报道该途径在体内的应用情况。随后,美国David Baker 实验室设计并人工合成了以甲醛酶为核心的FLS 途径,仅通过2 步即可实现甲醛到二羟丙酮磷酸(dihydroxyacetone phosphate,DHAP)的转化(消耗1 分子ATP),而RuMP 途径中从甲醛到DHAP需要4步反应,因而该反应极大缩短了C1底物进入中枢代谢的步骤;同时,此途径可以甲酸作为底物,经过乙酰CoA 合成酶(acetyl-CoA synthase,ACS)和乙醛脱氢酶(acetaldehyde dehydrogenase,ACDH)转变为甲醛,过程中需要消耗1 分子NADH[98]。2019 年报道了两条合成途径,一条来自天津工业生物技术研究所江会峰团队[99]报道的SACA 途径,通过计算设计合成的乙醇醛合成酶(glycolaldehyde synthase,GALS)、乙酰磷酸合成酶(acetyl-phosphate synthase,ACPS)可以通过三步反应快速转化甲醛为乙酰CoA,不需要消耗ATP、无碳损失,可惜的是文章中仅在体外实验中验证了该途径的作用,而在E.coli中没有明显的甲醇利用效果;另一条途径来自美国Ramon 实验室所设计的HACL 途径,该实验室筛选两种酶,RuHACL和酰基辅酶A还原酶(acyl-CoA reductase,ACR),首次实现C1化合物甲醛至C2化合物乙醇酸(glycolate)的转变,该途径同样可用甲酸为底物,经由甲酰CoA转变为甲醛[81]。
2.1.2 甲酸和二氧化碳
目前,E.coli主要是通过还原型甘氨酸途径(reductive glycine pathway,rGlyP)利用甲酸和CO2,仅有少量研究借助CBB循环实现一碳物质的转化。首先,rGlyP 可以利用甲酸和CO2两种C1化
合物,代谢途径整体结构与rACoAP 类似,同样是借助THF 作为辅助因子,通过引入THF 循环,从而实现甲酸和CO2的利用[8]。该途径有3 个优点:①仅通过一个酶,甘氨酸裂解酶复合体(glycine cleavage system,GCS)即可完成中间产物CH2-THF向C2甘氨酸的转化,而rACoAP涉及众多辅助酶且许多至今未知。②与丝氨酸途径和CBB 途径相比,该途径更加经济节能,具有高效的甲酸利用能力;该途径产生1 分子乙酰CoA 需要消耗6 分子甲酸,而前两者分别需要11 分子甲酸和7 分子甲酸[8]。③该途径的中间产物(甘氨酸、丝氨酸)与中心代谢关联较少,不像rACoAP(乙酰CoA)和丝氨酸途径(苹果酸、乙醛酸等)的中间产物与多种代谢有密切联系,因而可以避免考虑复杂的代谢流。2018年,Arren Bar-Even实验室[100-101]通过在E.coli中构建rGlyP,在体内证明了该途径可以利用C1底物支撑微生物生长。同年,Lee Sang Yup实验室[102]在E.coli中引入rGlyP 和FDH(Candida boidinii),首次实现了E.coli仅利用甲酸和CO2即可轻微生长(不需要添加葡萄糖)。2020 年先后发表了两篇文章,通过引入不同来源的酶构建rGlyP,引入不同来源的FDH 达到提供能量和还原力的作用,均实现了E.coli利用甲酸作为唯一碳源支撑微生物生长;2020年初的文章中,利用ALE实现改造菌株在甲酸和CO2中生长的倍增时间不到8 h,生物量达到2.3 g CDW/mol 甲 酸[93];Lee Sang Yup 实 验室[103]2020 年中所发表的文章是2018 年工作的延续,作者进一步对底盘进行改造,引入多种来源的FDH 并调整胞内细胞色素泛素氧化酶(bo3、bd-I)的表达水平,最终菌株仅以甲酸和CO2作为碳源,OD 能够在450 h 达到7.38(1.3 L 发酵罐)。关于利用CO2作为主要碳源的研究较少,现有的两篇通过在E.coli中引入CBB 循环固定CO2;2016 年Ron Milo实验室首次实现E.coli利用CO2(丙酮酸作为辅助底物)合成中枢代谢的各种糖类物质,此时能量部分由丙酮酸所介导的TCA循环所提供[94];2019年,该实验室利用CO2和甲酸一起作为底物,结合ALE,最终实现E.coli利用CO2作为唯一碳源支撑生长的目的,此时由甲酸氧化提供能量[95]。
此外,研究发现了几种人工改造的合成型甲酸和CO2利用途径,目前关于这些途径的研究多聚焦于体外研究,没有被大量应用于生物合成。大致可分为3类:
(1)甲酸和CO2作为共同底物 包括丝氨酸-苏氨酸循环(serine-threonine cycle,STC)、丙酮酸-甲酸裂解酶(pyruvate formate-lyase,PFL)-苏氨酸循环(PFL-threonine cycle,PTC)、酮丁酸-甲酸裂解酶(ketobutyrate formate-lyase,KBFL)循环(KBFL cycle,KBFLC)。其中,STC 类似与丝氨酸循环,THF 作为辅助因子,利用甲酸和固定CO2的方式与之相同,不同点在于OAA 裂解形成天冬氨酸而不是MAL;PTC 循环中甲酸的利用方式不同于STC 循环,不需要THF 作为辅助因子,甲酸和乙酰CoA 在PFL 的作用下直接形成丙酮酸;KBFLC 不同于上述途径,丙酰-CoA 和甲酸在KBFL 的作用下2-酮丁酸,随后固定无机碳源,终产物为乙醛酸(图3)。

图3 合成甲酸利用途径Fig.3 Synthetic metabolic networks for formate utilization
(2)仅利用甲酸作为底物 如PFL-磷酸转酮酶(phosphoketolase,PKT)循 环(PFL-PKT cycle,PPC),该途径中,PKT 转化Xu5P 为酰基磷酸和G3P,酰基磷酸可以转化为乙酰CoA,从而和甲酸在PFL 的作用下形成丙酮酸;此外,甲酸可还原为甲醛,从而通过RuMP、FLS途径代谢。
(3)仅以CO2作为底物 巴豆酰基CoA-乙基丙二酰CoA-羟基丁酸酰基CoA(crotonyl-CoA/ethylmalonyl-CoA/hydroxybutyryl-CoA,CETCH) 循环[104]。由于甲酸和CO2之间的相互转化关系,赋予了上述途径更加丰富的利用空间。
2.2 谷氨酸棒状杆菌
目前,关于C.glutamicum的C1利用研究主要聚焦于甲醇的代谢。2013年Bott实验室[105]研究发现,C.glutamicum内源存在甲醇转化为CO2的一系列酶,乙醇脱氢酶(alcohol dehydrogenase,ADHA)可以催化甲醇转变为甲醛,甲醛可由乙醛脱氢酶(acetaldehyde dehydrogenase,ALD)或以硫醇作为辅因子的FADH(adhE)转变为甲酸,随后甲酸经内源FDH(fdhF)转变为CO2;该文章首次完整展示了C.glutamicum中甲醛脱毒的所有基因,为后续的改造研究奠定了基础。随后的研究中,通过敲除adhE和ALD,阻断C.glutamicum中甲醇至CO2的转化途径,并引入RuMP,以葡萄糖或核糖辅助甲醇利用,利用甲醇合成尸胺[75];以木糖和甲醇作为主要碳源,生物合成谷氨酸[76-77];2020年孙际宾团队[76]通过适应性进化,将菌株所耐受的甲醇浓度提高到15 g/L,且甲醇与木糖利用率为7.04∶1;大大提高了甲醇的利用效率。但是,截至目前,并没有研究实现C.glutamicum以甲醇作为唯一碳源和能源支撑其生长。
2.3 酿酒酵母
作为真核模式生物,S.cerevisiae具有详细的基因信息,完善的数据库和多样的基因编辑工具,被广泛应用于细胞工厂的构建。由于S.cerevisiae本身对甲醇和甲醛具有更高的耐受性[106],因此S.cerevisiae在C1的生物转化中具有广阔的应用前景。当前,仅有少量文献报道了关于合成型“甲醇酵母”的研究,研究内容停留在S.cerevisiae的菌株选择和生长两个方面,没有实现任何一种C1化合物作为唯一底物原材料即可支撑微生物正常生长目的。南京工业大学姜岷实验室[107]首次在S.cerevisiae中引入RuMP 和XuMP,赋予其对甲醇的利用能力,但是其在甲醇当中的生长能力有待提高。澳大利亚的Paulsen 实验室[108]结合转录组学数据,对比了两类常见的酵母品系(CEN.PK 和S288C)在甲醇当中的生长情况,发现CEN.PK 更适合用于构建合成型“甲醇酵母”。随后,Paulsen实验室[109]发表在Nature Communications 的研究,通过对S.cerevisiaeCEN.PK113-5D 进行适应性进化,发现其具有天然的甲醇利用能力,进化后可在含有甲醇和酵母提取物的培养基中生长。此外,Arren Bar-Even 实 验室[110]研究 表明,rGlyP 在S.cerevisiae中具有很强的甲酸代谢能力,该研究首次报道了S.cerevisiae通过rGlyP 利用甲酸和CO2。因此,根据已有的C1 代谢途径重构S.cerevisiae代谢底盘,并结合ALE,能够进一步发掘其对C1底物的利用潜力[111]。
3 结语
本综述总结了基于天然和合成型甲基营养型微生物利用C1底物进行生物合成的主要代谢网络及现有产品。已发掘的天然甲基营养菌大多直接利用甲醇或CO2作为C1底物,通过自身所具有的一磷酸核酮糖途径、丝氨酸途径和还原型乙酰CoA途径,完成C1底物向中枢代谢的转运,产物主要为氨基酸类(如丝氨酸、赖氨酸、谷氨酸等)、PHA 或PHB;天然甲醇酵母主要利用一磷酸木酮糖途径,产物除了氨基酸和小分子有机酸,还有他汀类药物。虽然天然甲基营养型微生物能够高效利用C1底物,但是缺乏完善的基因组信息和基因编辑工具,因而在进一步提升底物利用率、目标物产量及产物转化率方面,都具有较大的困难。当前,随着高通量测序和多组学技术的发展,针对已被广泛应用的天然甲基营养型微生物建立数据库,提供更加全面和丰富的基因信息,可以有效提高其生物合成的应用范围;此外,基于天然甲基营养型微生物开发高效的基因编辑工具,提高菌株自身的同源重组效率,可以有效增加其用于生物合成的操作可行性。近年来,关于毕赤酵母的基因信息和数据库资源日渐丰富,已有多项研究聚焦于优化毕赤酵母的基因编辑方法,如开发高效的CRISPRi(clustered regularly interspaced short palindromic repeat interference)系 统[112-113];敲除Ku70(ATP 依赖的DNA 解旋酶)[114]、引入Rad52(DNA修复蛋白)提高非同源重组效率[115];此外,针对天然甲基营养菌的基因编辑手段也逐渐增多,如优化CRISPRi系统中dCas9 启动子[116]、开发sRNA(small regulatory RNA)系统用于抑制基因表达[117-118]。合成甲基营养型微生物能够弥补其在基因编辑上的不足,但是却存在C1底物利用效率低的问题,导致微生物不能以甲醇或CO2作为唯一碳源和能源快速生长。当前,虽有少量研究实现E.coli利用甲醇或CO2进行生长,但是距离产物合成及工业化应用还有较远的距离。目前,合成型甲基营养微生物的研究策略主要依赖于代谢底盘的改造(如天然甲醇利用途径的引入)、打造全新的代谢途径(如还原型甘氨酸途径,甲醛酶途径)、关键酶的挖掘(如高效MDH 的筛选)、适应性进化(如葡萄糖、木糖等多底物偶联进化)等;最近的文章将纳米材料应用于CO2的固定,结合多条已有的C1利用途径,有效提高了CO2的转化效率,展示了纳米材料在生物转化研究中的应用前景[119],为未来的C1化合物的高效利用提供更有效的思路。
值得注意的是,两种类型的甲基营养型微生物都面临同样的问题,即底物毒性耐受性问题。多种C1底物,如甲烷、甲醇的代谢网络一脉相承,高度的相似性伴随而来的是甲醛毒性的问题,甲醛积累而引起的细胞毒性,是导致微生物不能正常生长的根本原因,也限制了甲基营养微生物底物利用率的提高[120]。因此加强细胞对毒性物质的代谢能力,或者提高细胞对毒性物质的耐受性,是实现C1底物高效利用的重中之重[121]。针对这一问题,目前的主要手段均为适应性进化,虽然能够在一定程度上提高微生物的甲醛耐受能力,但是所需时间较长,且现有研究均没有突破甲醛毒性所带来的生长限制;未来,利用多种诱变手段加快进化速度,加强对甲醛致毒机制的剖析,同时结合不同微生物自身的特点(如酵母的区室化效应)[122],是微生物突破生长瓶颈的有效途径。总之,充分提升C1底物利用率和目标产物转化率,以生物制造推动新型工业化改革,对世界经济的可持续发展具有重要意义。

