罗格列酮对脓毒症肺损伤患者血清炎症水平的影响
文晓旭 孟佳 明丹 孙爱慧
由于肺部感染等疾病不断增加,脓毒症在急诊救助过程中发生率亦具有升高[1-3]。由于机体全身严重感染、创伤等多种原因所导致全身的炎性反应,其炎症状态与预后存在明显的关联[4]。随着病情严重程度的进展,最终能够发展为脓毒症休克、器官功能衰竭等,并最终导致患者的死亡,故在临床工作中需给予足够的重视[5]。有研究报道称,该病所导致患者的总死亡人数超过其他类疾病,成为重症科室患者死亡的首因[6]。血清高迁移率族蛋白-1(HMGB1)和肿瘤坏死因子α(TNF-α)等均为机体重要的炎性因子并与疾病进展密切相关,有研究指出促炎和抗炎因子水平的异常会影响患者的预后,故其水平的变化能够为患者的预后提供借鉴意义[7]。罗格列酮能够促进机体脂联素等抗炎物质的表达,减少过强炎性反应引起的机体组织损伤进而保护患者的心肺系统和全身组织,最终提高患者治疗的疗效情况改善最终预后[2]。故本次研究试着探讨该药物的使用对患者炎症水平的影响。
1 资料与方法
1.1 一般资料 选取2014年9月至2016年9月在我院救治的脓毒症患者126例,随机分为对照组和观察组,每组63例。患者符合美国医学联席会给出的脓毒症定义[8],感染伴有:(1)体温改变(测定深部>38.3℃或者<36℃)、心率增快(>90次/min或者>正常值+2倍标准差)、呼吸增快、意识改变、出现水肿、出现无糖尿病史的血糖改变等;(2)炎症状态的改变,白细胞水平改变(>12 000 μl或者<4 000 μl)、幼稚细胞的异常(水平>10%)、炎性反应蛋白水平改变(>正常值+2倍标准差)、降钙素原水平改变(>正常值+2倍标准差);(3)血流情况改变,血压改变(收缩压降低值超过40 mm Hg或者<正常值-2倍标准差等);(4)器官功能改变,动脉血的血氧情况改变(氧分压/FiO2<300等)、尿量改变(尿量急性减少每千克体重<0.5 ml/h等)、肌酐异常增多、凝血出现改变(活化部分凝血活酶时间>60 s等);(5)灌注情况改变;(6)MEDS评分≤12分。在本研究中,病例资料的收集符合研究的伦理学标准,并获得患者及家属的知情同意。排除标准:患者没有临床感染症状,患者年龄<18周岁,患者不能完成随访,因故不能完成临床病例资料收集的患者,患有恶性肿瘤,心肌梗死等的患者,患者合并严重肝肾功能衰竭,患者出现不能够配合调查等影响研究的情况。
1.2 治疗方法 2组患者均进行全程监护、抗炎、补液等基础治疗,观察组患者在以上治疗措施的基础之上加用罗格列酮(葛兰素史克公司),2次/d,每次15 mg,治疗时间为2周[4]。对治疗前和治疗后2周对患者的生命体征、脏器功能和炎症指标水平进行比较。
1.3 检测指标 紫管抽取4 ml抗凝血使用发光免疫的检测方法主要检测指标Th1、Th2等细胞免疫指标;红管抽血3 ml不抗凝后2 500 r/min进行离心,离心2次,10 min/次,收集上清检测,即刻进行免疫等指标检测,如果不能即刻检测,则-70℃冰箱保存。HMGB1、IL-6、TNF-α等相关因子使用检测试剂盒进行检测,试剂盒均购买自上海煦达生物公司,所有检测操作均按照说明书进行,每组检测重复6次取平均值进行比较。
1.4 MEDS评分 该标准共有9项,其中包括基础疾病(转移癌等,则评分为6分);呼吸功能异常(呼吸>20次/min,血氧饱和度<0.9等,则评分3分);出现感染性休克(收缩压<90 mm Hg等,则评分为3分);血小板计数下降(评分3分);不成熟中性粒细胞(>0.05,则评分3分);年龄(>65周岁,则评分3分);出现下呼吸道感染(则评分2分);居住在疗养院(则评分2分);意识状态改变(格拉斯哥昏迷评分<15,则评分2分)[7]。
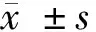
2 结果
2.1 2组患者一般资料比较 2组患者性别比和年龄比较,差异无统计学意义(P>0.05);观察组患者的MEDS评分为(8.5±3.3)分,较对照组评分(8.4±3.7)分,差异无统计学意义(P>0.05)。见表1。
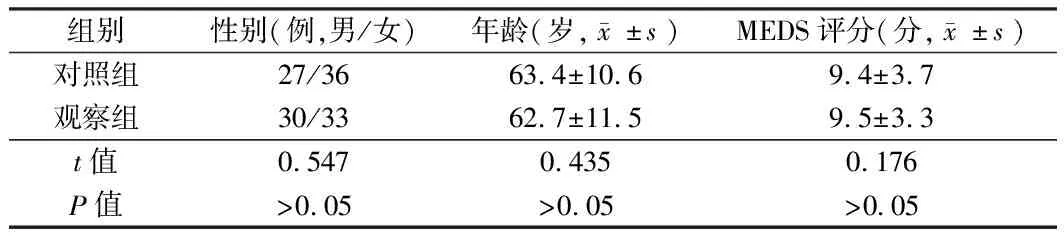
表1 2组患者一般资料比较 n=63
2.2 2组患者治疗前后生命体征比较 对2组患者治疗前后的生命体征急性比较发现,观察组患者治疗前后在体温、心率、呼吸等较对照组比较,差异均无统计学意义(P>0.05);观察组患者在治疗前收缩压的比较中,较对照组差异无统计学意义(P>0.05);而在治疗2周后的收缩压比较中,观察组患者的收缩压为(119.6±22.5)mm Hg,较对照组的收缩压(100.7±20.6)mm Hg明显升高,差异有统计学意义(P<0.05)。见表2。
表2 2组患者治疗前后生命体征情况比较
2.3 2组患者治疗前后炎症指标比较 2组患者在治疗前的HMGB1、IL-6和TNF-α的比较中,差异无统计学意义(P>0.05)。在治疗后2周,观察组患者的HMGB1的水平为(33.4±7.6)μg/L,较对照组患者的(64.7±9.2)μg/L,差异有统计学意义(P<0.05);观察组患者的IL-6水平为(148.5±17.7)ng/L,较对照组患者的(209.3±25.8)ng/ml,差异有统计学意义(P<0.05);观察组患者的TNF-α水平为(114.2±16.9)pg/ml,较对照组患者的(186.5±27.1)pg/ml,差异有统计学意义(P<0.05)。见表3。
表3 2组患者治疗前后炎症指标比较

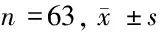
表4 2组患者治疗前后免疫功能和MEDS评分比较
3 讨论
随着该病患病率的不断升高,高死亡率和预后不佳逐渐引起临床医生的关注[1]。有研究指出,该病在发生进展过程中,炎性因子出现升高而免疫功能收到抑制。其中李真玉等[7]研究证实,在此类患者中白介素-6(IL-6)的水平存在异常,其是体内重要炎症促进因子,其大量释放和水平的升高能够直接的促进和激活机体炎性反应水平,进而引起炎症相关的肺组织损伤并导致患者呼吸窘迫和死亡,而且IL-6的水平与患者的预后存在密切的关系,预示着患者的病程进展并提高死亡等不佳预后的发生率。另有研究指出,肿瘤坏死因子α(TNF-α)等细胞因子对脓毒症的预后具有预警作用,该炎性因子水平的升高能够直接的激活单核-巨噬系统进而促进炎性反应[8]。HMGB1是相对晚期的炎症相关因子,其水平的升高能够直接结合晚期糖基化受体(RAGE),进而促进巨噬和淋巴细胞的各类因子分泌,导致机体更严重的损伤[9-11]。故该病的治疗过程应该关注患者的炎症相关因子水平,以控制炎性反应强度,进而保护机体组织改善患者的预后情况。

本研究亦有很多不足:(1)罗格列酮的使用仍需要大样本的研究支持;(2)促进炎症的相关因子被探讨,而抑制炎症的相关因子如IL-10未被讨论;(3)抗感染等其他药物的使用对患者的免疫状态亦存在影响,而这种影响在患者中存在异质性。

