解淀粉芽孢杆菌对三角褐指藻的化感作用研究
任国梁 董志国 , 李德盛 夏 青 柳佳玲 崔振权 梁夏菲
(1. 江苏海洋大学, 江苏省海洋生物资源与环境重点实验室, 连云港 222005; 2. 江苏海洋大学, 江苏省海洋生物技术重点实验室, 连云港 222005; 3. 江苏省海洋生物技术协同创新中心, 连云港 222005)
化感作用(Allelochemical)是植物或微生物向周围环境中释放化学物质进而影响到其他植物生长的一种克生作用[1—3]。三角褐指藻(Phaeodactylum tricornutum)是在海洋中广泛分布的一种优质硅藻饵料, 常被应用于虾、蟹、贝的苗种饵料[4—6]。解淀粉芽孢杆菌(Bacillus amyloliquefaciens)是一种重要的生防芽孢杆菌(Bacillus subtilis), 可分泌对多种真菌与细菌有抑制作用的化学物质, 如脂类抗生素、寡肽酶、抑菌蛋白类及一些细胞外物质等[7—10]。解淀粉芽孢杆菌被广泛应用于抑制病原菌等方面,如解淀粉芽孢杆菌BN-9对大肠杆菌具有抑制作用[11],解淀粉芽孢杆菌G1对痢疾病原菌具有拮抗作用[12],及对植物病毒如黄瓜花叶病毒(CMV)和甜瓜花叶病毒(MMV)的侵染等[13]。除了抑制作用, 有研究发现解淀粉芽孢杆菌FZB45具有肌醇六磷酸酶活性,可以在缺磷的条件下刺激植物生长[9]。而且解淀粉芽孢杆菌微胶囊无毒, 对养殖水体中的理化因子的影响也在常见水产养殖动物的安全浓度范围内, 因此被作为水产养殖中的水质改良剂而大面积应用[14]。近年来, 研究大型水生植物浸取液与微藻之间的化感作用日益增多[15—18], 但是在微生物尤其是解淀粉芽孢杆菌对海洋微藻的作用方面的研究相对较少。本文以海水中常见的硅藻饵料三角褐指藻为实验材料, 探究解淀粉芽孢杆菌及其分泌物对三角褐指藻的化感作用。
1 材料与方法
1.1 菌株获得及其代谢物的制备
供试菌株为解淀粉芽孢杆菌B5, 由本实验室从对虾养殖海水中直接分离、筛选、鉴定后备用。用种子培养基接种经发酵后的解淀粉芽孢杆菌制备种子培养液, 再用发酵培养基接种种子培养液制备发酵液。
种子培养基: 葡萄糖、磷酸氢二钾各2.5 g, 胰蛋白胨17 g, 氯化钠25 g, 蒸馏水1000 mL, 121℃, 灭菌0.5h。
发酵培养基: 玉米粉2.9 g, 豆饼粉12.5 g, 磷酸氢二钾1.5 g, 氯化钠27.6 g, 蒸馏水1000 mL, 121℃,灭菌0.5h。
发酵采用16 L发酵罐。发酵条件: 装液系数0.75, 初始pH 7.5, 接种量3%, 发酵温度31℃, 机械搅拌转速180 r/min, 通气量1.2 vvm, 发酵周期36h。
代谢产物获取方法: 取部分发酵产物在0.22 μm的微孔的条件下进行超滤, 得到解淀粉芽孢杆菌菌液和其代谢产物; 另一部分不经超滤, 为解淀粉芽孢杆菌液和代谢产物的混合液, 保存备用。
1.2 三角褐指藻培养条件
供试三角褐指藻藻种取自上海海洋大学藻种室。初始浓度为1×105cells/mL, 逐级扩培后于5 L锥形瓶中长期培养。自然海水取自江苏连云港周边海域, 经抽滤、灭菌后使用。光照培养箱参数设置为: 温度20℃, 光强63 μmol photons/(m2·s), 光暗比为12h∶12h。营养液为含硅的f/2培养液。每天定时取样且摇动培养瓶, 期间维持藻液pH在7.9—8.1。
1.3 三角褐指藻生长曲线的绘制
用血球计数板计数, 并换算长期培养藻液的浓度。稀释藻液, 使其浓度分别为原来的20%、40%、60%、80%和100%, 在663 nm波长处分别测量吸光值, 绘制藻密度与吸光度的线性标准曲线,为后续计算三角褐指藻细胞数提供参考。
1.4 解淀粉芽孢杆菌对三角褐指藻的化感作用
本次实验所用锥形瓶规格为250 mL, 使用前均经反复冲洗及高压灭菌处理。将处于对数生长期的三角褐指藻50 mL接种到200 mL新鲜培养液中,初始密度为每毫升1.83×106个(1.83×106ind./mL)。实验进行4d, 菌-藻共培条件同1.2。
实验设置对照组、实验组和空白组3个不同组别, 每处理三次重复。对照组只接种三角褐指藻(I组); 实验组分为3组, 每组先接种与对照组等量的三角褐指藻, 再分别接种数量级为109的解淀粉芽孢杆菌液(菌液组P+B)、解淀粉芽孢杆菌代谢产物(代谢物组P+M)、解淀粉芽孢杆菌液及代谢产物混合液(混合液组P+BM), 添加量分别为100、500和1000 μL; 空白组也分为三组, 不接藻种, 分别对应对照组添加相同剂量的解淀粉芽孢杆菌添加液。每天定时测量每组的吸光值, 计算三角褐指藻细胞浓度, 其中实验组藻细胞浓度计算时, 最终吸光值为对照组吸光值减去对应空白组的吸光值。
1.5 数据处理
抑制率公式:PI(%)=(1-N/N0)×100%。其中,N0和N分别为对照组三角褐指藻浓度和试验组三角褐指藻浓度;PI为抑制比例,PI=50%时对应的浓度为EC50。
数据用SPSS 23软件做显著性分析, 并进行Duncan多重比较, 以P<0.05作为差异显著水平。
2 结果
2.1 解淀粉芽孢杆菌菌液对三角褐指藻生长的影响
与对照组相比, 在前3天时P+B100、P+B500、P+B1000三组的生长率没有显著变化, 但是三角褐指藻的藻细胞数均低于对照组, 到第4天时藻细胞数显著低于对照组(P<0.05, 图1)。P+B100组抑制率呈现缓慢上升的趋势, P+B500与P+B1000两组在第1天时抑制率显著高于P+B100组, 到第2天有所下降, P+B100组抑制率在第3天开始大幅度增加,对应的藻细胞数增加速率放缓, P+B500组在第2至第3天抑制率显著增加, 所对应的藻细胞数最少(图2)。实验结束, P+B100、P+B500和P+B1000的三角褐指藻藻细胞数分别比对照组低28.52%、35.56%和22.36%。
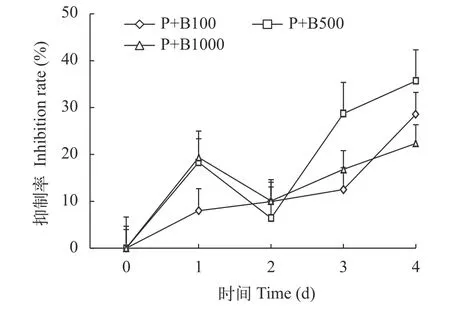
图2 添加解淀粉芽孢杆菌菌液组三角褐指藻抑制率Fig. 2 Inhibition rate of P. tricornutum added with B. amyloliquefaciens bacterial solution
2.2 解淀粉芽孢杆菌代谢产物对三角褐指藻生长的影响
在第1至第4天P+M100、P+M500和P+M1000三组藻细胞数均显著低于对照组(P<0.05), 到第3天P+M1000组藻细胞数与其他三组相比迅速降低, 表现出很好的抑制性, 随着解淀粉芽孢杆菌代谢产物添加量增加, 三角褐指藻生长率随之减少, P+M1000组在第3天发现藻细胞数降低的现象(图3)。P+M100、P+M500和P+M1000三组在第1天抑制率增长迅速,在第2至第3天3组抑制率的增长均放缓, 在第3至第4天P+M100和P+M500两组抑制率有所下降,P+M1000抑制率迅速升高(图4)。实验结束, P+M100、P+M500和P+M1000的三角褐指藻藻细胞数分别比对照组低11.80%、41.20%和56.69%。
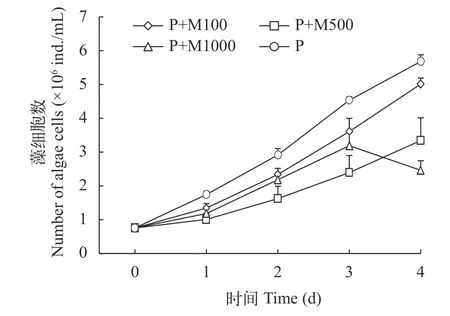
图3 添加解淀粉芽孢杆菌代谢物组三角褐指藻生长曲线Fig. 3 Growth curve of P. tricornutum with the metabolite group of B. amyloliquefaciens

图4 添加解淀粉芽孢杆菌代谢物组三角褐指藻抑制率Fig. 4 Inhibition rate of P. tricornutum in the metabolite group of B. amyloliquefaciens
2.3 解淀粉芽孢杆菌及代谢产物混合液对三角褐指藻生长的影响
与对照组相比, P+BM100、P+BM500和P+BM1000三组三角褐指藻均生长缓慢, 在第1至第2天P+BM1000藻细胞数呈下降趋势, P+BM100和P+BM500藻细胞数第1至第3天呈缓慢增长的态势,在第3至第4天则开始降低, P+BM1000组则明显低于其他三组(图5)。P+BM100、P+BM500和P+BM1000三组对三角褐指藻均表现出了较好的抑制性, 但都没有超过50%, 在第2天时P+BM1000组抑制率超过50%达到了51.32%。到第3天时P+BM500和P+BM1000两组对三角褐指藻的抑制率均超过50%, 分别达到了54.87%与65.05%(图6)。实验结束, P+BM100、P+BM500和P+BM1000三组的藻细胞数分别比对照组低了37.32%、54.93%和64.96%。
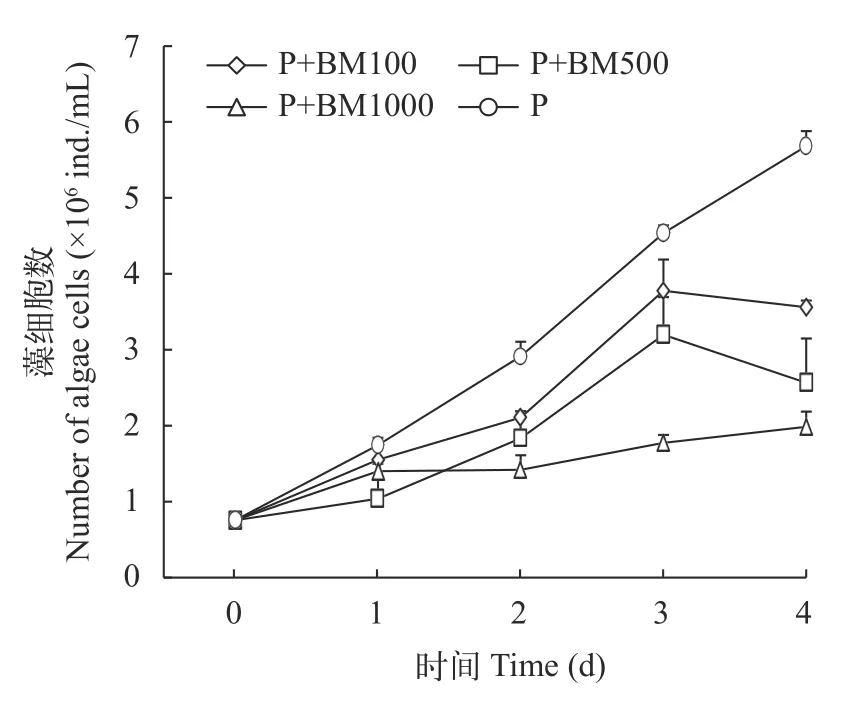
图5 添加混合液组三角褐指藻生长曲线Fig. 5 Growth curve of P. tricornutum with mixed solution group
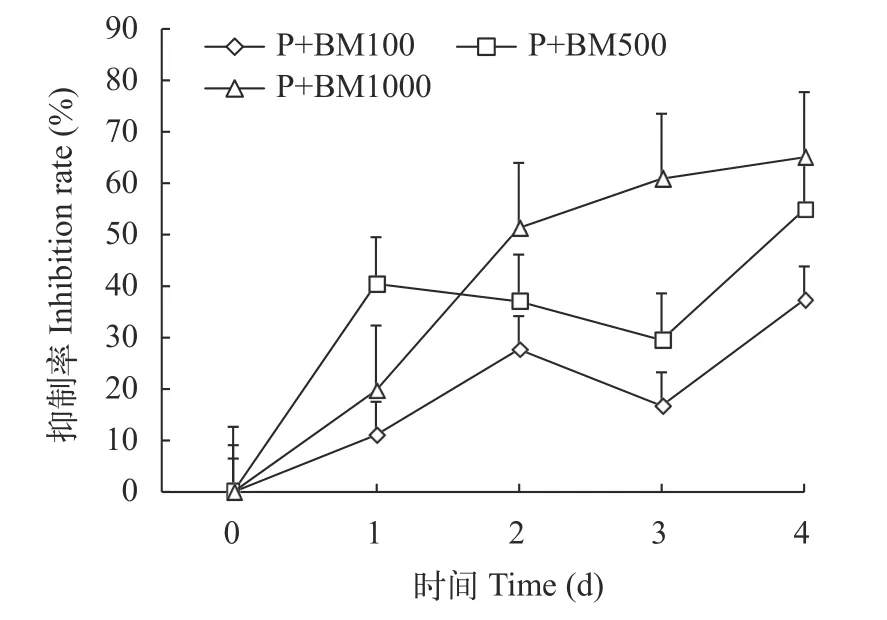
图6 添加混合液组三角褐指藻抑制率Fig. 6 Inhibition rate of P. tricornutum in mixed solution group
2.4 相同条件下不同添加物对三角褐指藻生长的影响
添加解淀粉芽孢杆菌菌液、代谢产物以及混合物三组三角褐指藻细胞数均低于对照组, 添加物的量的不同对藻细胞数的数量也有影响。除P+B100组外, 其余各组藻细胞数均随着添加物的量的增加而减少。添加物的量相同时, 除P+M100组外, 其余实验组均表现为解淀粉芽孢杆菌菌液、代谢产物、混合物依次减少的现象(图7)。而三者对三角褐指藻的抑制率则同三角褐指藻的藻细胞数相反(图8), 除P+B500组外, 其余实验组抑制率均随添加物的增加而增加, 且P+BM500、P+M1000和P+BM1000三组对三角褐指藻的抑制率均达到50%以上, 分别为54.87%、56.67%和65.05%。
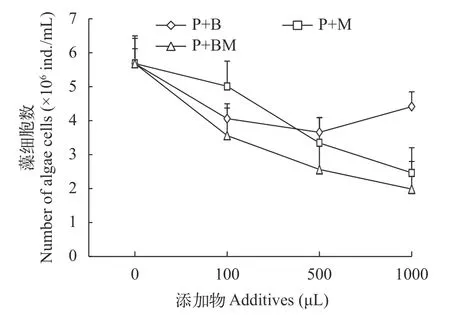
图7 添加不同物质组三角褐指藻细胞数Fig. 7 Number of P. tricornutum cells with different substance groups
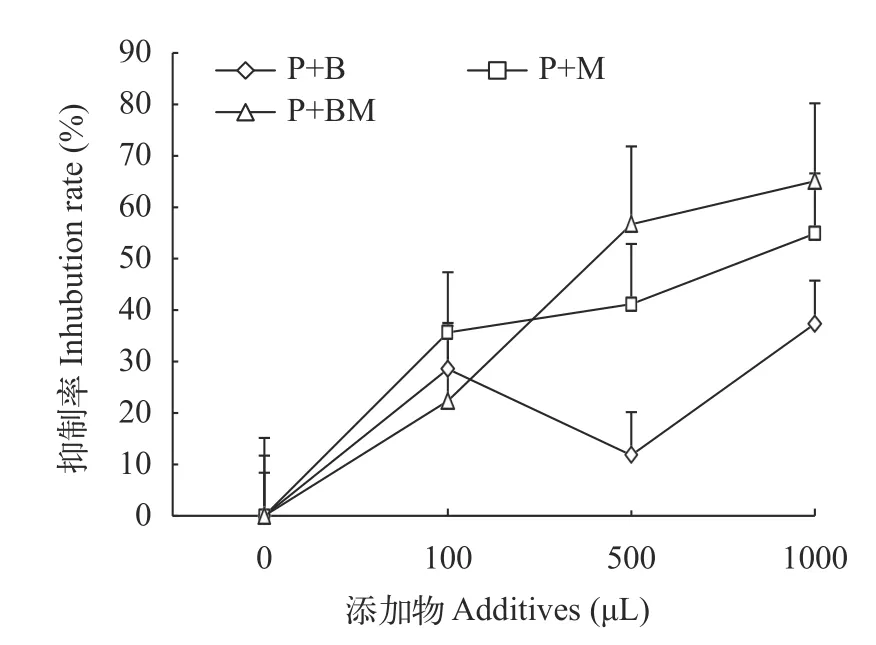
图8 添加不同物质组三角褐指藻抑制率Fig. 8 Inhibition rate of P. tricornutum with different substance groups
3 讨论
化感作用是植物或者微生物向周围环境中释放代谢产物从而影响与它临近的植物或微生物的生长[19]。研究表明, 水生植物与微生物之间的化感作用可以对水域生态系统的结构造成影响, 过去近30年中, 许多研究学者对“藻-菌”相互关系进行探索, “藻-菌”相互关系一直是海洋微藻研究方面的热点[20—24]。解淀粉芽孢杆菌作为一类重要的生防微生物, 不仅对植物生长具有促进作用, 其在生长过程中产生的代谢产物还可抑制藻类生长。朱芝秀等[25]在对解淀粉芽孢杆菌的研究中发现, 从鲫肠道分离得到一株解淀粉芽孢杆菌菌株JX001对嗜水气单胞菌具有较好的抑制作用。许波[26]在进行一株芽孢杆菌溶藻活性物质的分离及结构分析的研究中发现, 解淀粉芽孢杆菌A对铜绿微囊藻905A具有溶藻性, 同时发现T1芽孢杆菌是一株拥有高效杀藻作用的菌株, 具有较强的溶藻活性。李成果[27]研究发现, 芽孢杆菌的抑菌物质伊枯草菌具有抑制植物A病原菌孢子生长的作用, 解淀粉芽孢杆菌L3不仅对西瓜枯萎病发生具有防控作用, 同时对西瓜的生长具有明显的促生作用。本研究在实验室中探究了解淀粉芽孢杆菌及其代谢产物对三角褐指藻生长的影响。结果表明, 解淀粉芽孢杆菌、其代谢产物和两种混合液均表现出了抑制三角褐指藻生长的特性, 解淀粉芽孢杆菌对三角褐指藻的抑制作用不明显, 代谢产物和两种的混合液对三角褐指藻表现出了明显的抑制效果。
本研究在培养介质中, 添加解淀粉芽孢杆菌代谢产物组与添加混合液组明显抑制了三角褐指藻的生长, 说明解淀粉芽孢杆菌及其代谢产物有抑制作用且存在一个阈值, 在这个阈值之下, 存在着浓度效应, 浓度越高抑制作用越明显。这与于靓等的研究结果一致, 他们认为解淀粉芽孢杆菌T1所产生的溶藻活性物质在一定藻细胞数范围内, 抑藻效果随着T1无菌滤液浓度的增加而显著加强[28]。在同等的浓度下, 添加解淀粉芽孢杆菌组不如其他两组抑制作用明显, 添加混合液组与添加代谢产物组所显示出的抑制作用远强于添加解淀粉芽孢杆菌组,添加混合液组的抑制作用又比添加代谢产物组更强, 由此说明解淀粉芽孢杆菌与其代谢产物对三角褐指藻的抑制作用可以叠加, 二者同时存在时抑制效果最强。而这两组表现出的抑制效果没有特别大的差异。由此说明解淀粉芽孢杆菌代谢产物在对三角褐指藻产生的抑制效果中起主要作用。
综上所述, 解淀粉芽孢杆菌对三角褐指藻没有明显的抑制作用, 但其高浓度的代谢产物与两者混合液可有效的抑制三角褐指藻的生长, 并存在着一个阈值, 在这个阈值之下, 具有浓度效应, 浓度越高抑制效果越明显, 解淀粉芽孢杆菌与其代谢产物对三角褐指藻的抑制作用可以叠加, 二者同时存在时抑制效果最强。

