昼夜温差对三角褐指藻和赤潮异弯藻生长和叶绿素荧光特性的影响
李建安 王佳妤 梅熠辉 陈梅玲 周成旭 李亚鹤
(1. 宁波大学海洋学院, 宁波 315211; 2. 宁波大学食品与药学学院, 宁波 315211)
作为一种微型的光合生物, 海洋微藻是海洋主要的初级生产者[1], 在海洋生态系统中起重要的作用, 可用作浮游动物、养殖生物的饵料, 也可产生较高含量的初生及次生代谢产物, 但也有一些种类如中肋骨条藻(Skeletonema costatum)和赤潮异弯藻(Heterosigma akashiwo)等暴发性生长形成赤潮, 给海水养殖和旅游业带来一定的经济损失。众所周知, 微藻的生长受温度、光照强度和盐度等环境因素的影响, 并具有种间差异。有研究表明, 三角褐指藻(Phaeodactylum tricornutum)的最适生长温度在15—20℃, 温度升高至25℃ 显著降低其平台期的生物量[2], 海链藻(Thalassiosirasp.)在18—24℃内具有较高的生长速率, 温度升高至27℃显著抑制其生长[3], 而相比于22℃, 假微型海链藻(Thalassiosira pseudonana)在26℃时的生长速率显著增加[4], 相比于15℃, 25℃显著促进中肋骨条藻的生长[5], 也有研究显示温度从20℃升高至28℃, 威氏海链藻(Thalassiosira weissflogii)的生长不受影响, 但玛氏骨条藻(Skeletonema marinoi)的生长速率逐渐降低[6],即微藻生长对温度变化的响应不同。近岸海域的调查研究显示, 温度是影响近岸海域浮游植物群落结构的主要环境因子之一[7], 赤潮的暴发于海水温度密切相关[8], 有害赤潮藻赤潮异弯藻生长的最适温度为25℃[9]。
一般认为, 温度是通过影响微藻中与光合作用相关的酶的活性及耐受性, 影响微藻的叶绿素含量和光合速率, 继而影响微藻的生长、总脂和毒素含量等, 及影响浮游植物的群落结构。研究表明, 赤潮异弯藻的细胞体积随着温度的升高而逐渐减小,同时单位体积细胞的色素含量逐渐增加[9], 锥状斯氏藻(Scrippsiella trochoidea)和塔玛亚历山大藻(Alexandrium tamarense)的光合放氧速率在20—22℃时达到最高值[10], 温度由15℃升高至25℃, 三角褐指藻的光合固碳速率也显著增加[11], 而当温度由10℃逐渐升高至30℃, 三角褐指藻达到指数生长末期所需的时间降低, 其总脂肪酸含量先增加后降低, 且组成成分也受影响, 其中不饱和脂肪酸含量在15℃时含量最高[12]。三角褐指藻作为一种饵料微藻, 在研究温度对其生长的影响的同时, 也需考虑其品质的变化。
然而, 尽管关于温度对微藻生长、光合作用及生化组分等方面的研究较多, 但已有的研究多集中在探究不同温度梯度的影响[2—6,9—12], 也有少量研究关注了低温或高温的前处理即温度的诱导作用[13],但这些研究均忽略了昼夜温差的效应, 而自然界中昼夜温差是真实存在的, 虽然海水温度的昼夜变化低于陆地温度, 但海水温度昼夜变化的影响也是不可忽视的。目前已有的关于昼夜温差的研究多集中在对大型海藻的探究上[14,15], 本实验室的研究也表明大型海藻浒苔(Ulva prolifera)在夜间黑暗状态下能够快速生长[16], 且一定程度的昼夜温差可促进大型海藻浒苔的生长(未发表数据)。因此, 考虑到大部分微藻的细胞增殖主要是在暗周期进行, 我们推测微藻的生长在一定程度上会受到昼夜温差的影响, 且具有种间差异。本实验选择常见的优良饵料藻三角褐指藻(Phaeodactylum tricornutum)和赤潮藻赤潮异弯藻(Heterosigma akashiwo)为材料, 探究昼夜温度变化对其生长和光合作用的影响。
1 材料与方法
1.1 藻种
三角褐指藻由中国科学院水生生物研究所胡晗华教授提供, 赤潮异弯藻由宁波大学食品与药学学院藻种库提供。
1.2 微藻培养
分批培养P. tricornutum和H. akashiwo分别培养在盐度为35和25的f/2加富的人工海水中, 培养期间光照强度为100 μmol/(m2·s)(早8:00到晚8:00为光周期时间)。温度处理设置3个水平, 分别为22℃(光暗周期培养温度均为22℃)、22—18℃(光、暗周期培养温度分别为22℃和18℃)、18℃(光暗周期培养温度均为18℃)。每个温度处理组设4个重复, 分批培养时P. tricornutum和H. akashiwo的起始密度分别为3×105和5×104cell/mL。每天测定细胞密度, 绘制标准曲线, 在指数生长期进行叶绿素荧光参数、叶绿素a和类胡萝卜素含量及光合固碳速率的测定。
半连续培养在分批培养的基础上(明确指数生长期细胞浓度范围), 取指数生长中期的藻细胞进行半连续培养实验, 温度处理和其他培养条件同分批培养。P. tricornutum和H. akashiwo的起始细胞密度分别设置为9×105和5×104cell/mL, 每隔1天进行细胞计数和按比例稀释, 稀释的后的细胞浓度等同于初始浓度, 并计算半连续培养时细胞的比生长速率。待比生长速率稳定后测定其叶绿素荧光参数、叶绿素a和类胡萝卜素含量。
1.3 细胞密度的测定和比生长速率的计算
每天定时取样用血球计数板和浮游植物计数框分别测定三角褐指藻和赤潮异弯藻的细胞密度。赤潮异弯藻在计数前需用卢戈氏液进行固定。而后, 用Logistic方程对分批培养下的生长速率(即生长曲线)进行拟合, 拟合公式为:y=a/{1+[(ay0)/y0]e-rx}(y0代表初始细胞密度,a代表环境承载量,r为内禀增长率)[17]。
半连续培养下的比生长速率的计算公式如下:μ=ln(N2/N1)/(t2-t1), 其中N1和N2分别为半连续培养时t1和t2对应的细胞密度。
1.4 叶绿素荧光参数的测定
采用AquaPen手持式水体荧光仪进行叶绿素荧光参数的测定。中午12点前后取样, 黑暗条件下适应15min后进行叶绿素荧光诱导曲线的测定, 光化光设置为600 μmol/(m2·s)。获得围绕光系统Ⅱ的最大光化学效率(Fv/Fm)和相对高光600 μmol/(m2·s)条件下(大于半饱和光强)的有效光化学效率(ФPSⅡ)、光化学淬灭(Qp)和非光化学荧光淬灭(NPQ), 其中,ФPSⅡ=(Fm′-Fs)/Fm′, Qp=(Fm′-Fs)/(Fm′-F0′), NPQ=Fm/Fm′-1。
直接取培养状态下的细胞进行快速光响应曲线(RLC)的测定, RLC用公式rETR=PAR/(a×PAR2+b×PAR+c) 进行拟合, 进而计算其围绕光系统Ⅱ的最大相对电子传递速率(rETRmax)、表观光能利用效率(α)和半饱和光强(Ek)[18]。
1.5 叶绿素a和类胡萝卜素的提取与测定
在指数生长期和平台期取一定体积的藻液, 过滤在GF/F膜上 (Φ25 mm, Whatman, 孔径0.22 μm),放入15 mL 离心管中, 加入5 mL 甲醇, 4℃提取24 h,之后离心 (5000×g, 10 min), 取上清液于紫外-分光光度计(UV6100A, 上海元析仪器有限公司)中进行全光谱扫描(250—750 nm)。根据公式计算叶绿素a(Chl.a)和类胡萝卜素 (Carotenoids, Car.) 的含量[19]:
Chl.a(μg/mL)=13.2654×(A665-A750)-2.6839×(A632-A750)

而后再根据细胞密度和藻液体积, 将Chl.a和Car.的单位换算为pg/cell。
1.6 光合固碳速率的测定
取指数生长期的藻液进行低压过滤(压力低于0.03 pa), 将过滤后的藻细胞冲洗入新鲜的预调温的空气饱和的培养基中, 测定藻液的初始pH和细胞浓度, 再分装到4个定制玻璃管中, 放入相应的培养条件下密闭培养1h, 而后迅速测定其pH。根据pH和总碱度(TA, 固定值, 与海水盐度有关[20]), 运用CO2sys软件计算密闭培养前后培养基中溶解无机碳的浓度, 进而计算藻细胞的光合固碳速率[21]。计算公式如下: 固碳速率=ΔC×V/(N×h), ΔC为培养前后无机碳浓度的变化值,V为密闭培养的体积,N为细胞数,h为培养时间。
1.7 数据处理
所有数据表示为平均值±标准误(n=4)。采用单因子方差分析的方法进行温度效应的显著分析, 事后采用Tukey法进行多重比较, 显著水平设置为P<0.05。
2 结果
2.1 昼夜温差对三角褐指藻和赤潮异弯藻生长的影响
分批培养的结果显示三角褐指藻相比于18℃,22℃延长了藻细胞生长的延迟期, 平台期时细胞浓度低于18℃, 而22—18℃处理组, 在培养的第1至第3天其生长趋势几乎与18℃处理组一致, 但显著降低平台期的藻细胞密度(图1A), 然而对不同温度条件下的生长曲线进行拟合发现, 培养温度为22℃时, 藻细胞的内禀增长率较高, 但该温度处理下初始藻细胞浓度较低(表1)。半连续培养的结果显示相比于18℃, 22℃时细胞的比生长速率略有降低, 降幅为8.9%, 22—18℃显著抑制了细胞的生长(P=0.012; 表2)。
和三角褐指藻不同, 尽管18℃和22℃处理下,平台期的细胞密度相差不大, 但相比于22℃, 18℃和22—18℃均延长了赤潮异弯藻生长的延迟期(图1B和表1)。且相比于恒温处理, 无论是分批培养还是半连续培养, 昼夜温差显著降低了赤潮异弯藻的比生长速率(表1和表2), 尤其是半连续培养时, 相比于22℃, 22—18℃时细胞比生长速率的降幅高达36.4%(表2)。

表1 三角褐指藻和赤潮异弯藻分批培养时不同温度处理下生长曲线的拟合参数Tab. 1 Fitting parameters of growth curve of P. tricornutum and H. akashiwo

表2 半连续培养条件下三角褐指藻和赤潮异弯藻在各温度处理条件下的比生长速率Tab. 2 The specific growth rate (μ) of P. tricornutum and H.akashiwo
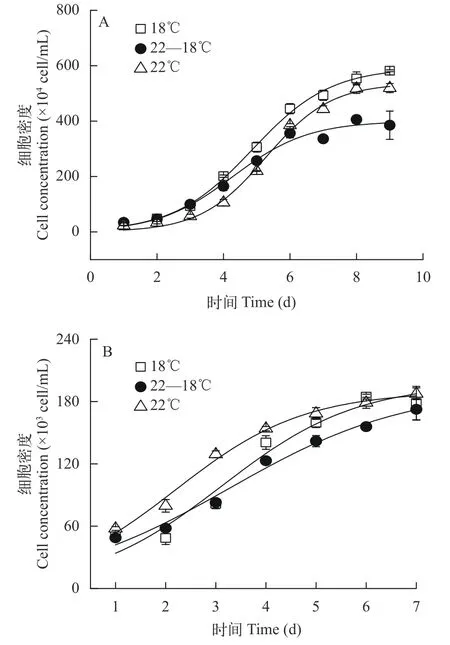
图1 光暗周期不同温度处理的三角褐指藻(A)和赤潮异弯藻(B)的细胞密度Fig. 1 Cell concentrations of P. tricornutum (A) and H. akashiwo(B) under different temperatures treatments
2.2 昼夜温差对三角褐指藻和赤潮异弯藻叶绿素a和类胡萝卜素含量的影响
在分批培养时, 相比于22℃, 18℃和22—18℃均显著降低了三角褐指藻的叶绿素a(Chl.a; 18℃:P<0.001; 22—18℃:P<0.001)和类胡萝卜素含量(Car.; 18℃:P<0.001; 22—18℃:P<0.001; 图2A)。然而, 对于赤潮异弯藻而言, 22℃和22—18℃处理间的Chl.a和Car.的含量差异不显著(Chl.a:P=0.503;Car.:P=0.501), 但相比于22℃, 18℃显著降低其含量(Chl.a:P=0.002; Car.:P=0.004; 图2C)。在半连续培养时, 温度变化对2种藻Chl.a和Car.的影响均不显著(图2B和2D)。

图2 在不同温度处理下三角褐指藻(A和B)及赤潮异弯藻(C和D)分别在分批培养指数期(A和C)和半连续培养(B和D)时的叶绿素a和类胡萝卜素含量Fig. 2 Cellular pigments contents of P. tricornutum (A and B)and H. akashiwo (C and D) under different temperature treatments with batch (A and C) and semi-continuous cultures (B and D),respectively
2.3 昼夜温差对三角褐指藻和赤潮异弯藻叶绿素荧光参数的影响
分批培养和半连续培养的结果显示, 三角褐指藻光系统Ⅱ的最大光化学效率(Fv/Fm)和非光化学淬灭(NPQ)在不同温度处理间无差异(图3A和3B),但在600 μmol/(m2·s)条件下其有效光化学效率(ФPSⅡ)及光化学淬灭(Qp)在18℃处理下略高于其他2个温度处理。温度对赤潮异弯藻的Fv/Fm、ФPSⅡ和Qp的影响均不显著(图3C和3D), 然而分批实验的结果显示在22℃培养条件下的细胞的NPQ最大(图3B),而半连续培养时NPQ在22℃条件下最小(图3D)。
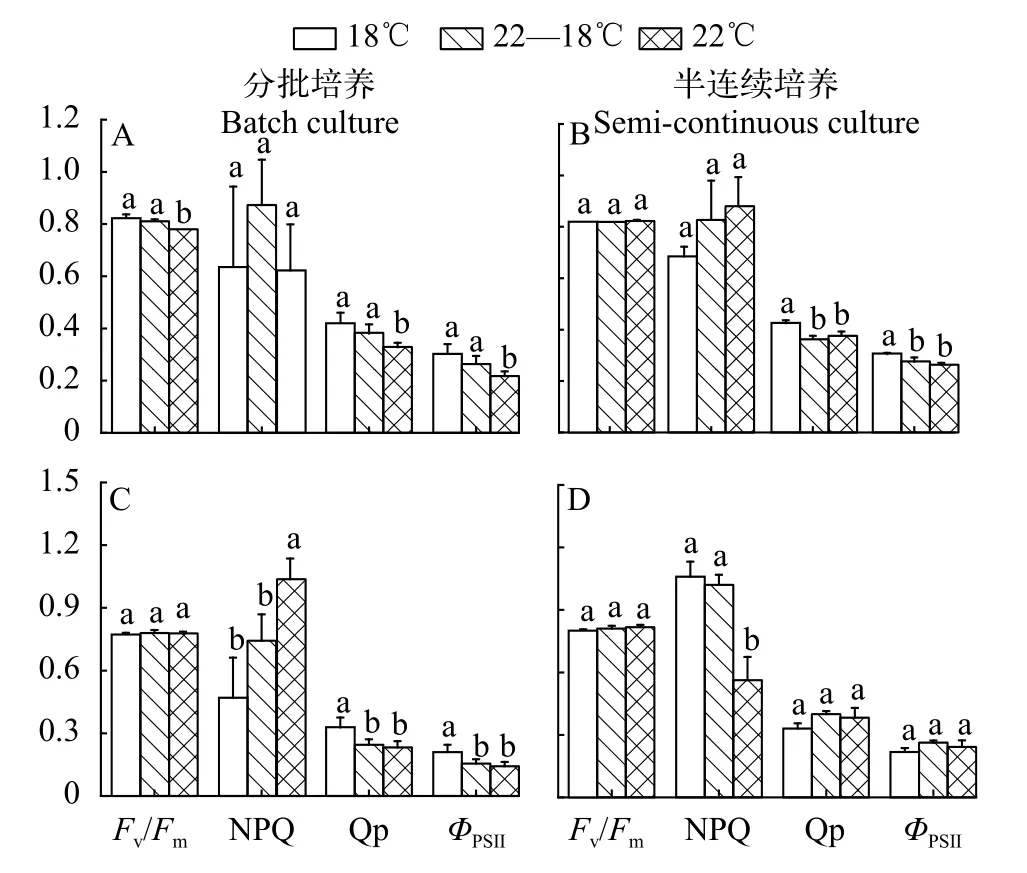
图3 在不同温度处理下三角褐指藻(A和B)及赤潮异弯藻(C和D)分别在分批培养指数期(A和C)和半连续培养时的叶绿素荧光参数Fig. 3 Chlorophyll fluorescence parameters of P. tricornutum (A and B) and H. akashiwo (C and D) under different temperature treatments with batch (A and C) and semi-continuous cultures (B and D), respectively
整体来说, 三角褐指藻和赤潮异弯藻的相对电子传递速率随着光照强度的增加而增加, 且三角褐指藻的半饱和光强(Ek)和对高光的耐受能力显著高于赤潮异弯藻(图4和表3)。培养方式影响2种藻相对电子传递速率对温度的响应, 在分批培养时, 三角褐指藻和赤潮异弯藻的最大相对电子传递速率(rETRmax)在18℃时最大(图4A和4C、表3), 而在半连续培养时, 三角褐指藻的rETRmax在18℃时最小,温度对赤潮异弯藻rETRmax的影响不显著(F(2,9)=0.413,P=0.674), 22℃增大了赤潮异弯藻的Ek, 增加了该藻对高光的耐受能力(图4C和4D、表3)。
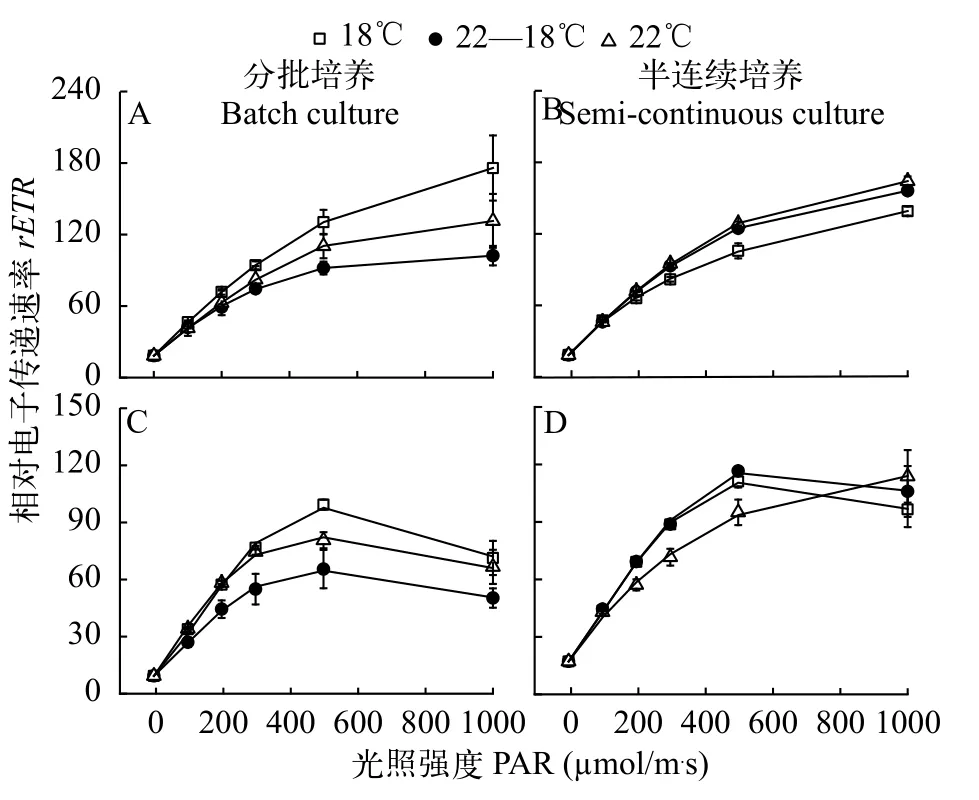
图4 不同培养温度下三角褐指藻(A和B)及赤潮异弯藻(C和D)分别在分批培养指数期(A和C)和半连续培养时的光响应曲线Fig. 4 Rapid light curves of P. tricornutum (A and B) and H. akashiwo (C and D) under different temperature treatments with batch(A and C) and semi-continuous cultures (B and D), respectively

表3 在分批及半连续培养条件下三角褐指藻和赤潮异弯藻在各温度处理下的表观光能利用效率(α)、半饱和光强(Ek)和最大相对电子传递速率(rETRmax)Tab. 3 The table tourism efficiency (α), saturated intensity (Ek), and the maximum relative electron transfer rate (rETRmax) of P.tricornutum and H. akashiwo with batch culture
2.4 昼夜温差对三角褐指藻和赤潮异弯藻光合固碳速率的影响
三角褐指藻和赤潮异弯藻的光合固碳速率均在22—18℃条件下显著高于其他2个温度处理, 但在18℃和22℃处理间几乎无差异, 即昼夜温差显著影响微藻的光合作用(和22℃相比, 三角褐指藻:P<0.01; 赤潮异弯藻:P=0.02; 图5)。

图5 不同温度处理的三角褐指藻(A)和赤潮异弯藻(B)的光合固碳速率Fig. 5 Carbon fixation rates of P. tricornutum (A) and H.akashiwo (B) at different temperature treatments
3 讨论
温度是影响微藻生长、光合作用、饵料品质及分布的主要因素, 不同微藻具有不同的最适温度[2—7],温度升高或降低将会抑制或促进微藻的生长及光合作用[2—6,9,10]。本研究发现, 温度从18℃升高至22℃, 三角褐指藻的生长速率略有降低, 但差异不显著, 即三角褐指藻的适温范围较广[2], 而赤潮异弯藻的生长略有增加, 体现了微藻的不同最适生长温度, 这与之前的研究一致, 即25℃是赤潮异弯藻的最适生长温度[6]。
3.1 昼夜温差对微藻生长的影响
尽管关于温度对微藻生长、生化组成影响的研究较多[2—6,9—12,22], 然而对已有的文献进行分析发现, 现有的研究多是探讨恒定的温度梯度的效应,缺少对昼夜温差效应的探究, 仅有的关于温度波动、昼夜温差对藻类生长的研究显示: 温度波动10℃不影响蛋白核小球藻的生长, 但抑制铜绿微囊藻和梅尼小环藻的生长, 且对梅尼小环藻的抑制作用强于铜绿微囊藻[23]; 昼夜温差促进了大型海藻坛紫菜的生长, 并强化了海水酸化对坛紫菜光合作用、硝酸还原酶活性、氨基酸含量等的促进作用[15],也有研究显示相比于昼夜温差10℃, 昼夜温差5℃有利于梅尼小环藻的生长[24], 即相比于恒温处理来说, 无论是温度波动还是昼夜温差, 对大型海藻、微藻的生长均具有一定的效应, 且该效应具有种间差异。本研究的结果显示, 昼夜温差4℃显著降低了三角褐指藻和赤潮异弯藻的生长, 但具有种间差异, 具体体现在: 分批培养时昼夜温差4℃处理显著降低了三角褐指藻在平台期的细胞密度, 而该处理下赤潮异弯藻在平台期的细胞密度和其他2个温度处理间的差异不显著, 但降低了分批培养初期的细胞生长速率, 延长了达到平台期所需的时间, 从生态学的角度来看, 昼夜温差延长了赤潮异弯藻指数生长的延迟期, 在一定程度上也延迟了以赤潮异弯藻为优势种的赤潮的暴发。但从不同温度处理间平台期细胞密度的变化这个角度来说, 赤潮异弯藻对昼夜温差的耐受性高于三角褐指藻。然而半连续培养的结果显示, 昼夜温差4℃对赤潮异弯藻生长的抑制作用(和最适温度相比, 抑制率为36.4%)远高于三角褐指藻(11.4%), 从这个角度来看, 三角褐指藻对昼夜温差的适应能力较强。这在一定程度上说明微藻培养方式的重要性, 因此, 昼夜温差处理虽然降低了三角褐指藻的生长速率, 但其光合固碳速率显著增加, 可通过优化培养条件、培养方式促进其生长并提高其饵料品质。同时本研究分批培养的结果也说明了温度对三角褐指藻生长的影响很可能受到其他环境因素, 比如光照强度、营养盐等的影响。柳清杨等[25]的研究显示, 氮限制能够降低三角褐指藻对光能的吸收利用效率, 在分批培养后期, 三角褐指藻细胞浓度较高, 其单细胞接受的光照强度和营养盐均低于培养初期, 进一步导致昼夜温差4℃处理的藻细胞密度显著降低。
3.2 昼夜温差对微藻光合作用能力的影响
适度的昼夜温度变化可提高大型海藻的光合作用和氮同化, 有利于有机物的合成[15], 也有研究显示, 夜间低温可以促进浒苔在光周期时的生长[16],且浒苔在暗周期时也可以维持较高的生长[14]。本研究的结果显示, 三角褐指藻和赤潮异弯藻的光合固碳速率均在昼夜温差处理下较高, 即夜间温度适度降低可以促进藻细胞在光周期时的光合作用, 结合以往的研究结果即温度史影响藻细胞对温度变化的响应[26], 推测适度的昼夜温差可以促进微藻的生长, 但需要进一步的实验验证。同时, 目前海水升温是一个不争的事实, 而升温也具有季节和区域差异[27], 昼夜温差的变化幅度也会有差异, 微藻对昼夜温差的不同响应, 会在一定程度上影响浮游植物的群落结构。此外, 温度影响微藻的脂肪酸含量及组分且具有种间差异[11,12,28], 昼夜温差对不同种类的饵料微藻品质的影响需进一步研究。
一般来说, 藻类光系统Ⅱ的最大光化学效率Fv/Fm反映了藻类进行光合作用的最大潜力[29], 当藻细胞受到温度、光照等环境因素的胁迫时, 藻细胞的Fv/Fm会显著降低[25]。本研究的结果显示3个温度处理下2种藻的Fv/Fm均在0.8左右, 不同温度处理间的差异不显著, 表明实验所用的3个温度均不是胁迫温度。Qp是光系统Ⅱ吸收的能量用于进行光化学反应的比例, 开放态的光系统Ⅱ反应中心所占的比例, 反映了光合活性的高低[30]。在高光条件下, 低温培养的三角褐指藻具有较高的光化学淬灭(Qp)和有效光化学效率(ФPSⅡ), 而温度不影响赤潮异弯藻的Qp和ФPSⅡ, 进一步反映了微藻响应环境因素变化的种间差异。对于三角褐指藻来说, 温度升高降低了藻细胞的Qp和ФPSⅡ, 表明温度升高使得藻细胞对高光更加敏感。此外, 半饱和光强Ek的高低反映了藻细胞对高光的耐受能力[31], 三角褐指藻的Ek显著高于赤潮异弯藻, 其对高光的耐受性也较高, 同时在分批培养后期对单个细胞接受的光照强度变化的敏感性也更高, 这或许是分批培养2种藻对昼夜温差处理不同响应的可能原因。
在理论上, 藻类相对电子传递速率(rETR)和光合固碳/放氧速率均可以用来衡量藻细胞的光合作用, 尤其是基于荧光检测的便捷性, 叶绿素荧光技术在藻类光合性能的研究中应用广泛[32], 但实际上rETR和光合放氧/固碳速率并不是总是同步的, 尤其是在高光条件下, 也会出现藻细胞的rETR较高但光合放氧速率接近0的情况[33], 其主要原因是部分电子参与具有光保护作用的水-水循环, 从而降低高光的抑制作用[34]。在本研究中, 分批培养时, 和18℃、22℃处理相比, 22—18℃条件下藻细胞的rETR较低, 但光合固碳速率较高, 这在以往的研究中也有所发现[5,11]。可能的原因是升温促进光合作用关键酶核酮糖-1,5-二磷酸羧化酶/加氧酶的羧化活性, 但也降低了该酶对CO2的亲和力[35], 即光合作用对温度的依赖性较高, 其响应策略也较复杂,22—18℃培养的藻细胞在光暗周期的交替中经历着高温-低温的变换, 光周期时培养温度较高, 此时较高的光合固碳速率是对升温的一种应激现象。2个恒温处理间的藻细胞的光合固碳速率无差异也说明实验所选取的温度均在2种藻的最适温度范围内。
三角褐指藻生长繁殖快, 富含多不饱和脂肪酸[12],是鱼虾贝的理想饵料藻, 在水产育苗中应用广泛,同时也富含岩藻黄素[36], 经济价值高, 如何提高三角褐指藻的生长速率获得较高的细胞数量是关键。赤潮异弯藻是有害赤潮的优势种, 实验室内开展环境变化对赤潮藻优势种生长等特性的影响对赤潮预测、治理有重要的意义。基于此, 本研究选取了饵料藻三角褐指藻和赤潮藻赤潮异弯藻为材料, 研究昼夜温差这个自然现象对其生长、光合作用等的影响, 并分析其种间差异。其结果显示昼夜温差抑制二者的生长、相对电子传递速率, 但受其培养方式、光照强度和营养盐等因素的调控。但本研究仅仅是对昼夜温差效应的初步探讨, 其作用机理、多环境因素的复合效应及微藻的种间、品系间的不同响应均需深入探究。

