晚期肺腺癌转化为小细胞肺癌1例并文献复习
余雯文 叶华 陈阿丽 李继法
患者 男,75岁。因“体检发现左肺占位1年”于2019年6月22日入乐清市人民医院。入院查体神志清楚,精神可,口唇无发绀,咽不红,双侧扁桃体无肿大,双肺呼吸音清,未闻及干湿啰音,余未见明显异常。6月22日胸部增强CT示左肺上叶占位,大小约58 mm×52 mm;两肺多发结节灶,考虑转移瘤(图1)。6月25日行支气管镜检查示左肺上叶后段支气管腔内新生物完全阻塞管腔,行新生物活检,病理学检查结果为腺癌。免疫组化:肿瘤组织 细胞角蛋白(cytokeratin,CK)7(+)、新天冬氨酸蛋白酶 A(napsin A)(+)、甲状腺转录因子 1(thyroid transcription factor1,TTF1)(+)、CK5/6(-)、p63(-)、p40(-)、CD56(-)、嗜铬素 A(chromogranin A,CgA)(-)、突触素(synaptophysin,Syn)(-)、细胞增殖核抗原(Ki-67)(+,约80%)。完善分期检查后诊断为左上肺腺癌cT3NxM1b期,两肺及脑转移,Ⅳ期。基因检测结果为表皮生长因子受体(epidermal growth factor receptor,EGFR)19外显子缺失突变。7月5日开始予盐酸厄洛替尼片(规格:150mg/片,批号:J20170030,上海罗氏制药有限公司)150 mg/d口服;贝伐珠单抗注射液(规格:100 mg/瓶,批号:S20120068,德国 Roche Diagnostics GmbH公司)500 mg/次,3周/次,静脉滴注抗肿瘤治疗,后多次随访复查。11月26日复查胸部CT示左肺上叶占位大小为10 mm×9 mm,提示左肺上叶占位较前缩小,根据实体瘤疗效评价标准1.1(response evaluation criteria in solid tumors 1.1,RECIST1.1)[1]评价为部分缓解。
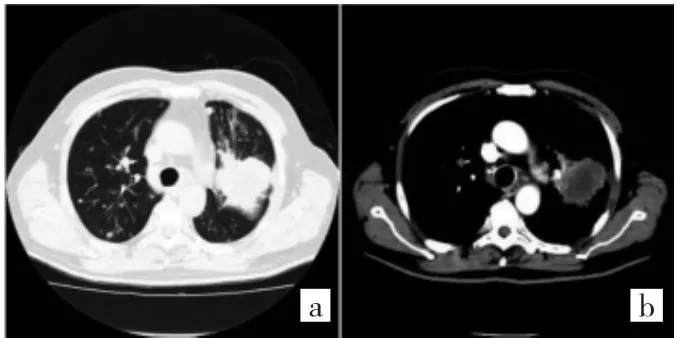
图1 胸部增强CT所见(a:肺窗示左肺上叶团块影,大小约58 mm×52 mm,边缘呈分叶状,见毛刺,邻近胸膜增厚;b:纵隔窗示增强后团块边缘呈渐进性轻-中度强化,病灶中心强化不明显,两肺多发结节影)
2020年1月28日复查胸部CT示左肺上叶恶性肿瘤,大小约38 mm×32 mm,颅内转移灶较前相仿,根据RECIST 1.1评价为疾病进展(progressive disease,PD),行支气管镜检查示左肺上叶后段支气管腔内新生物部分阻塞管腔,行新生物活检,病理学检查结果为腺癌,当时患者拒绝送检基因。2月7日起改为口服奥希替尼片(规格:80 mg/片,批号:H20170167,瑞典AstraZeneca AB公司)80 mg/d治疗,期间多次复查胸部CT,评价为疾病稳定(stable disease,SD)。11月5日复查胸部CT示左肺上叶恶性肿瘤伴两肺多发结节,对比前片左肺上叶团块较前增大,大小约41mm×38 mm,两肺结节灶较前大致相仿。11月9日再次行气管镜下左肺上叶后段支气管腔内新生物活检,病理学检查结果为小细胞肺癌(small cell lung cancer,SCLC)。免疫组化:肿瘤组织 CgA(+)、Syn(+)、CD56 部分(+)、TTF1(部分 +)、Napsin A(-)、CK7(-)、CK5/6(-)、p63(-)、p40(-)、Ki-67(+,>95%)。
组织基因检测结果为EGFR19外显子缺失突变、TP53错义突变、NTRK1错义突变阳性。12月2日起行EC方案(依托泊苷联合卡铂)静脉滴注化疗6个周期,同时口服奥希替尼片。2021年1月14日复查胸部CT示左肺上叶恶性肿瘤伴两肺多发结节,对比前片左肺上叶团块较前略缩小,大小约40 mm×35 mm,评价为SD。3月3日复查胸部CT示左肺上叶恶性肿瘤伴两肺多发结节,对比前片左肺上叶团块较前略增大,大小约45 mm×35 mm,评价为SD。后患者无法耐受化疗放弃进一步治疗,末次随访时间为2021年8月5日。
讨论目前EGFR-酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitors,EGFRTKIs)是EGFR敏感突变阳性的非小细胞肺癌(non small cell lung cancer,NSCLC)患者的一线治疗药物,与化疗相比能显著延长患者的无进展生存期和总生存期[2]。但多数患者在EGFR-TKIs治疗后10~14个月会出现PD,最常见的耐药机制为获得性T790M突变,约占50%~60%,此外还有人表皮生长因子受体2基因扩增、肝细胞生长因子受体基因扩增等旁路激活以及SCLC转化等耐药机制,其中发生SCLC转化的占3%~10%,称之为转化性SCLC(the transformation to SCLC,ttSCLC)[3-5]。与EGFR突变不同,ALK融合阳性肺腺癌的耐药机制里SCLC转化非常罕见,多为个案报道[6]。
目前肺腺癌EGFR-TKIs治疗耐药后出现ttSCLC的机制仍不明确。一种解释为肿瘤干细胞共同起源假说。起源于Ⅱ型肺泡上皮细胞和Clara细胞的肺腺癌具有转化为起源于神经内分泌细胞的SCLC的潜能[7]。研究提示RB1及TP53这两种抑癌基因的突变可能导致NSCLC向SCLC转化,导致肺腺癌对靶向药物产生获得性耐药[8-9]。Offin 等[10]研究显示与 EGFR/TP53 突变组、EGFR突变组相比,EGFR/TP53/RB1突变组肺癌患者无进展生存期更短,分别为(12.3、36.6个月比 9.5个月,P<0.01),且EGFR/TP53/RB1突变组SCLC转化的发生率更高(P=0.05),提示 RB1及 TP53失活与NSCLC出现SCLC转化的风险有关。本例患者从初始治疗到疾病进展的时间为6.5个月,明确ttSCLC的时间为16个月,其发生SCLC转化后进行基因检测发现TP53错义突变,提示了TP53突变可能与NSCLC出现SCLC转化存在一定的相关性。另一种解释是肿瘤细胞异质性假说[11],肿瘤干细胞在增殖分化过程中既能分化成NSCLC细胞也能分化为SCLC细胞。Marcoux等[12]Meta分析结果显示,67例EGFR突变的SCLC中58例患者(86.6%)初诊时为NSCLC,另9例(13.4%)为NSCLC和SCLC的混合病理类型,提示肺癌的异质性。初始样本中存在NSCLC和SCLC的混合组织学成分,第一次活检由于样本体积的局限性仅检测到腺癌的成分,而再次活检样本中获取了不同的组织学区域[13]。本例患者通过支气管镜下左肺上叶后段支气管腔内新生物活检获得病理学结果,由于样本体积有限,不能排除样本量不足导致病理诊断的不全面,对于肿瘤患者尽量多得获取肿瘤标本有利于病理诊断。
肺腺癌出现ttSCLC后生物学行为与经典SCLC类似,病情进展快,有效治疗手段少,总体预后较差。SCLC对化疗和放疗敏感,目前阿特珠单抗或度伐利尤单抗、依托泊苷/伊立替康联合铂类,结合胸部放疗是广泛期SCLC的一线治疗方案。但原发性SCLC的治疗策略可能在ttSCLC中疗效不佳[14]。Marcoux等[12]Meta分析结果显示ttSCLC患者经铂类联合依托泊苷治疗的中位无进展生存期仅为3.4个月。Sehgal等[15]Meta分析结果显示接受纳武利尤单抗或帕博利珠单抗单药治疗的肺腺癌转化为SCLC患者自转化为SCLC以来的中位生存时间为13.0个月,提示免疫治疗可能对于ttSCLC患者的生存期有获益。但Marcoux等[12]的研究中17例肺腺癌转化为SCLC患者应用免疫检查点抑制剂治疗无获益,因此肺腺癌发生SCLC转化后的免疫治疗需要筛选适合的特定人群,寻找对应的生物标志物。本例患者转化为SCLC后基因检测结果仍有EGFR19外显子缺失突变,该患者继续予奥希替尼口服联合EC方案化疗治疗,然而对于存在EGFR敏感突变的ttSCLC患者是否在EGFR-TKIs治疗的同时进行放化疗,目前没有统一的标准,对于ttSCLC的治疗方案仍需进一步的研究和探索。关于ttSCLC的预后,既往研究显示EGFR-TKIs耐药后的ttSCLC患者中位生存期较经典型SCLC更短,总体预后较差[12,16]。
综上所述,部分肺腺癌患者经EGFRTKIs治疗后会出现ttSCLC,导致获得性耐药,其机制可能与肿瘤干细胞共同起源假说、肿瘤细胞异质性假说等有关,这提示重复组织活检及重复基因检测对于探索肺癌治疗过程中的耐药机制至关重要,肺腺癌向SCLC转化的患者病情进展快,预后不佳,需要探索更多的治疗方法以改善预后。

