HO-1、HMGB1在早产儿支气管肺发育不良发病中的作用及近期神经系统发育评估中的价值
杜薇薇 韩爱民 刘文强 李明磊 王军
支气管肺发育不良(bronchopulmonary dysplasia,BPD),即早产儿慢性肺病综合征,是一种极/超低出生体重儿常见的慢性肺部疾病。近年来,随着医疗技术的发展,极/超低出生体重儿的存活率逐渐升高,同时BPD的发病率也在不断增高。据报道,极低出生体重儿BPD的发病率高达24.9%,部分早产儿可能遗留神经系统发育不良等问题[1-2]。目前有研究发现,血红素氧合酶-1(heme oxygenase-1,HO-1)、高迁移率族蛋白 B1(high mobility group box 1,HMGB1)参与了急性肺损伤、肺纤维化等多种肺部疾病的发生、发展[3-4]。但是关于两者在BPD发病机制中作用的研究仍然较少,此外有研究发现两者与神经系统发育密切相关[5-6]。近年来研究发现振幅整合脑电图(amplitude-integrated EEG,aEEG)评分的变化与新生儿神经发育水平相一致[7-8],可反映新生儿近期神经系统发育情况。本研究通过比较早产儿出生后不同时期血清中HO-1、HMGB1水平及aEEG评分的差异,探讨HO-1、HMGB1在BPD发病过程中的可能作用及早产儿近期神经系统发育评估中的临床价值。
1 对象和方法
1.1 对象 选取2019年12月至2021年3月徐州医科大学附属医院新生儿重症监护室收治的早产儿120例作为研究对象。纳入标准:胎龄≥28周且<32周、出生体重<1 500 g的早产儿,要求至少存活至出生后矫正胎龄40周。排除标准:严重的先天发育畸形、重症感染、复杂型先天性心脏病、遗传代谢性疾病、Ⅲ度及Ⅲ度以上颅内出血、胆红素脑病、缺血缺氧性脑病、小于胎龄儿等。研究期间自动放弃4例,死亡1例,发生重症感染、实验数据不完整者19例,最终纳入96例。根据第4版《实用新生儿学》[9]中BPD诊断标准,将早产儿分为BPD组40例和非BPD组56例。两组早产儿性别、胎龄、出生体重、1 min及5 min Apgar评分、肺表面活性物质(pulmonary surfactant,PS)使用情况、母亲妊娠期糖尿病及妊娠期高血压发生率比较差异均无统计学意义(均P>0.05),但两组早产儿无创通气时间、有创通气时间比较差异均有统计学意义(均P<0.05),见表1。根据矫正胎龄36周时需吸入氧浓度(fraction of inspired oxygen,FiO2)情况[9]将BPD组分为轻度亚组(未用氧)、中度亚组(FiO2<30%)及重度亚组(FiO2≥30%或需机械通气)。本研究经医院医学伦理委员会审核通过(XYFY2021-KL114),所有患儿家属均知情同意。
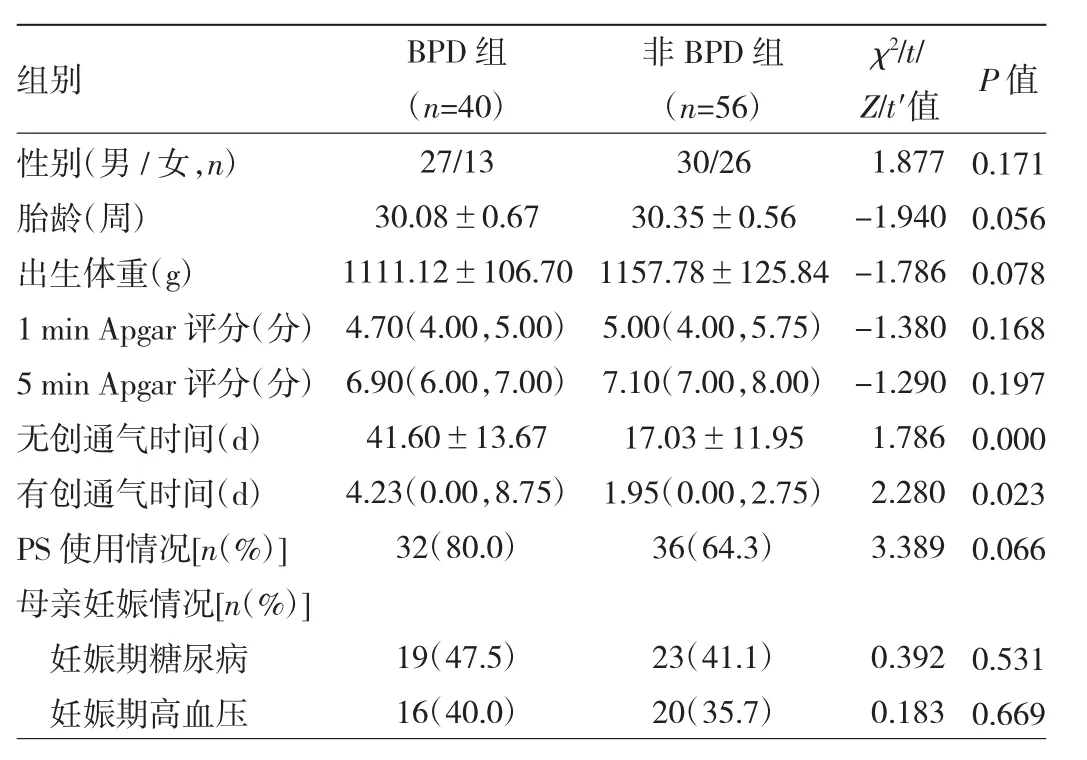
表1 BPD组与非BPD组早产儿一般资料比较
1.2 方法
1.2.1 血清HO-1、HMGB1水平检测 所有入选对象于出生后第1、7、14、28天采集动脉血1 ml,采用ELISA法检测血清HO-1、HMGB1水平,试剂盒均购自上海将来实业股份有限公司,严格按照试剂盒说明书进行操作。
1.2.2 aEEG评分监测 由于早产儿出生后早期病情危重,于出生后1周内及矫正胎龄40周时使用美国NATUS公司生产的Nicolet One视频脑电图监测仪记录脑电图,每次监测至少4 h,并参照Burdjalov等[10]aEEG评分系统由专业医师进行评分,分值范围0~13分,分值越低提示脑损伤越重[11]。
1.3 统计学处理 采用SPSS 21.0统计软件。符合正态分布的计量资料以表示,方差齐时,两组间比较采用两独立样本t检验;方差不齐时,两组间比较采用校正t检验。非正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-Whitney U检验;多组间比较采用Kruskal-Wallis H检验,两两比较采用Nemenyi法。计数资料组间比较采用χ2检验。两组间不同时间点血清HO-1、HMGB1水平变化采用重复测量数据的方差分析。BPD组血清HO-1、HMGB1水平与aEEG评分的相关性采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 BPD组与非BPD组早产儿血清HO-1、HMGB1水平的变化与比较 BPD组早产儿出生后第7、14、28天血清HO-1、HMGB1水平均高于非BPD组,差异均有统计学意义(均P<0.05);而两组早产儿出生后第1天血清HO-1、HMGB1水平比较差异均无统计学意义(均P>0.05)。与同组出生后第1天比较,BPD组早产儿出生后第 7、14、28天血清 HO-1、HMGB1水平均升高;非BPD组早产儿出生后第7、14天血清HO-1、HMGB1水平均升高,而出生后第28天血清HO-1、HMGB1水平均下降,差异均有统计学意义(均P<0.05)。与同组出生后第7天比较,BPD组早产儿出生后第14天血清HMGB1水平升高,出生后第 28天血清 HO-1、HMGB1水平均下降;非BPD组早产儿出生后第14天血清 HMGB1水平下降,出生后第28天血清HO-1、HMGB1水平均下降,差异均有统计学意义(均P<0.05)。与同组出生后第14天比较,两组早产儿出生后第28天血清HO-1、HMGB1水平均下降,差异均有统计学意义(均P<0.05),见表2。

表2 BPD组与非BPD组早产儿血清HO-1、HMGB1水平的变化与比较(ng/ml)
2.2 BPD各亚组与非BPD组出生后1周内、矫正胎龄40周时aEEG评分比较 BPD轻度、中度及重度亚组早产儿出生后1周内、矫正胎龄40周时aEEG评分均低于非BPD组,差异均有统计学意义(均P<0.05);BPD中度及重度亚组早产儿出生后1周内、矫正胎龄40周时aEEG评分均低于轻度亚组,重度亚组早产儿出生后1周内、矫正胎龄40周时aEEG评分均低于中度亚组,差异均有统计学意义(均P<0.05),见表3。

表3 BPD各亚组与非BPD组出生后1周内、矫正胎龄40周时aEEG评分比较(分)
2.3 BPD组血清HO-1、HMGB1水平与aEEG评分的相关性分析 BPD组出生后第7天血清HO-1水平与出生后1周内 aEEG评分呈负相关(r=-0.718,P<0.01),出生后第7、14、28天血清HO-1水平与矫正胎龄40周时aEEG评分均呈负相关(r=-0.800、-0.762、-0.704,均P<0.01)。BPD组出生后第7天血清HMGB1水平与出生后1周内aEEG评分呈负相关(r=-0.784,P<0.01),出生后第 7、14、28 天血清 HMGB1 水平与矫正胎龄40周时aEEG评分均呈负相关(r=-0.746、-0.753、-0.721,均 P<0.01)。
3 讨论
BPD是早产儿常见的慢性呼吸系统疾病,以肺血管系统破坏、肺泡发育受阻、肺组织损伤后异常为主要病理特征[12]。近年来关于BPD发病机制的研究较多,主要为氧化应激、感染、炎症反应、机械通气损伤等[13-14]。HO-1作为应激蛋白,已被证实参与急性肺损伤、肺纤维化等多种肺部疾病的发生、发展[3-4],但是HO-1在BPD发病机制中的研究仍然较少。
本研究发现 BPD组出生后第 7、14、28天血清HO-1水平均高于非BPD组,其机制可能是:机体在对抗氧化应激及炎症反应时激活Nrf2/Keap1信号传导通路,上调HO-1的表达,促进血红素氧化分解为胆绿素、一氧化碳、Fe2+,减少氧自由基的产生,发挥抗炎、抗氧化及抗凋亡,从而减轻肺泡Ⅱ型上皮细胞(AECⅡ)的损伤,抑制肺部炎症反应,改善血管重构[15-16];此外HO-1通过下调凋亡相关蛋白Bcl-2表达,上调Caspase-3蛋白表达,同时通过促进线粒体融合,从而发挥AECⅡ保护作用[17-18],进而参与调节BPD的发生、发展。本研究还发现BPD组血清HO-1水平虽较非BPD组高,但可能因其水平仍相对不足,机体抗氧化抗凋亡等作用失衡,导致AECⅡ凋亡破坏较多,引起肺部发生重构等异常,最终发展为BPD。
此外有研究证实在p38MAPK/Nrf2/HO-1信号通路上,HMGB1作为HO-1下游,通过上调HO-1可以抑制HMGB1水平,减轻炎症反应[13,19-20]。本研究中两组早产儿出生后第1天血清HO-1、HMGB1水平无明显差异,可能与其采样时间较早,患儿尚未暴露在高氧、炎症环境中或通气时间较短有关。本研究发现BPD组无创通气及有创通气时间均高于非BPD组,而BPD组患儿出生后第7、14、28天血清HMGB1水平均高于非BPD组,可能因为机械通气激活了肺组织表皮生长因子受体,经p38MAPK信号通路诱导HMGB1表达增加[19]。
BPD早产儿脑组织中神经胶质分化和髓鞘形成较为敏感,由于生后长期氧疗,更易发生脑损伤,部分患儿可出现神经行为发育落后,甚至脑瘫等[21-23]。近年来研究发现HO-1可通过分解血红素起到保护神经细胞的关键作用[5]。而HMGB1也被证实存在于脑细胞中,可以参与神经系统发育,且与细胞因子等相互作用而介导炎症反应,参与神经损伤的发生、发展[6]。aEEG作为一种床旁监测神经系统发育情况的检查方法,由于操作简单已被广泛用于临床。本研究于出生后1周内及矫正胎龄40周时监测aEEG,结果示BPD组aEEG评分低于非BPD组,BPD组血清HO-1及HMGB1水平与出生后1周内、矫正胎龄40周时aEEG评分均呈负相关。其机制可能为当机体神经系统损伤时可刺激机体保护性基因HO-1表达,通过抗炎、抗氧化、调节凋亡自噬等机制发挥保护神经细胞作用。但本研究未结合颅脑超声、MRI及神经行为学检查等指标,对早产儿神经发育的评估存在一定的局限性。
综上所述,HO-1/HMGB1可能与早产儿BPD的形成有关,同时可能影响早产儿的神经系统发育。因此,通过增加HO-1表达或抑制HMGB1表达可能改善BPD形成。如近年来有学者发现过氧化物酶体增殖物激活受体γ激动剂(如罗格列酮等)可以促进HO-1的表达,目前部分已应用于临床[24-25],这可能为BPD的治疗提供一个新的研究方向。

