糖尿病足溃疡患者感染铜绿假单胞菌的相关因素及药敏分析
曹云玲,孙爱东,井庆平
(淄博市第一医院内分泌科,淄博 255200)
随着人们生活水平的提高、生活方式的改变,糖尿病患者数量呈上升趋势,且发病率逐渐升高[1-2]。糖尿病足溃疡(diabetic foot ulcers,DFU)是糖尿病较严重的并发症之一,病死率较高。因患者抵抗力下降,受到感染的概率升高,当患者发生溃烂时创口往往很难完全愈合[3-4];且病情一旦恶化,将会增大截肢的风险,为患者及社会带来沉重负担。使用抗菌药物是临床治疗DFU感染的重要方式之一,但抗菌药物的滥用、错误使用方式和细菌自身的突变问题,会导致病原菌的耐药性日益严重[5]。铜绿假单胞菌(pseudomonas aeruginosa,PA)是一种条件致病菌,是导致DFU感染的常见病原菌之一,其耐药率随着药物的过度运用及各种损伤性治疗手段的使用而呈现增高的趋势[6-7]。目前的研究大多仅分析不同疾病感染病原菌的耐药性,有关DFU患者感染PA的药物敏感性及其相关影响因素的研究较少。因此,本研究回顾性分析125例DFU患者的临床资料,探讨其感染PA的影响因素,并分析PA对常见抗菌药物的耐药性。
1 资料与方法
1.1 一般资料
收集2017年3月至2020年3月就诊于淄博市第一医院的125例DFU患者为研究对象,按照是否感染PA分为PA组与非PA组。PA组(n=67):男性42例,女性25例;平均年龄(69.18±9.56)岁;糖尿病平均病程(13.06±7.96)年。非PA组(n=58):男性38例,女性20例;平均年龄(67.47±10.69)岁;糖尿病平均病程(12.85±7.18)年。纳入标准:①确诊为DFU患者;②临床资料均完整;③患者及家属均知情且签署同意书。排除标准:①有恶性肿瘤者;②长期化疗者;③有免疫缺陷性等疾病者;④有静脉性溃疡者;⑤有因长期口服糖皮质激素引起的溃疡者。
1.2 方法
1.2.1 资料收集 所有患者在入院后收集病史且检查以下指标:体质量指数、收缩压、舒张压、糖尿病病程、周围神经病变、周围血管病变、糖化血红蛋白(hemoglobinA1c,HbA1c)、白细胞、中性粒细胞百分比、纤维蛋白原、血红蛋白、血浆白蛋白、血沉(ESR)、三酰甘油、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、骨髓炎及入院前因同一溃疡住院的情况。
DFU评估采用Wagner分级方法,1级:患者创口表面有溃疡但无感染症状;2级:患者创口有较深程度的溃疡感染病灶,常合并软组织炎症,但未出现脓肿或骨感染;3级:患者进阶为深度感染,伴有骨组织病变或脓肿现象;4级:患者骨质缺失或损伤,出现部分趾、足坏疽;5级:患者足的大部分或全部坏疽。评估患者的创面感染程度,参照美国感染病协会制定的糖尿病足感染防治指南分为轻度、中度及重度。
1.2.2 周围血管病变与周围神经病变[8]周围血管病变:患者需踝臂指数<0.9,使用多普勒超声检查下肢后,结果显示形成了动脉粥样硬化斑块且伴有不同程度的狭窄、闭塞,或下肢血管经过CT等血管造影均显示下肢动脉狭窄、闭塞,或曾经有下肢动脉成形术经历,综合临床间歇性的跛行、静息痛及足背动脉搏动消失进行治疗诊断。
周围神经病变:①患者感知温度障碍;②使用10 g尼龙丝行触觉检测时,足部感觉不明显或无感觉;③对于震动感知出现障碍;④踝反射功能降低或无感觉。满足上述两点及以上,可结合患者有痛感、麻木感等情况进行诊治。
1.2.3 创面处理与样本采集 先将患者溃疡表面坏死的组织、脓性分泌物或结痂部位清除干净,显露干净的肉芽组织,而后使用无菌生理盐水对患者创面进行冲刷,洁净后用无菌棉球擦拭,随后在肉芽组织1 cm2的范围处使用无菌棉拭子的头部旋转擦拭5 s,采集创面溢出的组织液,采样后将其放置无菌试管中,2 h内检测样本。
1.2.4 细菌的培养与药物敏感性试验 将样本放置在血琼脂的平面上待测,在35℃环境下培养72 h,菌株鉴定参照全国临床检验操作规程进行。细菌数值分类分析鉴定系统为API鉴定系统,API 20NE试剂盒购自法国生物梅里埃公司。药敏试验使用K-B法,药敏纸片购自英国Oxoid公司。
抗菌药物包括头孢他啶、头孢吡肟、哌拉西林/他唑巴坦、环丙沙星、美罗培南、哌拉西林、阿米卡星、庆大霉素、亚胺培南、妥布霉素、氨曲南及左氧氟沙星。
1.3 统计学方法
数据采用SPSS 22.0统计软件进行分析,计数资料以例或率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,组间比较采用t检验;将单因素分析有统计学意义的因素纳入多元Logistic回归分析。P≤0.05为差异有统计学意义。
2 结果
2.1 DFU患者临床资料
PA组患者周围神经病变、周围血管病变、骨髓炎及入院前因同一溃疡住院史的比例均高于非PA组患者(P均<0.05),见表1。
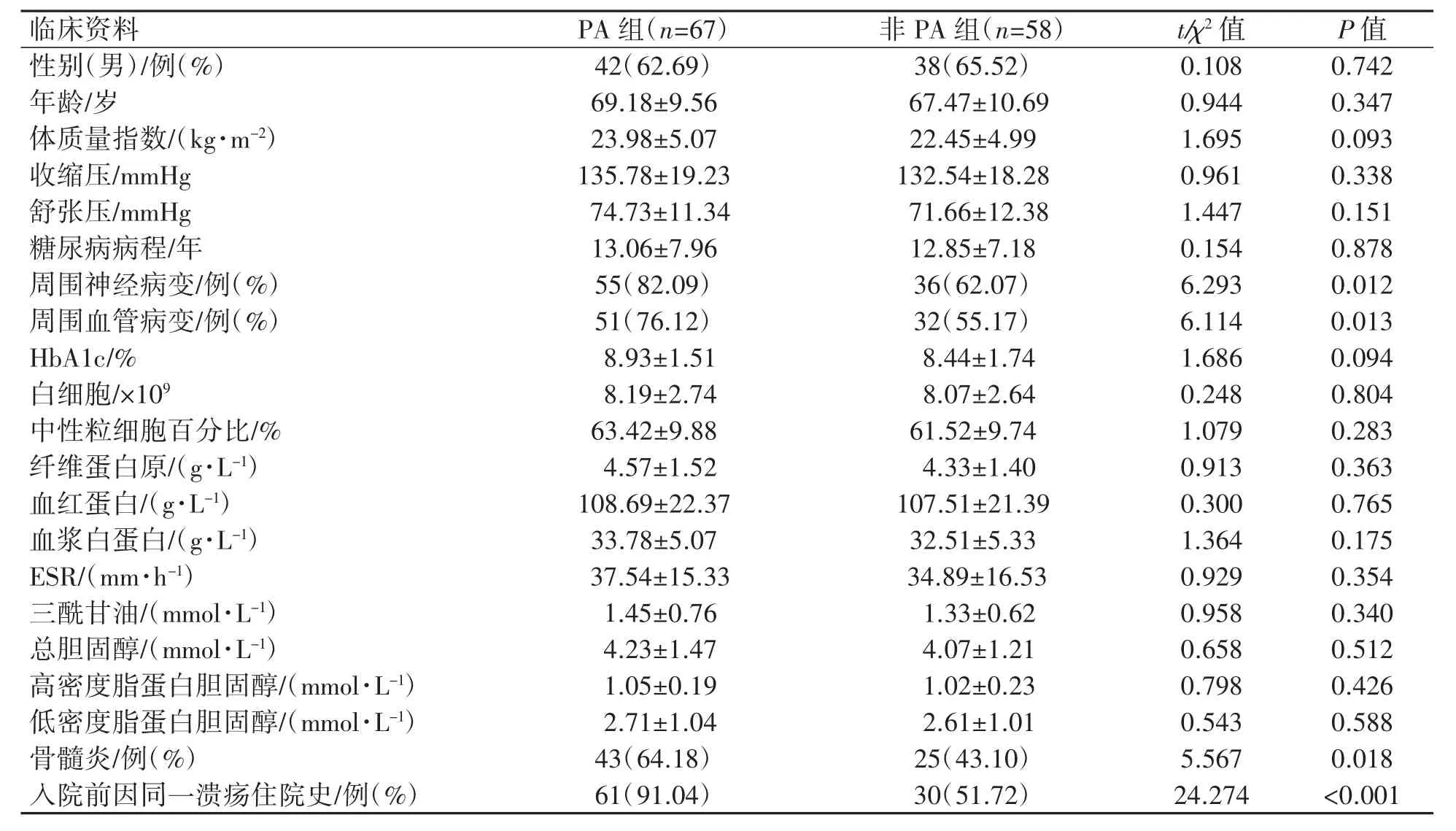
表1 两组患者临床资料比较
PA组患者以中度感染为主,Wagner分级主要为4级;非PA组患者以轻度感染为主,Wagner分级主要为1级。两组患者感染程度与Wagner分级比例差异均有统计学意义(P均<0.05),见表2。
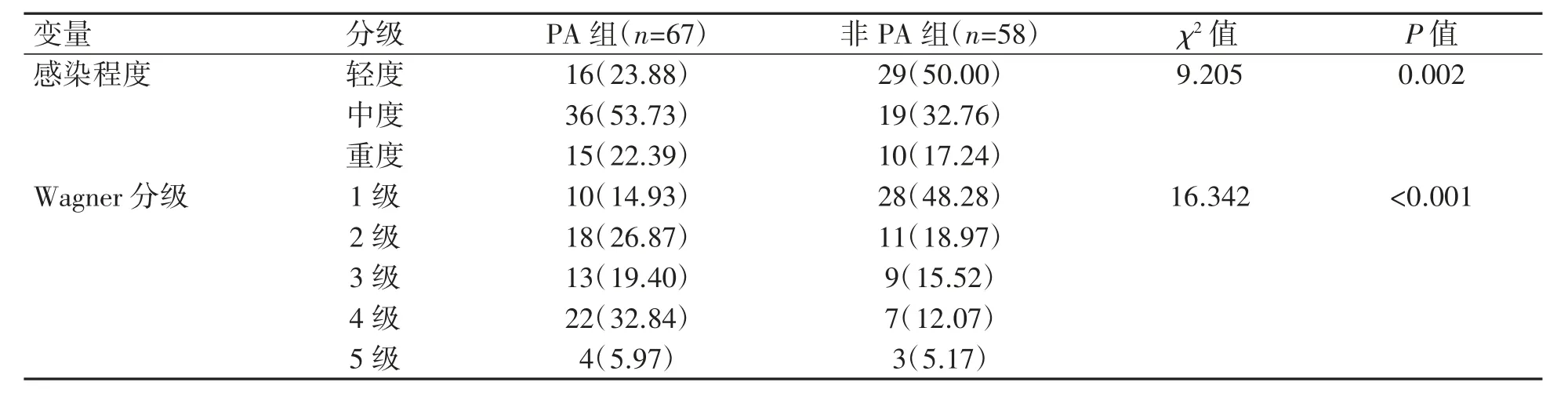
表2 患者感染程度与Wagner分级情况[例(%)]
2.2 铜绿假单细胞菌对常用抗菌药物的耐药性
PA对常见抗菌药物均有一定程度的耐药性,其中对头孢他啶、头孢吡肟、哌拉西林/他唑巴坦、环丙沙星和美罗培南的耐药率>80%,分别为88.06%、86.57%、86.57%、82.09%、80.60%;对哌拉西林、阿米卡星、庆大霉素、亚胺培南、妥布霉素耐药率为70%~80%,对左氧氟沙星耐药率最低,为62.69%,见表3。
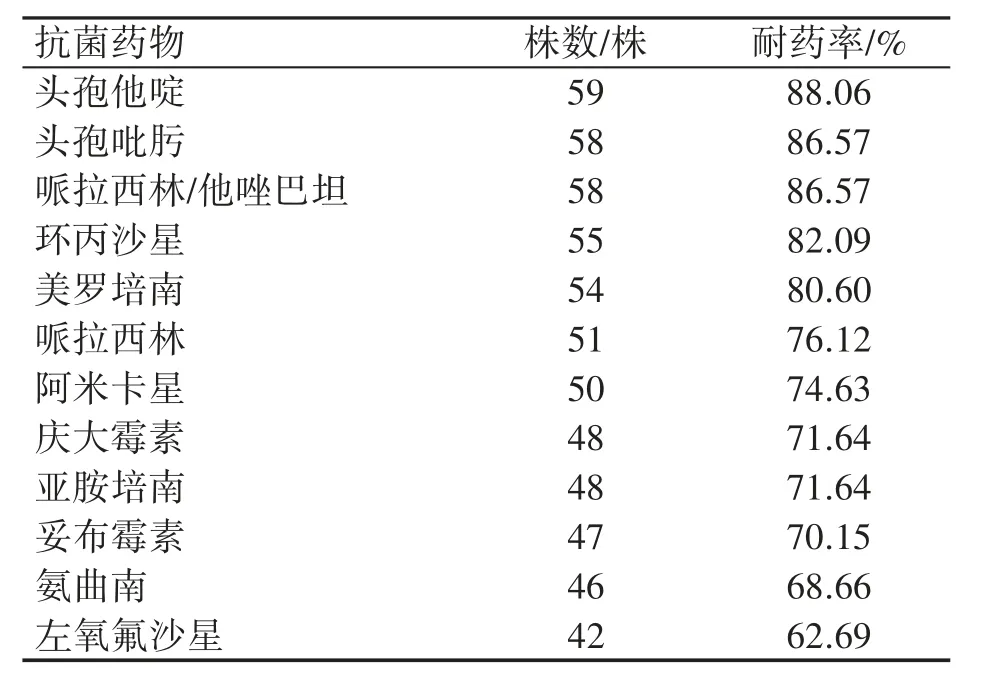
表3 67例PA对常用抗菌药物的耐药情况
2.3 DFU患者感染PA的多因素Logistic回归分析
以是否感染PA为因变量(1=感染,2=未感染),以周围神经病变(1=是,2=否)、周围血管病变(1=是,2=否)、骨髓炎(1=是,2=否)、入院前因同一溃疡住院史(1=是,2=否)、感染程度(1=轻度,2=中重度)、Wagner分级(1=1~2级,2=3~5级)为自变量,纳入Logistic回归分析。结果显示,入院前因同一溃疡住院史、Wagner分级均为DFU患者感染PA的独立影响因素(P均<0.05),见表4。

表4 DFU患者感染PA的多因素Logistic回归分析结果
3 讨论
糖尿病足是公认的经济压力及危害性较大的糖尿病并发症之一,而DFU则对患者的病情加重有不可估量的后果[9-10],其表现为足部软组织及骨关节系统遭到破坏或引发畸形,进而导致一系列的足部问题[11],死亡风险比单纯糖尿病患者高40%[12]。本研究125例DFU患者中,有67例发生感染PA,且感染PA耐药率较高的抗菌药物为头孢他啶、头孢吡肟、哌拉西林/他唑巴坦、环丙沙星和美罗培南,因为同一种病菌对于使用不同药物的敏感性不同,所以临床需要通过对药物敏感性进行检测,对患者的用药程度及方式进行适当调整,以防止药物的滥用和误用。
张静等[13]研究发现,PA菌株对头孢呋辛钠、头孢呋辛酯的耐药率均达到100.00%;杨雪梅等[14]研究表明,PA对美罗培南、亚胺培南和头孢他啶的耐药率较低,均为25.00%;郭小兵等[15]研究指出,PA对哌拉西林、哌拉西林/他唑巴坦、氨基糖苷类、氟喹诺酮类、四代头孢菌素的敏感率均>60%,且对亚胺培南和美罗培南的耐药率分别为30.8%和35.0%。本研究中,PA对头孢他啶、头孢吡肟、哌拉西林/他唑巴坦的耐药率较高,分别为88.06%、86.57%、86.57%,且对左氧氟沙星耐药率较低,为62.69%,这可能是因为头孢吡肟是第四代半合成头孢菌素之一,其通过对细菌的细胞壁合成及代谢的干预,能够在患者体内产生抗菌作用,且其活性较高,对PA的抗菌效果类似头孢他啶。近年临床对头孢类抗生素的广泛使用及使用不当,导致PA对头孢他啶、头孢吡肟等抗菌药物的耐药率变高。而左氧氟沙星是喹诺酮类药物中的一种,也具有广谱抗菌作用,但该药的不良反应会随剂量的增加而增加,临床在对其安全性与合理性使用上的方案未得出准确结论,无法对其药剂用量进行判定,所以耐药率低于上述药物。刘薇等[16]研究表明,HbA1c、SCr、病程≥10年、Wagner分级≥3级、合并骨髓炎是糖尿病患者多重耐药菌感染的危险因素。本研究发现,患者入院前因同一溃疡住院史、Wagner分级是影响其感染PA的独立影响因素,这可能是因为患者长期使用多种抗菌药物导致耐药率升高后,因为同一溃疡多次入院接受治疗,在频繁住院期间极其容易导致交叉感染,导致感染PA的风险加大。Wagner分级级别越高,患者感染的概率越大,这是因为级别越高患者的病情程度更深,创面更大或伤情更严重,此时患者愈合较慢更容易被感染。
综上所述,PA对头孢他啶、头孢吡肟、哌拉西林/他唑巴坦、环丙沙星和美罗培南的耐药率较高,因此临床应早期明确患者感染的病原菌,选择合适的抗菌药物。患者入院前因同一溃疡住院史、Wagner分级均为其感染PA的独立影响因素,临床需针对存在这两种情况的患者采取有效监测并提供相应的干预。

