慢性阻塞性肺疾病早期远端肺小动脉重塑及相关NOX4表达水平研究
高 超,郭晓桐,郝斌威,曹 霞,范玉春,陈 娟
(1.宁夏医科大学,银川 750004;2.宁夏回族自治区银川监狱医院,银川 750004;3.宁夏医科大学总医院呼吸与危重症医学科,银川 750004;4.山西白求恩医院山西医学科学院呼吸与危重症医学科,太原 030000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种慢性进行性气道和肺实质炎症性疾病,逐渐进展形成气流受限和肺泡毛细血管网破坏,肺泡缺氧及肺血管重塑会促进肺血管阻力和肺动脉高压(pulmonary artery hypertension,PAH)升高。远端肺小动脉重塑是肺血管阻力升高及血管扩张性降低的主要因素[1-2]。而肺血管平滑肌细胞的增殖、迁移和细胞外基质(extracellular matrix,ECM)组分的沉积又是COPD肺动脉重塑的重要过程[3]。过多的活性氧簇(reactive oxygen species,ROS)激活氧化还原敏感信号通路,导致血管收缩增强和PAH肺血管重塑[4]。烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nucleotide phosphate oxidase,NOX)是细胞内ROS产生的重要来源。NOX4是其7个家族成员之一,通过介导血管平滑肌及血管内皮细胞增殖、分化、凋亡等参与血管舒缩性控制及血管生成。低氧通过上调转化生长因子-β(transforming growth factor-β,TGF-β)诱导肺动脉平滑肌细胞高表达NOX4,促进细胞内ROS产生,诱导肺血管平滑肌细胞增生,从而参与肺动脉重塑[5]。目前针对轻中度以及未发生PAH的COPD患者的肺小动脉重塑机制研究甚少,本研究旨在观察轻中度COPD(未合并PAH)患者远端肺小动脉重塑情况,并探索TGF-β1介导的NOX4高表达及ECM异常沉积在肺小动脉重塑中的作用及机制。
1 资料与方法
1.1 研究对象
根据《GOLD指南2018》[6],选取2018年9月至2020年3月宁夏医科大学总医院收治的需行手术治疗的肺部肿瘤合并COPD(稳定期)患者24例(COPD组),其中轻度15例,中度9例,年龄40~65岁。选取同期需行手术治疗的肺部肿瘤而肺功能正常患者20例(对照组),年龄40~65岁。纳入患者均签署知情同意书。排除标准:①COPD合并肺动脉高压患者;②引起COPD类似症状和肺功能改变的其他疾病患者;③肺静脉闭塞及继发性肺动脉高压的其他肺血管疾病患者。
1.2 研究方法
1.2.1 主要试剂 山羊来源а-SMA抗体、兔多克隆抗体DAPDH(美国Abcam公司),兔来源NOX4抗体(美国Novus公司),鼠抗人Ⅳ型胶原单克隆抗体、兔抗人Ⅰ型胶原单克隆抗体、兔抗人纤维连接蛋白多克隆抗体、鼠抗人层粘连蛋白单克隆抗体、封闭用10%兔血清、封闭用山羊血清、辣根过氧化物酶标记二抗、DAB试剂盒(北京中杉金桥公司),重组人TGF-β1蛋白(美国R&D公司),封闭用驴血清、RIPA裂解液(北京索莱宝公司),人原代肺动脉平滑肌细胞(human primary pulmonary artery smooth muscle cells,HPASMC)、平滑肌细胞完全培养(美国Sciencell公司),BCA蛋白提取试剂盒(凯基生物公司),辣根过氧化物酶标记荧光二抗、辣根过氧化物酶标记山羊抗兔IgG(H+L)/HRP抗体、辣根过氧化物酶标记驴抗山羊IgG(H+L)/HRP抗体(美国Proteintech公司)。
1.2.2 人体组织收集及处理 收集受试者肿瘤病灶远端(>5 cm)、正常、新鲜的肺组织,约0.5 cm×0.5 cm×0.5 cm大小。石蜡包埋组织制成3 μm厚切片;新鲜组织用于检测目的蛋白表达,HE染色观察肺组织病理改变。使用а-平滑肌肌动蛋白抗体(а-smooth muscle actin,а-SMA)标记肺动脉平滑肌细胞,在此基础上每张切片高倍视野(×400)随机选取3~5个结构完整的肺小动脉(血管横断面外径为100~500 μm)为观察对象[7],采用Image-Pro Plus software 6.0(IPP)图像分析软件测量血管平滑肌层厚度(wall thickness,WT)、血管外径(external diameter,ED)、血管平滑肌层面积(vascular wall area,WA)、血管总面积,计算平滑肌层厚度占血管外径的百分比(WT%)[8]和平滑肌层面积占血管总面积的百分比(WA%)[9]。
1.2.3 免疫组织化学法测定肺组织远端肺小动脉平滑肌细胞а-SMA、Ⅳ型胶原蛋白(CollagenⅣ)、Ⅰ型胶原蛋白(CollagenⅠ)、纤维连接蛋白(fibronectin,FN)、粘连蛋白(laminin,LN)及NOX4蛋白表达情况 术中获取受试者肺组织后常规固定、石蜡包埋,制成3 μm厚石蜡切片。常规烤片、脱蜡、柠檬酸盐高压修复,3%H2O2消除内源性过氧化物,血清(10%兔血清,进口山羊血清)封闭,一抗孵育(兔来源NOX4抗体,1∶200稀释;山羊来源а-SMA抗体,1∶200稀释;鼠抗人CollagenⅣ抗体、兔抗人Collagen I抗体、兔抗人FN抗体、鼠抗人LN抗体,1∶200稀释)4℃过夜。滴加辣根过氧化物酶标记的相应二抗37℃孵育30 min。DAB显色,苏木素复染,脱水、封片。以PBS代替一抗做阴性对照。结果判读:平滑肌细胞胞浆内见棕黄色颗粒视为阳性,未见表达为阴性。采用IPP图像分析软件分析目的蛋白阳性细胞的平均光密度(average optical density,AOD)[10],AOD=积分光密度/染色区域分布面积。
1.2.4 细胞培养及处理 将HPASMC置于平滑肌细胞完全培养基中培养(37℃、5% CO2加湿空气)。通过а-SMA免疫细胞化学及免疫细胞荧光化学法检测鉴定HPASMC,第2~8代HPASMC用于实验。取对数生长期的HPASMC制成细胞悬液,接种于24孔板中,分为TGF-β1刺激与未刺激组,每组4个副孔。TGF-β1组使用加新鲜培养基配制的TGF-β1蛋白(2 ng·mL-1)刺激HPASMC 24 h后收集细胞,TGF-β1蛋白使用浓度以及作用时间参考本课题组前期研究[11];对照组在相同的培养条件下加入PBS液培养24 h后收集细胞。
1.2.5 免疫细胞化学法(ICC-P)与免疫细胞荧光法(IFC-P)测定HPASMC的а-SMA、NOX4及CollagenⅠ蛋白表达情况4%多聚甲醛固定HPASMC,0.5%Triton X-100通透,5%驴血清封闭,目的一抗(а-SMA抗体1∶100、NOX4抗体1∶200、CollagenⅠ抗体1∶200)4℃过夜孵育。次日加入一抗相应二抗或荧光二抗孵育,免疫细胞化学加入DAB工作液显色,免疫细胞荧光化学加入DAPI染核,倒置显微镜及倒置荧光显微镜下观察上述目的蛋白表达情况。结果判读:免疫细胞化学阳性信号为细胞胞浆内见棕黄色颗粒视为阳性,未见表达为阴性。免疫细胞荧光化学:а-SMA以细胞浆内呈现红色荧光为阳性反应,NOX4以细胞浆内呈现绿色荧光为阳性反应,DAPI为细胞核呈现蓝色荧光。采用IPP图像分析软件分析目的蛋白阳性细胞的AOD值。
1.2.6 蛋白免疫印迹法(Western blot)测定受试者肺组织以及HPASMC的а-SMA、NOX4、Collagen I蛋白表达情况 对于肺组织,术中获取受试者新鲜肺组织后迅速置入液氮中快速冷冻,将1.0 mL冰冻的RIPA裂解液加入大约300 μg的肺组织中进行匀浆;对于HPASMC,第2~8代HPASMC在冰上收获,用RIPA裂解液提取蛋白质。根据蛋白提取试剂盒及BCA法提取并测定肺组织及HPASMC的蛋白浓度。10% SDS-PAGE转移电泳,转膜、封闭,目的一抗(山羊抗人а-SMA抗体1∶2 000;NOX4抗体1∶1 000;兔抗人Collagen I抗体1∶500;兔抗人GAPDH抗体1∶2 000)4℃孵育过夜。使用辣根过氧化物酶标记的二抗[山羊抗兔IgG(H+L)/HRP抗体,稀释1∶5 000;驴抗山羊IgG(H+L)/HRP抗体,稀释1∶5 000]室温孵育1 h。GAPDH作为内参。ChemiDoc MPTMImaging System分析系统曝光、扫描。应用IPP软件通过光密度测定法量化目的蛋白表达AOD值。
1.3 统计学方法
数据应用SPSS 19.0统计软件进行分析。计量资料以均数±标准差(±s)表示,两样本间均数比较采用独立样本t检验;计数资料(性别)比较采用卡方检验;各指标的相关性分析采用Pearson相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料比较
两组患者在性别、年龄、吸烟指数(吸烟指数=每日吸烟包数×吸烟年数)方面差异均无统计学意义(P均>0.05)。COPD组患者第一秒用力呼气容积/用力肺活量(forced expiratory volume in one second/forced vital capacity,FEV1/FVC)、第一秒用力呼气容积占预计值百分比(forced expiratory volume in one second total predicted value,FEV1%pred)及动脉血氧分压(arterial partial pressure of oxygen,PO2)均低于对照组(P均<0.05)。COPD组动脉血二氧化碳分压(partial pressure of carbon dioxide,PCO2)高于对照组(P<0.05),见表1。

表1 两组患者一般临床资料比较
2.2 两组患者肺组织形态改变
HE染色结果显示:COPD组患者肺泡形态不规则,肺泡部分融合呈气肿样改变,肺泡间隔及小气道壁增厚并可见不同程度炎性细胞浸润。COPD组患者远端肺小动脉平滑肌层增厚,血管腔变形且管腔缩小,血管管壁及周围不同程度炎性细胞浸润,图1。

图1 两组患者肺组织形态改变(HE×200)
使用а-SMA标记肺小动脉平滑肌细胞结果显示,肺小动脉ED在COPD组与对照组差异无统计学意义(P=0.320),COPD组患者肺小动脉WT、WT%、WA%均较对照组增高(P均<0.05),见图2、表2。
表2 两组患者肺小动脉重塑指标比较(±s)

表2 两组患者肺小动脉重塑指标比较(±s)
?

图2 两组患者肺小动脉平滑肌а-SMA表达情况(IHC×400)
2.3 两组患者远端肺小动脉ECM蛋白表达情况
免疫组织化学染色发现,ECM蛋白(CollagenⅠ、CollagenⅣ、LN、FN)在肺小动脉平滑肌细胞胞质中均有表达;COPD组肺小动脉平滑肌CollagenⅠ、CollagenⅣ、LN、FN AOD值均较对照组增强(P均<0.05),见图3、表3。
表3 两组患者远端肺小动脉ECM蛋白表达水平(AOD值)比较(±s)

表3 两组患者远端肺小动脉ECM蛋白表达水平(AOD值)比较(±s)
?

图3 两组患者肺小动脉ECM蛋白表达情况(IHC×400)
2.4 两组患者远端肺小动脉平滑肌细胞а-SMA、NOX4蛋白表达情况
免疫组织化学染色发现,а-SMA、NOX4在肺小动脉平滑肌细胞胞质中均有表达;COPD组肺小动脉平滑肌а-SMA、NOX4表达AOD值[(1.23±0.80)、(0.94±0.54)]均较对照组[(0.09±0.06)、(0.02±0.01)]增强(P均<0.05)。Western blot结果显示,COPD组肺组织а-SMA、NOX4蛋白表达灰度值[(1.46±1.12)、(1.65±1.20)]较对照组[(0.85±0.58)、(0.62±0.28)]增强(P均<0.05),见图4、图5。
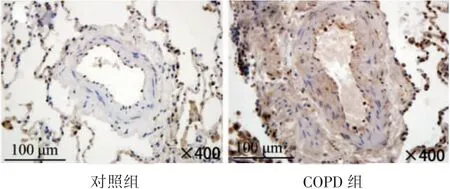
图4 两组患者肺小动脉NOX4蛋白表达情况(IHC×400)

图5 Western blot检测两组患者肺组织а-SMA、NOX4蛋白表达的电泳图
2.5 TGF-β1作用于HPASMC 24 h后NOX4、а-SMA、CollagenⅠ蛋白表达情况
ICC-P及IFC-P检测TGF-β1(2 ng·mL-1)作用于HPASMC 24 h后,NOX4、а-SMA、CollagenⅠ蛋白表达AOD值均较TGF-β1未作用前增高(P均<0.05),见图6、图7、表4。
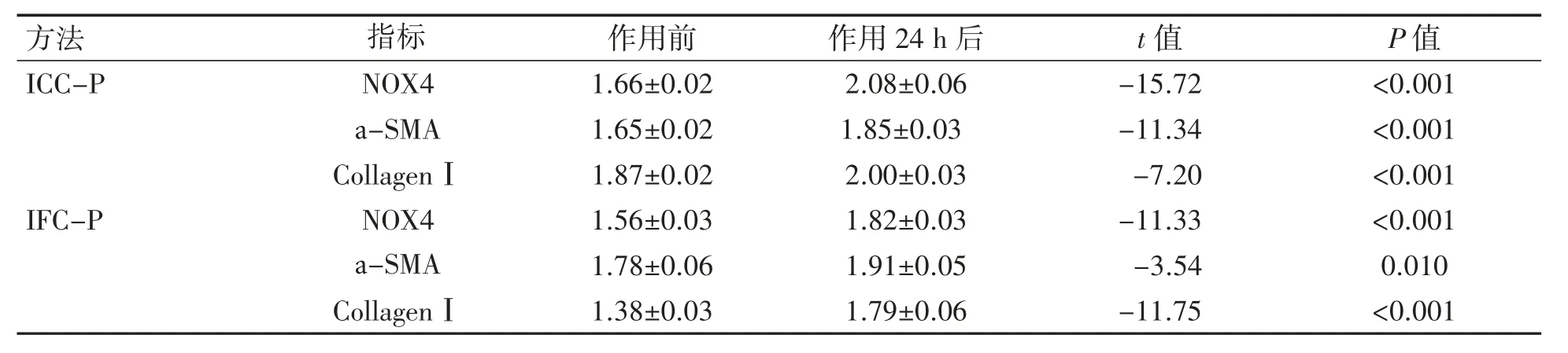
表4 TGF-β1作用于HPASMC前和24 h后NOX4、а-SMA、CollagenⅠ蛋白表达水平比较
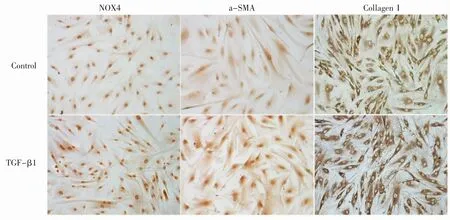
图6 TGF-β1(2 ng·mL-1)作用于HPASMC 24 h后NOX4、а-SMA、CollagenⅠ蛋白表达情况(ICC-P×400)
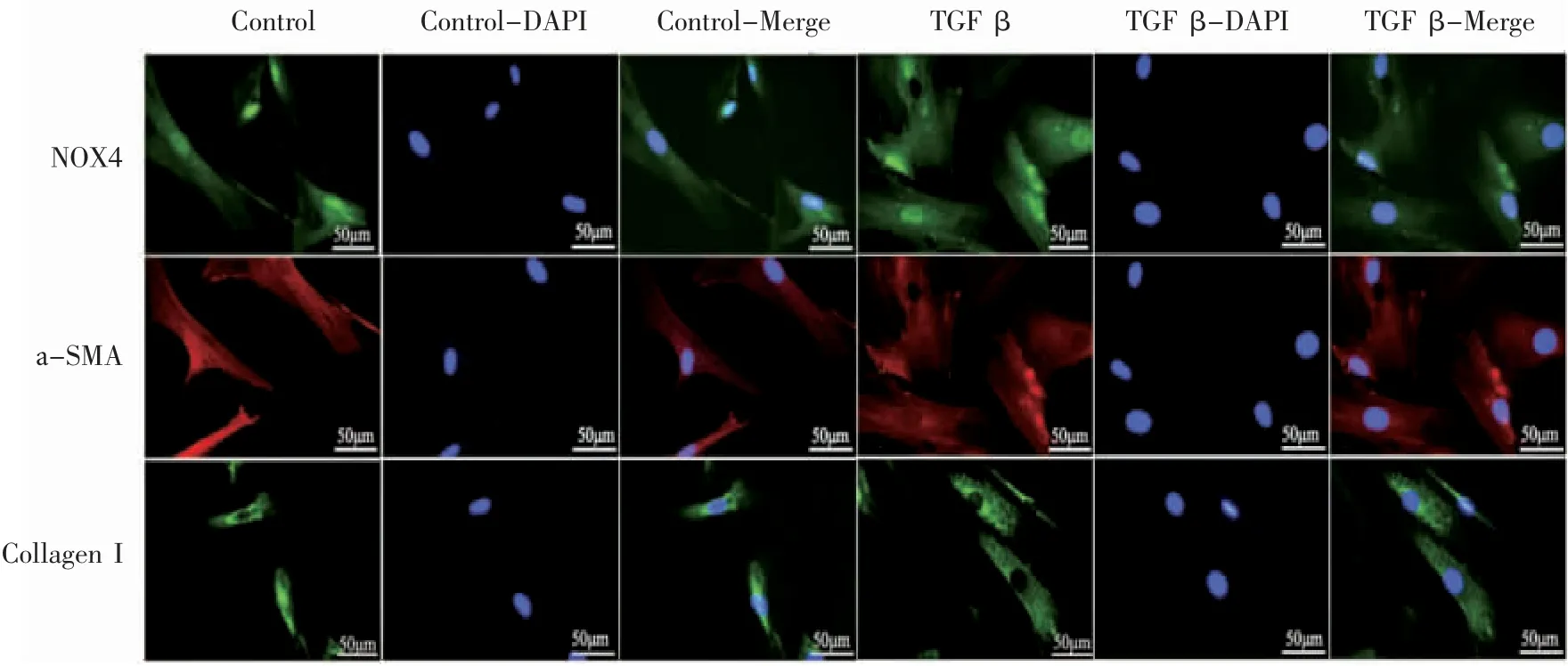
图7 TGF-β1(2 ng·mL-1)作用于HPASMC 24 h后NOX4、а-SMA、CollagenⅠ蛋白表达情况(IFC-P×400)
2.6 各指标的相关性分析
肺动脉重塑指标WA%、WT%与FEV1/FVC、FEV1%pred均呈负相关(P均<0.05)。肺小动脉平滑肌细胞CollagenⅠ、CollagenⅣ、LN、FN蛋白AOD值与FEV1/FVC、FEV1%pred均呈负相关(P均<0.05),见表5。
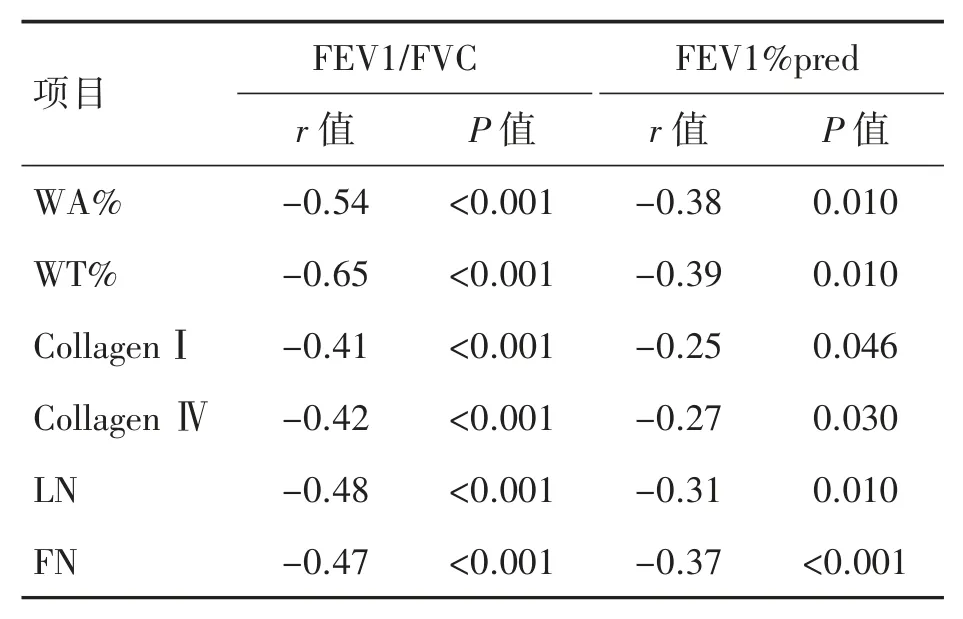
表5 各参数间的相关性分析结果
3 讨论
COPD不仅是一种气道疾病,而且同多数慢性弥漫性肺部疾病一样,肺微血管和毛细血管前小动脉也会受到影响[12]。肺动脉重塑导致PAH是COPD的特征性表现,ECM沉积、血管平滑肌细胞增殖和肥大均参与其中,导致毛细血管前肺动脉闭塞和PAH持续升高[13-14]。然而,肺动脉重塑并非只存在于晚期COPD,在没有动脉低氧血症的轻中度COPD患者中也发现了肺动脉重塑现象[15],主要表现为内膜增厚、血管壁面积增加以及中层血管壁增厚[16]。氧疗常常不能逆转COPD患者的PAH,且轻度COPD患者通常不存在低氧,这表明此类COPD患者的肺血管重塑包括不能用低氧性血管收缩来解释的其他因素。目前针对未发生PAH的COPD患者肺血管重塑机制研究甚少,本研究选取未发生PAH的轻至中度COPD患者为研究对象,使用平滑肌标记性抗体а-SMA标记远端肺小动脉(血管横断面外径100~500 μm),发现未发生PAH的COPD组患者的肺小动脉WT、WT%、WA%均较对照组增高,且肺小动脉а-SMA表达较对照组增高,提示未发生PAH的COPD患者存在以平滑肌层增厚、面积增大为表现的远端肺小动脉重塑。相关性分析也显示,肺动脉重塑指标WA%、WT%与FEV1/FVC、FEV1%pred均呈负相关,提示肺小动脉重塑与气流阻塞程度相关。
ECM是由高度交联的分泌蛋白组成的复杂网络,其主要结构成分被称为“核心基质”。ECM的重构对伤口愈合和组织内稳态至关重要,这一过程失调会导致多种病理状态,包括COPD发生[17]。ECM沉积、肺动脉平滑肌细胞的增殖和肥大,促进肺动脉中膜肥大和肌化,导致毛细血管前肺动脉闭塞和PAH持续升高[13,18]。本研究采用免疫组织化学检测法观察人远端肺小动脉ECM沉积情况,结果显示COPD组患者肺小动脉ECM蛋白(CollagenⅠ、CollagenⅣ、LN、FN)表达较对照组增强,提示ECM沉积参与COPD远端肺小动脉重塑。相关性分析显示远端肺小动脉ECM蛋白表达与FEV1/FVC、FEV1% pred均呈负相关,提示肺小动脉ECM沉积也与气流阻塞程度相关。
ROS是公认的引起血管壁细胞增殖和血管收缩的刺激因素。在COPD中,ROS从活化的炎性细胞或结构细胞如上皮细胞、内皮细胞和平滑肌细胞中释放出来,直接损害细胞成分。研究[19-20]显示,ROS参与肺动脉平滑肌细胞的增殖和EMC的沉积。NOX是脉管系统中产生ROS的重要来源,低氧诱导的NOX的激活在PAH中起重要作用,NOX促进肺血管收缩和血管重塑[21-22]。NOX4是NOX家族成员之一,作为PASMCs中主要的NOX亚型,NOX4通过介导肺动脉平滑肌增生、内皮细胞迁移增殖、分化及凋亡等,参与血管舒缩、血管生成以及PAH的发生[23]。TGF-β1是一种非活性的潜伏前体,从细胞分泌出来后与潜伏期TGF-β1结合蛋白(latent TGF-β1 binding protein,LTBP)结合,LTBP引导潜伏期复合物定位于ECM[24]。PAH患者的肺小动脉PASMC显示出较高水平的TGF-β1细胞内活性,PAH内分泌TGF-β1途径通过介导表皮生长因子和血小板源性生长因子诱导ECM沉积和PASMC细胞增殖[25]。
本课题组前期研究[11]显示:COPD组患者肺组织远端肺小动脉平滑肌细胞TGF-β1蛋白表达较对照组增高,提示TGF-β1参与COPD远端肺小动脉重塑。本研究发现COPD组患者肺小动脉平滑肌及肺组织NOX4表达均高于对照组,且采用TGF-β1能够刺激诱导HPASMC分化并上调HPASMC细胞NOX4、а-SMA及CollagenⅠ表达增强。因此,推测TGF-β1可能通过上调NOX4导致ROS产生增多,并通过此机制促进细胞转分化及ECM蛋白的分泌,NOX4/TGF-β1相关氧化应激信号通路可能参与了ECM介导的COPD肺小动脉重塑。
综上,COPD患者存在以平滑肌层增厚以及细胞外基质沉积为主的肺小动脉重塑,TGF-β1介导的NOX4相关氧化应激信号通路可能参与了COPD肺小动脉重塑的发生。

