90例氯氮平血药浓度监测结果回顾性分析
陈 洋,杨爱娟,马 薇
(宁夏回族自治区宁安医院(宁夏精神卫生中心),银川 750021)
氯氮平(clozapine,CZP)在临床上被用于精神分裂症的治疗,目前不作为一线药物推荐使用,但对于难治性精神分裂症仍是疗效最为确切的药物之一,有效率为15%~30%[1-2]。CZP个体差异较大,长时间服用容易发生不良反应,尤其易发生粒细胞缺乏症[3]。这极大地限制了CZP在临床的使用,因此实现个体化给药迫在眉睫。目前,神经精神药理学与药物精神病学协会(AGNP)更新发布的2017版《精神科治疗药物监测共识指南》已经将CZP强烈推荐为进行血药浓度监测的药物(最大推荐水平)[4-5]。本文回顾性分析90例精神分裂患者CZP及其代谢产物去甲氯氮平(N-demethylclozapine,N-CZP)的血药浓度,探讨其与性别、年龄、就诊类别的关系,以期为临床精神分裂症的治疗提供参考依据。
1 对象与方法
1.1 研究对象
收集2019年7月至2020年9月宁夏回族自治区宁安医院(宁夏精神卫生中心)收治的90例精神分裂症患者资料,所有患者均按照医嘱服用氯氮平治疗2周,已达到稳态血药浓度,均经临床药学实验室进行血药浓度监测。患者于监测当天服药前静脉采血3 mL。所有患者血药浓度监测均符合医院医学伦理学标准,临床资料完整。
1.2 仪器与方法
1.2.1 试剂与仪器 仪器:岛津高效液相色谱系统、SPD-20A UV/VIS检测器、LC-Solution工作站(日本岛津公司)、全自动二维液相色谱柱系统(湖南德米特有限公司)、TDZ4-WS台式低速离心机(湖南湘仪集团)、ALL SHENG Mini-15K高速离心机(杭州奥盛仪器有限公司)、Vortex Mixer XW-80A涡旋仪(上海沪西分析仪器厂有限公司)、BDP-10TC超低有机物型超纯水仪(南京权坤生物科技有限公司)。
试剂:CAA-1B流动相、MPI-1移动相、API-1酸性移动相、BPI-1碱性移动相、OPI-1有机移动相、ORG-1去蛋白剂(均购自湖南德米特有限公司)。
1.2.2 血药浓度检测方法 采用高效液相色谱法监测CZP及N-CZP的血药浓度。具体操作如下:将采血管放置于离心机中,25 °C、4 000 r·min-1离心5 min,取上清液将患者血浆置于2 mL EP离心管中。再取1 000 μL ORG-1去蛋白剂置入新的2 mL EP离心管中,加入患者血浆400 μL,涡旋60 s混匀,25 °C、14 500 r·min-1离心8 min,取上清液1 000 μL进样。将CAA-1B流动相、MPI-1移动相、API-1酸性移动相、BPI-1碱性移动相、OPI-1有机移动相混合比作为流动相进行检测。以质控品CAA-1为对照组,进行同样操作监测,保证样本结果的准确性。CZP与N-CZP的保留时间分别为8.9 min和7.9 min。
1.3 CZP及N-CZP血药浓度分类
根据2017版AGNP《精神科治疗药物监测共识指南》,规定CZP治疗的有效血药浓度范围为(350~600)ng·mL-1,低于350 ng·mL-1或高于600 ng·mL-1为不达标/超标浓度,1 000 ng·mL-1为危急值[6]。因此,本文将CZP血药浓度值分为<350 ng·mL-1、(350~600)ng·mL-1和>600 ng·mL-1三组;依据文献[7]将N-CZP血药浓度值分为<100 ng·mL-1、(100~200)ng·mL-1和>200 ng·mL-1三组。
1.4 统计学方法
数据应用SPSS 16.0软件进行统计分析,符合正态性和方差齐性的计量资料以均数±标准差(±s)表示,组间比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 不同患者血药浓度监测结果
90例患者CZP血药浓度在治疗窗内的占18.89 %,且个体差异较大;有5例患者(5.56 %)达到危急值。90例患者的CZP平均血药浓度为(353.53±305.89)ng·mL-1,N-CZP的平均血药浓度为(129.81±116.57)ng·mL-1,见表1。
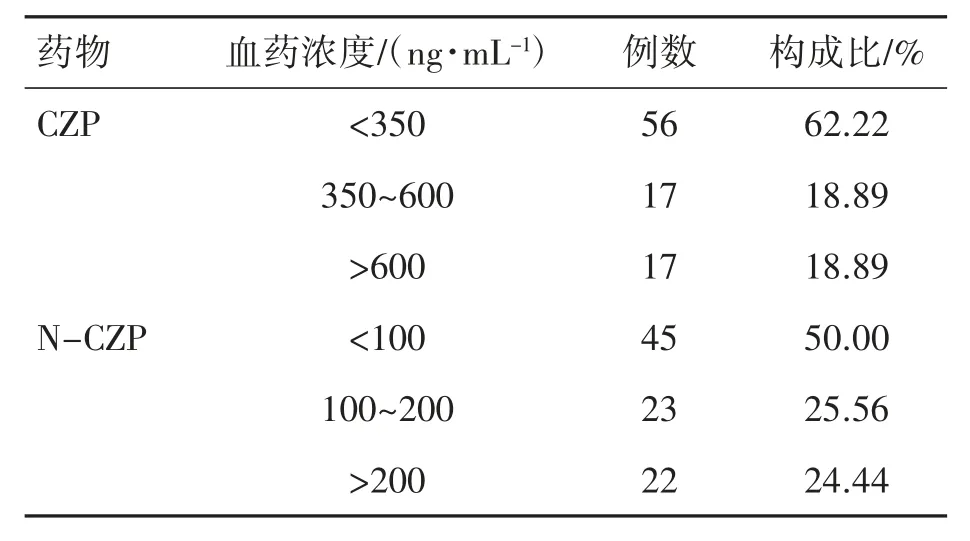
表1 不同患者血药浓度监测结果
2.2 不同年龄、性别及就诊类别患者的血药浓度监测结果比较
对各年龄组患者血药浓度进行监测发现,成年人组与未成年人组CZP、N-CZP平均血药浓度差异均无统计学意义(P均>0.05);90例患者中,女性61例(67.78%),男性29例(32.22%),不同性别精神分裂患者的CZP、N-CZP平均血药浓度差异均无统计学意义(P均>0.05);门诊和住院患者CZP、N-CZP平均血药浓度差异也无统计学意义(P均>0.05),见表2。
表2 不同年龄、性别及就诊类别患者的血药浓度监测结果比较(±s,ng·mL-1)
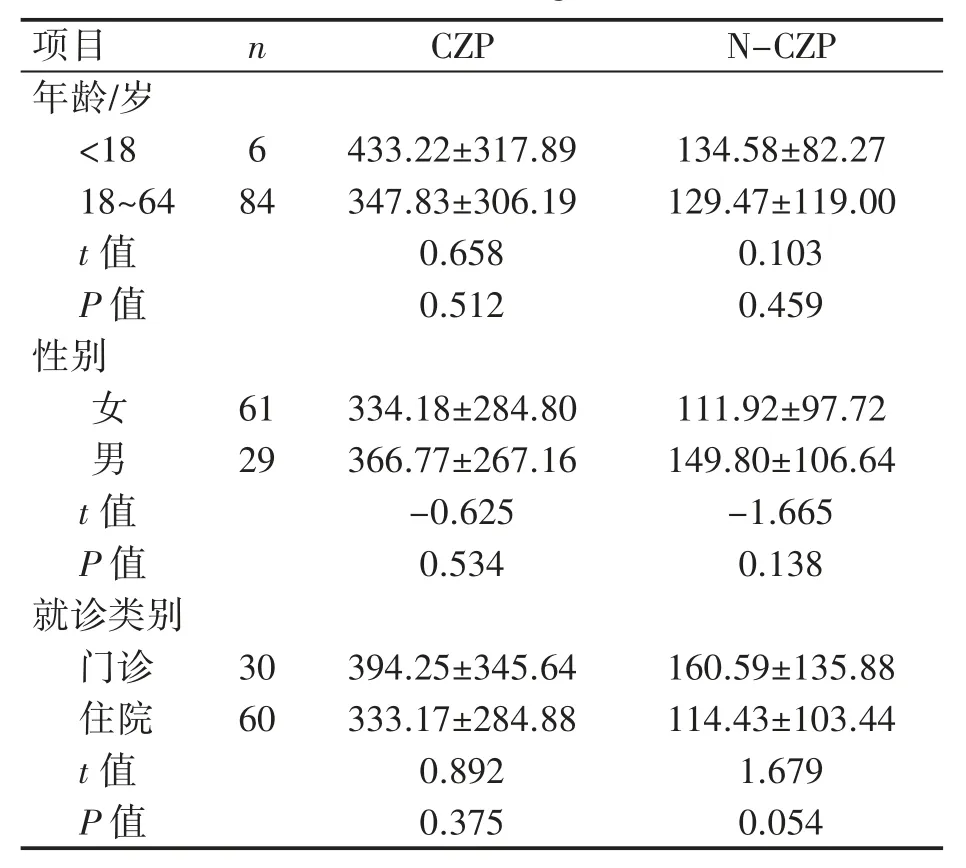
表2 不同年龄、性别及就诊类别患者的血药浓度监测结果比较(±s,ng·mL-1)
?
2.3 不同性别患者CZP与N-CZP比值比较
90例精神分裂患者CZP/N-CZP为(2.72±1.43);N-CZP/CZP为(0.41±0.52)。不同性别精神分裂患者的CZP/N-CZP和N-CZP/CZP差异均无统计学意义(P均>0.05),见表3。
表3 不同性别患者CZP与N-CZP比值比较(±s)

表3 不同性别患者CZP与N-CZP比值比较(±s)
?
3 讨论
目前CZP血药浓度的测定方法有很多种,如气象色谱法(GC)、高效液相色谱法(HPLC)等,国内有报道[8]采取HPLC法同时测定CZP及其代谢物N-CZP血药浓度的方法,但其保留时间较短,同时易受大量内源性物质的干扰,且出峰时间较近,分离度较差。本院采用的检测技术(由湖南德米特有限公司提供)方法稳定,样本处理操作简单,处理和监测1个样本仅需20 min,可以满足急诊快速检测的需求。因专利保护,监测方法及流动相配比均保密。
本实验测得的90例患者的CZP/N-CZP均值符合Georgios等[9]对2 317例成年患者检测CZP/N-CZP的参考值范围,即1.19~3.37;N-CZP/CZP均值为(0.41±0.52),也符合AGNP报道的精神药物代谢产物与原药浓度比值的范围,即0.4~0.7[10],说明本实验结果准确。本文中,90例精神分裂患者CZP血药浓度在治疗窗内者仅占18.89 %,且个体差异较大。因此,应密切关注患者CZP血药浓度的变化情况,调整药物到最佳剂量,以达到较好的疗效,避免不良反应的发生。90例患者中,有5例患者CZP血药浓度超过危急值(>1 000 ng·mL-1),未出现不良反应,说明在临床用药的过程中,部分患者使用剂量过高,这会增加药物不良反应发生的概率,同时还会造成患者对药物的耐受性下降、长期用药依从性差。对于这种患者,需由医师对其给药剂量进行相应调整,在后续的复查中,患者的CZP血药浓度保持在治疗窗内。因此,对血药浓度高于治疗窗者,应定期对其血药浓度进行监测并调整药物剂量。由于CZP的主要不良反应为血液系统改变,其中以对白细胞的影响最为常见[11-12],因此还应观察CZP对患者粒细胞的影响。
本研究未纳入65岁以上老年人的血药浓度数据,因本院血药浓度监测工作刚起步不久,后续将进一步对监测人群进行完善。有研究[13]报道,在相同体质量、日剂量下男性患者CZP的血药浓度低于女性。张昊等[14]研究发现,服用CZP的女性患者吸收程度高于男性。本文研究结果显示,CZP血药浓度在不同性别中无差异,男性CZP平均血药浓度稍高,女性未达到治疗窗范围,因本文为回顾性分析,无法精确统计门诊患者合并用药情况,因此不能明确该结果是否与合并用药有关。
引起CZP血药浓度个体差异的因素很多,除了上述考虑的生理因素外,还应该考虑遗传因素对血药浓度的影响。CZP主要经CYP1A2酶代谢,CYP2C19、CYP3A4、CYP2C9及CYP2D6等也参与CZP的体内代谢[15-17]。N-CZP是CZP的主要代谢产物,对CZP和N-CZP的比值进行比较分析,可评价患者的代谢状态和用药依从性。如果比值超出正常范围,说明可能存在用药依从性问题、因基因变异导致的代谢异常以及可能存在药物相互作用,因此,N-CZP血药浓度也应该受到关注[18]。
综上所述,随着精准药学的逐步发展,个体化用药显得尤为重要,精神类药物大部分是治疗窗窄、毒性作用大的药物,更应该引起关注。临床上在CZP的使用过程中,医师、药师应重视个体化差异,根据患者自身生理条件、临床实际疗效、合并用药以及不良反应发生情况,结合血药浓度监测结果,调整给药剂量,制订个体化的给药方案,力求达到最佳疗效。另外,西北地区精神类药物的血药浓度监测工作开展相对落后,药师应加大宣传力度,加强用药指导,告知患者按医嘱坚持服药的重要性,提高用药依从性,提高临床疗效。

