STING在氟氯氰菊酯诱导大鼠睾丸损伤中的作用
马利亚,赵 吉,李晓玉,谢永鑫,郭 新,杨惠芳
(1.宁夏医科大学公共卫生与管理学院,银川 750004;2.宁夏医科大学环境因素与慢性病控制重点实验室,银川 750004)
农药有导致免疫力下降、诱发慢性疾病、引起肝脏病变及致癌致畸致突变的危害[1]。本课题组前期对银川市近郊蔬菜大棚内农药残留进行检测,发现氟氯氰菊酯的检出率最高[2]。氟氯氰菊酯可对人类构成潜在健康威胁,其暴露可引起神经和生殖系统损伤[3-6]。研究[7-8]发现,拟除虫菊酯可降低精子的浓度、质量以及破坏精子DNA,还可引起成年男性的生殖损伤。本课题组前期研究[9]发现,暴露于氟氯氰菊酯可抑制大鼠睾丸抑制素B(INHB)的表达。INHB由生殖系统细胞分泌,是睾丸生精的主要标记物,反映男性睾丸生精能力[10]。表明氟氯氰菊酯对大鼠睾丸具有一定的毒性作用,但其作用机制尚不明确。
干扰素刺激基因(STING)是在研究天然免疫信号通路过程中发现的新型接头蛋白,在机体抗感染、炎性反应及抗肿瘤等方面都发挥了重要作用。在创伤性脑损伤中,STING表达上调导致促炎性细胞因子表达增加,自噬减少[11]。STING在氟氯氰菊酯所致大鼠睾丸损伤中的机制尚不明确。本研究探讨STING在氟氯氰菊酯诱导大鼠睾丸损伤中的作用,确定农药暴露早期生物标记物,以期为人群健康危险度评估提供基础资料,并为其预防和救治提供一定参考依据。
1 材料与方法
1.1 实验试剂
氟氯氰菊酯(英国Dr.Ehrenstorfer公司);金龙鱼牌玉米油;丙二醛(MDA)试剂盒(北京Solarbio公司)、超氧化物歧化酶(SOD)试剂盒(南京建成生物研究所)、乳酸脱氢酶(LDH)检测试剂盒(北京Solarbio公司);BCA蛋白检测试剂盒(江苏凯基公司);全蛋白提取试剂盒、SDS-PAGE凝胶配制试剂盒(上海碧云天公司);STING一抗(美国Abcam公司);白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、GAPDH一抗(中国Affinity公司);蛋白Marker(Thermo公司);TRIzol(Invitrogen公司);引物由上海生工合成。
1.2 实验动物与分组
40只SPF级雄性Wistar大鼠,体质量270 g左右,购自辽宁昌盛生物技术有限公司,动物合格证号:SCXK(Liao)2015-0001。大鼠饲养于标准动物房,环境温度(22±2)℃,相对湿度为60%~70%,光照(8:30~20:30)和黑暗(20:30~8:30)交替保持12 h,自由饮水和饮食。待大鼠适应环境1周后,最终设置对照组(玉米油)、氟氯氰菊酯低剂量组(6.25 mg·kg-1,低剂量组)、氟氯氰菊酯中剂量组(12.50 mg·kg-1,中剂量组)和氟氯氰菊酯高剂量组(25.00 mg·kg-1,高剂量组),每组10只。对大鼠进行隔天称重,根据前一天称取的体质量配制染毒药物。采用等浓度法进行灌胃染毒,对照组大鼠灌胃等量玉米油,隔天染毒,持续4周。最后用10%水合氯醛麻醉并处死大鼠,在无菌条件下收集睾丸组织。
1.3 检测方法
1.3.1 HE染色 将睾丸组织从10%的福尔马林溶液中取出,并在通风橱中用手术刀切割。组织的厚度约为3 mm。将修剪好的组织和相应的标签放入脱水箱,在75%、85%、90%和95%的乙醇梯度中脱水1 h,在无水乙醇1中脱水30 min,无水乙醇2中脱水30 min,随后置于二甲苯1和二甲苯2中分别脱水5 min。经过包埋、切片和染色后,用显微镜(20×)观察睾丸组织的结构变化。
1.3.2 透射电镜 取体积为3 mm×1 mm×1 mm的新鲜睾丸组织,迅速放入4℃的电镜固定液中2~4 h,室温(20℃)下在1%渗透压0.1 mol·L-1磷酸盐缓冲液PB(pH 7.4)中固定2 h。组织先后经过50%→70%→80%→90%→95%→100%→100%乙醇→100%丙酮脱水,每次15 min;环氧树脂包埋,将样本插入包埋板中,置于37℃烘箱过夜,60℃烘箱聚合48 h;超薄切片机切60~80nm超薄切片;铀-铅双重染色(2%乙酸铀酰饱和乙醇溶液,柠檬酸铅,每次染色15 min),切片在室温下干燥过夜。在透射电子显微镜下观察,采集图像进行分析。
1.3.3 乳酸脱氢酶(LDH)活性检测 选用LDH检测试剂盒检测细胞膜的损伤程度。称取不同组的大鼠睾丸组织约0.1 g,加入200 μL生理盐水进行冰浴匀浆;2 500 r·min-1离心20 min,取上清液,置于冰上,酶标仪预热后在450 nm处检测OD值,按公式LDH活力(U·gprot-1)=(OD测定-OD对照)/(OD标准-OD空白)×0.2(μmol·mL-1)/待测样本蛋白浓度(gprot·mL-1)计算,实验均重复3次。
1.3.4 丙二醛(MDA)检测 称取约0.1 g组织,加入1 mL提取液进行冰浴匀浆;8 000×g、4℃离心10 min,取上清液,置冰上待测。根据MDA试剂盒说明进行加样,分别测定各样本在450 nm、532 nm和600 nm处的吸光度,按照公式MDA含量(nmol·g-1)=5×[12.9×(ΔA532-ΔA600)-2.58×ΔA450]计算,实验均重复3次。
1.3.5 超氧化物歧化酶(SOD)检测 称取约0.1 g组织,加入0.9 mL生理盐水,剪碎组织进行冰浴匀浆;2 500 r·min-1离心10 min,取10%匀浆上清液置冰上待测。样本准备好后用BCA试剂盒测定蛋白浓度。根据SOD试剂盒说明进行操作,测定各样本在450 nm处的OD值。SOD抑制率(%)=[(A对照-A对照空白)-(A测定-A测定空白)]/(A对照-A对照空白)×100%,SOD活力(U·mgprot-1)=SOD抑制率(%)/50%×12/待测样本蛋白浓度(mgprot·mL-1),实验均重复3次。
1.3.6 Western blot检测 根据蛋白提取试剂盒提取睾丸组织总蛋白并采用BCA法测定蛋白浓度。变性后取10 μg总蛋白上样,经SDS-PAGE凝胶电泳、转膜后,3%BSA封闭1 h,于1∶1 000稀释的一抗中4℃孵育过夜,经TBST洗涤3次,10 min/次,再于1∶1 000稀释的二抗室温孵育1 h,TBST清洗3次,10 min/次,滴加ECL发光液曝光。并采用Image J软件进行灰度值分析。根据内参(GADPH)标准计算目标条带相对值,判断蛋白相对表达水平。
1.3.7 q-PCR检测 取出冷冻睾丸组织置于冰上,根据TRIzol法提取总RNA,逆转录合成cDNA。扩增条件为:95℃预变性5 min,95℃变性10 s、60℃退火30 s、60℃延长30 s,45个循环。反应结束后,根据扩增曲线数据,每个样品重复试验3次。分析扩增曲线后计算2-ΔΔCt,分析相关因子的mRNA表达水平。
1.4 统计学方法
实验数据经SPSS 21.0软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析(one-way ANVOA),两两比较采用Dunnett-t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 氟氯氰菊酯对大鼠睾丸损伤的影响
2.1.1 病理切片观察大鼠睾丸中细胞形态 对照组中,大鼠睾丸的生精小管分界清楚,排列相对松散,腔内的支持细胞和生精细胞排列紧密,分界清晰,无异常;氟氯氰菊酯各剂量组中大鼠睾丸内支持细胞和生精细胞形状不规则,数量减少,且随着染毒剂量的增加变化越明显(图1)。
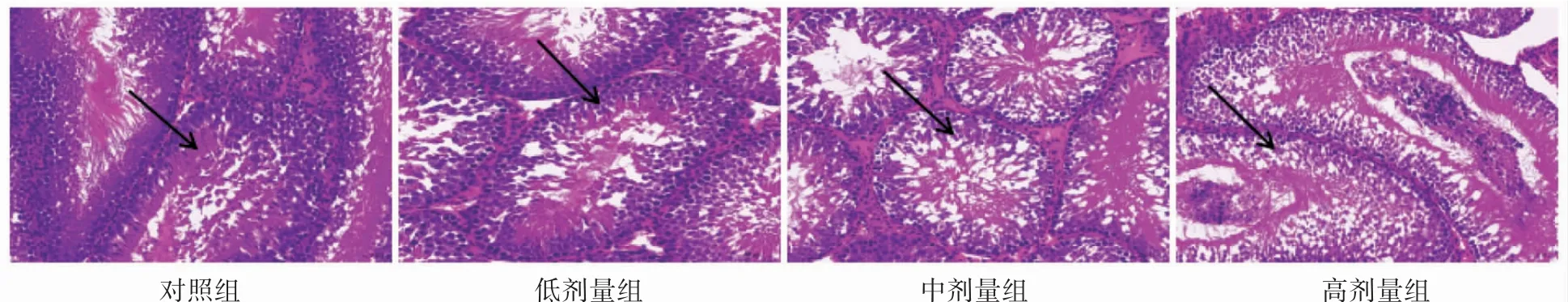
图1 各组大鼠睾丸中的细胞形态病理切片(HE×20)
2.1.2 透射电镜观察大鼠睾丸超微结构变化 对照组大鼠睾丸中精子细胞膜完整,细胞器丰富,细胞核呈圆形,核膜完整清晰,染色质均匀分布,顶体连续完整,线粒体丰富且均匀分布;氟氯氰菊酯低剂量组的精子细胞表现为轻度水肿,细胞膜完整,圆核,核膜完整,染色质分布均匀,顶体连续且完整,线粒体轻微肿胀;氟氯氰菊酯中剂量组精子细胞中度水肿,细胞膜完整,细胞核不规则,染色质稀疏,核膜部分上浮,核周间隙增宽,顶体结构完整,线粒体中度肿胀;氟氯氰菊酯高剂量组精子细胞出现严重的水肿、空泡化,细胞核不规则,染色质稀疏,核膜与顶体均不清晰,线粒体严重肿胀,嵴呈管状泡状,局部膜基质变浅,呈空泡状(图2)。
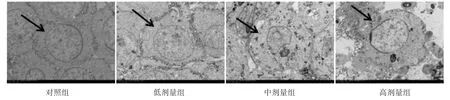
图2 透射电子显微镜观察氟氯氰菊酯暴露对大鼠睾丸细胞影响(5 μm)
2.2 细胞损伤及氧化应激损伤指标检测结果
与对照组相比,中、高剂量组LDH含量均增加(F=12.87,P<0.05),低、中、高剂量组MDA含量均升高(F=9.465,P<0.05),中、高剂量组SOD活力降低(F=12.42,P<0.05),见图3。

图3 氟氯氰菊酯染毒后大鼠睾丸中LDH、MDA及SOD的变化
2.3 氟氯氰菊酯染毒大鼠后对睾丸中STING和炎症的影响
q-PCR与Western blot结果均显示,与对照组相比,低、中、高剂量组STING、IL-6与TNF-α的mRNA和蛋白表达水平均上调(P均<0.05),见图4。
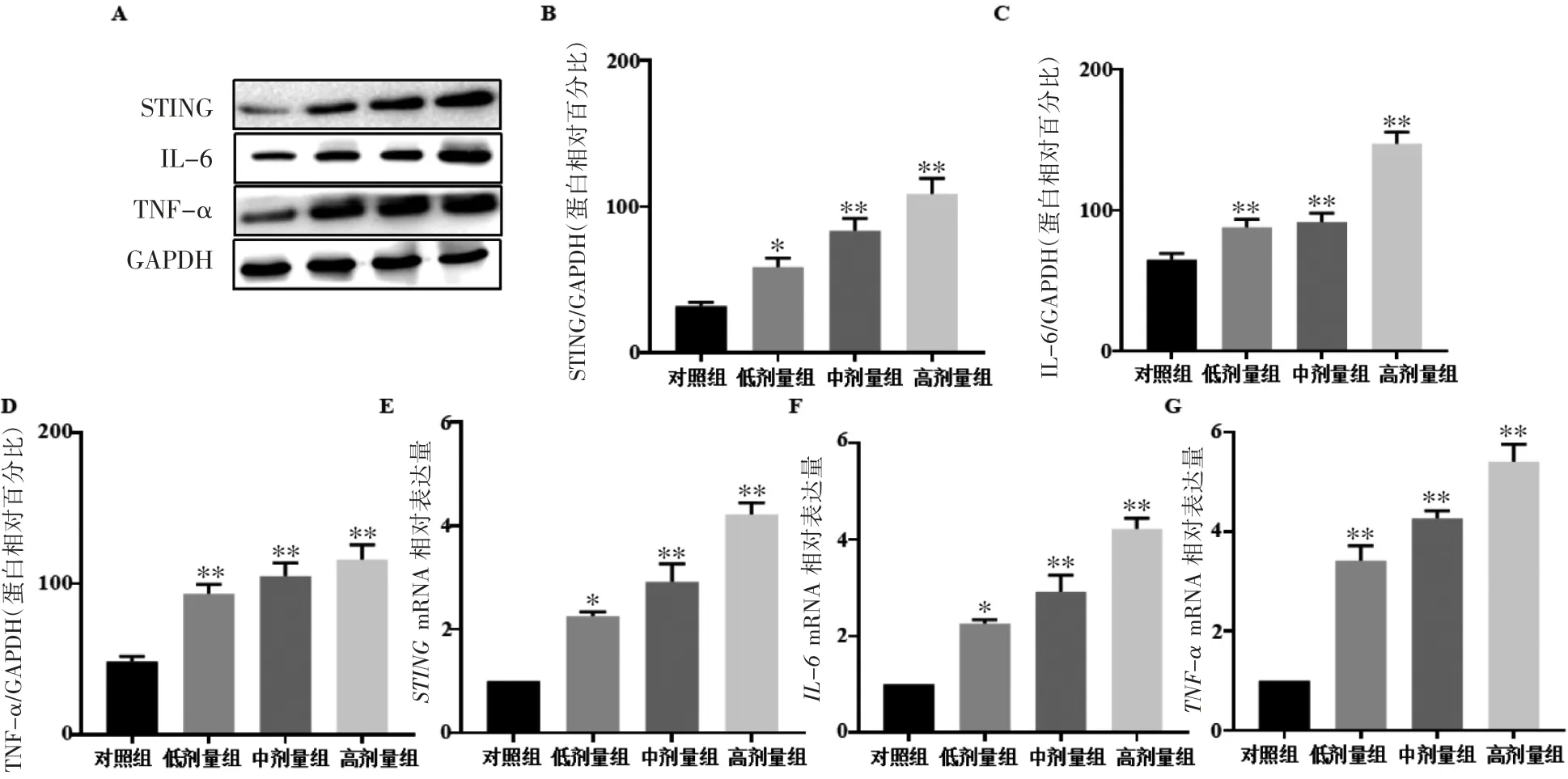
图4 氟氯氰菊酯染毒后大鼠睾丸中STING、IL-6与TNF-α的表达变化
3 讨论
拟除虫菊酯是高效、低毒、低残、广谱的环保型农药,在全世界范围内广泛应用,其低毒性和长期使用危害越来越引起人们的注意。拟除虫菊酯及其代谢物在人类母乳和尿液等样本中已被检测到[12],对人类健康构成了威胁。现有研究[13]表明,拟除虫菊酯对神经系统、肝脏、肾脏和男性生殖系统有不良影响。拟除虫菊酯类杀虫剂通过改变生殖激素的水平从而对睾丸激素水平产生不利的影响[14-15]。此外,拟除虫菊酯杀虫剂能降低精液的浓度和活性,增加异常精子的数量[16]。同时,拟除虫菊酯通过破坏男性生殖器官的结构和功能,从而损害男性生殖健康[17]。氯氰菊酯和溴氰菊酯对睾丸的损害体现在精子数量、精子活力、精子形态和睾丸激素水平上。有研究[4]发现,氟氯氰菊酯能引起精子的形态异常与死亡。本实验通过HE染色在显微镜下观察发现,随着氟氯氰菊酯剂量的增加,生精细胞和支持细胞的数量逐渐减少,这与Sharma等[5]的研究结果一致,即氟氯氰菊酯暴露导致睾丸中的精子数量明显减少。Taib等[6]研究发现,低毒倍硫磷可导致大鼠睾丸中的精子细胞肿胀,线粒体数量增加,并出现脂滴。这说明氟氯氰菊酯对大鼠睾丸超微结构造成了损伤,与本课题组前期研究结果一致[9]。
自噬伴随着细胞膜的破裂[18]。通常情况下,LDH只存在于活细胞中,当细胞膜受损时,LDH会从细胞膜上释放出来,因此根据游离LDH的水平可以间接评估细胞的损伤程度。本研究通过检测LDH的活性来验证氟氯氰菊酯对大鼠睾丸的毒性,发现低、中剂量组的LDH活性并未增加,可能是由于灌胃周期较短,低剂量的氟氯氰菊酯诱导了细胞的异常增殖,但细胞膜尚能维持正常功能。
ROS与糖尿病、肾损伤等多种疾病密切相关[19]。睾丸结构和功能的恶化会直接影响精子生成。在男性不育的发病机制中,ROS起着重要作用[20]。据报道[21],ROS会破坏男性和女性生殖细胞的结构,导致其功能紊乱。在正常情况下,人体保持氧化-抗氧化剂平衡的机制。SOD是体内重要的抗氧化酶,可清除体内释放的过多自由基,减少细胞膜的损伤。MDA是间接反映人体的氧化损伤的指标[22]。作为影响精子功能的信使之一,精子从睾丸到卵细胞的过程中,低水平的ROS可以调节精子功能,促进精子获能,并调节精子的成熟[23]。在精子获得受精的过程中,低水平的ROS是必不可少的。Aitken等[24]首先提出了低水平的ROS可以调节精子的生理功能,并发现精子与透明带结合的能力可以通过低水平的ROS来增强,这表明低水平的ROS可能对精子产生好的影响。然而,人类的精子特别容易受到氧化损伤,而且ROS的产生和抗氧化能力之间的不平衡将导致男性不育[25-26]。有研究[27]显示,通过对比不育与可育男子精子中的氧化水平,发现ROS的过度产生会对精子造成损害。本研究结果表明,随着氟氯氰菊酯浓度的增加,MDA水平增加,SOD水平减少,这说明氟氯氰菊酯染毒后大鼠睾丸组织氧化应激水平增加,发生氧化性损伤。
STING作为固有免疫系统的一个关键性接头蛋白,在宿主抵御外界病原菌的入侵中发挥了重要作用,同时STING又具有炎症分子的特征,与机体的炎性反应密不可分。STING最初作为一个免疫炎性因子被报道,有研究[28]发现细胞内氧化应激增加可以激活STING,活化后的STING可以促进体内炎症反应的发生。同时它可以调控肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)等炎症因子的表达[29-30]。在百草枯诱导小鼠急性肺损伤中,STING表达水平升高[11]。在本研究中,STING、IL-6及TNF-α的表达水平均随染毒剂量的升高而上调。结合之前的实验结果,说明在氟氯氰菊酯染毒后大鼠睾丸发生氧化损伤并伴随炎性反应的产生,与沈艾[31]的研究结果一致。
综上所述,氟氯氰菊酯具有一定的生殖毒性,STING可能通过正向调控炎性因子TNF-α与IL-6的表达促进大鼠睾丸炎性反应。在结直肠癌中,STING可能通过抑制AMPK并促进mTOR相关通路进而进一步抑制mTOR下游重要靶点S6K1的磷酸化[32],猜测可能因为STING能够抑制AMPK介导的自噬信号通路从而发挥调控作用。因此后续将进一步探讨STING及AMPK/mTOR/P70S6K介导的自噬通路在氟氯氰菊酯诱导大鼠睾丸损伤中的作用。

