SARS-CoV-2核酸检测试剂盒的制备及样本混检性能分析
钊倩倩,刘双双,周云英,史桂芝,汪运山*
(1.山东大学附属济南市中心医院 医学实验诊断中心,山东 济南 250013;2.山东英盛生物技术有限公司 研发中心,山东 济南 250100)
新型冠状病毒(novel corona virus, severe acute respiratory syndrom corona virus 2,SARS-CoV-2),属于冠状病毒科β属[1],跨物种传播引起2019冠状病毒疾病(corona virus disease 2019, COVID-19)[2-3],对全球的公共卫生安全造成极大威胁。病毒核酸阳性被作为SARS-CoV-2感染的确诊依据之一[4],而荧光RT-qPCR依其成本低、操作流程简单、易批量化等优点成为核酸检测的主流技术[5]。目前为了应对大规模人群SARS-CoV-2核酸筛查,提高检测效率,国务院及国家卫生健康委员会分别颁布了关于多样本混合检测的工作手册及技术规范,分单采混检和混采单检两种方式。由于混检会降低病毒浓度,对试剂灵敏度要求更高。市售核酸检测试剂盒性能良莠不齐,一直存在“假阴性”质疑,对混检样本的检测效果未见报道。本研究拟优化荧光RT-qPCR体系中不同靶基因扩增效率,开发适用于大规模人群筛查的核酸检测试剂盒,并考察临床多样本混合检测效果。
1 材料与方法
1.1 材料
1.1.1 引物和探针:ORF1ab和N靶基因扩增引物及探针序列源自中国疾病预防控制中心(Chinese Center For Disease Control And Prevention, CCDC),RNaseP(ribonuclease P)作为内标基因(表1)。引物配制成浓度为20 μmol/L的溶液,探针配制浓度为10 μmol/L的溶液。

表1 SARS-CoV-2 RT-qPCR引物及探针序列
1.1.2 临床样本:新型冠状病毒样本及常见呼吸道病毒样本均为鼻咽拭子,来自济南市中心医院及当地疾控部门。其中阳性样本为临床确诊病例并经国家药监局批准的试剂盒检测为核酸阳性。样本采集后放入3 mL病毒保存液中,并-70 ℃保存备用。样本的收集及使用均获得医院伦理委员会批准(批准号:2020-053-01)。
1.1.3 试剂:反转录酶、Taq酶及PCR反应MIX(南京诺维赞生物科技有限公司);RNA磁珠法提取试剂盒(上海之江生物科技股份有限公司);参比试剂盒:Kit-B(上海伯杰医疗科技有限公司)、Kit-S(硕世生物科技股份有限公司)及Kit-Z(北京卓诚惠生生物科技股份有限公司)均为市售主流产品。
1.2 方法
1.2.1 病毒RNA的提取与处理:磁珠法提取鼻咽拭子样本的病毒RNA,提取步骤及样本用量参照试剂盒说明书。RNA提取后-70 ℃保存备用。
1.2.2 试剂盒引物及探针浓度优化:单靶基因引物浓度优化:采用单一变量原则分别优化每一个靶基因引物浓度。25 μL的扩增体系中,缓冲液、反转录酶及扩增酶使用量按照说明书添加,加入5 μL含靶基因的重组质粒(1 copy/μL)作为模板(本实验室构建),加入200 nmol/L探针,分别加入240~800 nmol/L的等量正向及反向扩增引物。
引物浓度配比优化:按照3因素四水平设计正交实验优3个靶基因的引物浓度配比。分析每组扩增曲线的Ct值。
探针浓度优化:在25 μL反应体系中,分别加入200、320及400 nmol/L 3种浓度的探针,观察荧光PCR扩增曲线和Ct值。
1.2.3 试剂盒扩增参数:ABI7500荧光定量PCR仪按照如下程序进行扩增:反转录:50 ℃ 15 min;预变性:95 ℃ 5 min;变性、退火、延伸:[95 ℃ 10 s→60 ℃ 30 s(检测荧光)]×40循环。ORF1ab、N及RNaseP3个靶基因的检测通道分别为FAM、VIC及ROX。
1.2.4 试剂盒性能分析:准确性验证:提取107例新型冠状病毒阴性标本(其中男性55例,女性52例,年龄4~90岁,具有发热症状者28例,仅咳嗽或其他呼吸道症状者79例)及12例SARS-CoV-2阳性标本的病毒RNA,以获得国药监局批准的试剂盒作为参比试剂盒检测SARS-CoV-2核酸,计算阳性、阴性及总符合率。
特异性验证:检测10种常见的呼吸道病原体阳性且经市售试剂盒检测新型冠状病毒核酸为阴性的鼻咽拭子样本,分析检测结果是否为阴性。
灵敏度分析:梯度稀释已知浓度的阳性参考品,每个浓度重复测定20次,以ORF1ab和N同时检出作为阳性判定标准,统计各浓度样本检出的阳性个数。以95%阳性检出率的浓度值作为试剂盒的检出限,即灵敏度。
1.2.5 临床多样本混合检测效果分析:阳性样本与阴性样本按1/5、1/10、1/20、1/40及1/80比例混合[阳/(阳+阴)],磁珠法提取病毒RNA。以灵敏度与本试剂盒相同的3种市售试剂盒Kit-B、Kit-S及Kit-Z作为参比,检测SARS-CoV-2核酸,每种浓度重复检测3次。分析全部检出阳性结果的最高混检比例及扩增Ct值。
1.3 统计学分析

2 结果
2.1 试剂盒的多靶标引物浓度优化结果
单一变量优化得到每个靶基因的引物浓度范围均为320~800 nmol/L。正交实验中,ORF1ab、N的Ct值随引物浓度增加而降低,RNaseP的Ct值受引物浓度影响不明显(图1B)。3个靶基因的均值效应极差值(Mean-value effect)趋势为ORF1ab(delta=3.00)>N(delta=1.43)>RNaseP(delta=0.33)(图1A),提示ORF1ab引物浓度变化对扩增结果影响最大。在保持3个靶基因扩增效率相似的基础上,以ORF1ab扩增效率为主要因素进行优化,获得ORF1ab、N及RNaseP的引物浓度配比为640、800及400 nmol/L(图1C)。
ORF1ab和N的荧光信号强度随探针浓度的提高而增强(图1D),当探针浓度≥320 nmol/L时,荧光强度不再有明显的变化;而RNaseP的荧光信号强度变化不大。因此ORF1ab、N和RNaseP探针浓度分别为320、320及200 nmol/L。
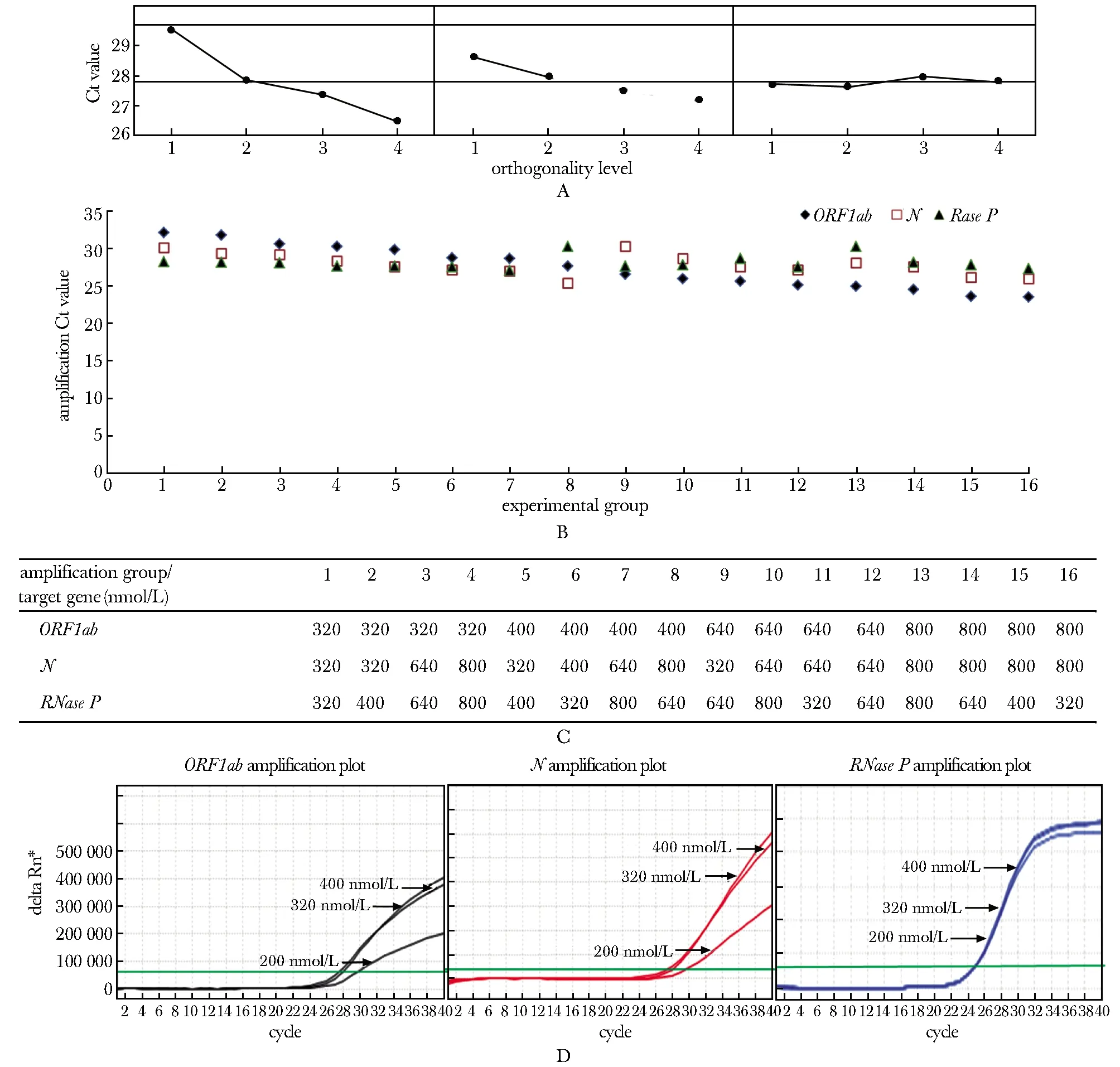
A.mean-value effect of different target genes; B.amplification Ct value of RT-qPCR under different primers concentration; C.experiment groups of different primers concentration; D.amplification curve of RT-qPCR with different probes concentration; delta Rn*.changes in fluorescence from the previous cycle
2.2 试剂盒的准确性及特异性验证结果
准确性:本试剂盒(命名为Kit-Y)对12例阳性标本检测结果全部为阳性,对107例阴性标本的检测结果全部为阴性,阳性、阴性及总符合率均为100%(表2)。

表2 试剂盒Y准确性验证结果
特异性:Kit-Y对甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、肺炎支原体、结核分枝杆菌、肺炎链球菌、肺炎克雷伯菌、流感嗜血杆菌、EB病毒、巨细胞病毒共10种病原菌的阳性标本的检测结果均为阴性(NoCt),分析特异性为100%(表3)。
表3 试剂盒Y特异性验证结果
灵敏度:阳性定值参考品按梯度稀释为1×105、1×104、1×103和1×102copies/mL,每个浓度重复测定20次的阳性检出结果如表4。模板浓度为1×103copies/mL时,20个阳性样本检出19个,阳性检出率为95%,符合灵敏度定义,因此Kit-Y检测灵敏度为1×103copies/mL。
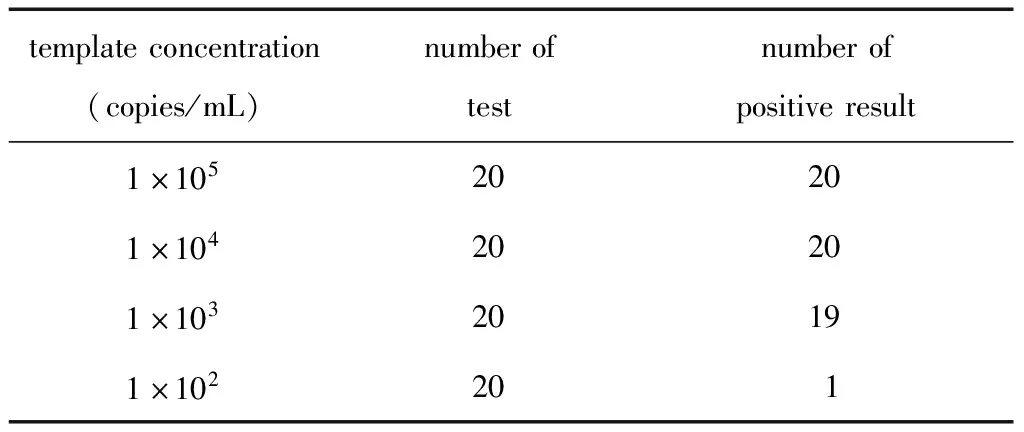
表4 试剂盒Y灵敏度分析结果
2.3 临床多样本混合检测结果
多样本混合检测Kit-Y对ORF1ab的检出限低于市售试剂盒(图2)。当混合比超过1/10时,3个参比试剂盒均无法检测到ORF1ab,而Kit-Y对其检出限可低至混合比例1/20(P<0.01)(图2A);Kit-Y对N基因的检出限与Kit-B及Kit-S相比差异无统计学意义(1/10),但低于Kit-Z(P<0.01);两个靶基因的扩增Ct值均随模板浓度降低而增大,相同模板浓度时,Kit-Y对ORF1ab的扩增Ct值低于3种参比试剂盒(P<0.05)(图2B),Kit-Y与Kit-S对N基扩增Ct值在不混合样本模板浓度下分别为31.74及35.5,差异显著(P<0.05),Kit-Y与其余两个试剂盒的Ct值的差异无统计学意义。

A.template dilution range of different target genes; B.amplification Ct values with same template concentration; *P<0.01,**P<0.05 compared with Kit-Y group
3 讨论
以荧光RT-qPCR技术为基础的新冠病毒核酸检测试剂在临床使用中多次出现假阴性的结果,甚至是个别病例还出现在不同时间5次以上结果阴性后又转阳的现象[6]。这种现象的出现具有多方面的原因:标本的采集部位或手法不当造成病毒采集量不足;标本保存及运输过程不当造成病毒降解等,而试剂的检测性能尤其是灵敏度不足则是造成假阴性结果的主要实验室原因。在本文中,3个靶基因扩增效率分析结果表明ORF1ab的扩增效率受引物浓度影响最大。以荧光PT-PCR技术为基础的核酸检测中,ORF1ab是检测结果判为阳性的必要条件,其检测灵敏度的提高,对于降低检测结果的假阴性具有重要意义。
由于多样本混检只进行初步筛查,任意一个靶标检测出阳性就需要对本组样本单个复检,因此单靶标的高灵敏度在样本混合检测过程中会更具有优势。用9~10个样本一组混检的方式对292组混合样本,通过单靶标(E)的筛查出的两组阳性样本,均得到了双靶标(E/ORF1ab)的复检及测序验证[7]。Kit-Y及Kit-Z均具有一个高灵敏靶标,在样本混合检测过程中会更具有优势。
有效的多样本混合检测试剂盒的开发及应用对大规模人群筛查具有重要意义。目前大多数试剂盒中的引物及探针序列都来源于中国疾病预防控制中心(CDC)或世界卫生组织(WHO)的公布数据[8-9],本文研究发现使用相同引物来源的检测试剂仍有不同的检测性能,比如在选择10个样本进行混合检测时,不同品牌的检测试剂出现不同的检测结果。差异原因可能是由于不同品牌试剂盒在缓冲体系成分、引物浓度、酶浓度及扩增条件等方面均存在差异而导致的。因此在实际应用中,对于检测试剂盒的灵敏度及样本的混合数量均需要预先进行分析确认以防止漏检错检的发生。

