基于细胞焦亡与炎症反应相关基因构建肝细胞癌预后风险评估模型及验证
应乐倩 王德强 余晖 李小琴
肝细胞癌恶性程度高、预后差,且其发病率在全球范围内居高不下[1]。免疫检查点抑制剂的出现为肝细胞癌的治疗开辟了新途径,但由于缺乏理想的靶点,因此治疗上缺乏个体化的用药指导。同时,细胞焦亡这一新的细胞死亡方式被揭示,其本质上是一场机体的“炎症风暴”,可激活免疫反应[2]。研究显示细胞焦亡与胃癌、肺癌以及结直肠癌等疾病有关,能影响抗肿瘤药物的疗效[3-8]。因此,本文基于细胞焦亡与炎症反应相关基因构建肝细胞癌预后风险评估模型,得到细胞焦亡与炎症反应评分(pyroptosis and inflammatory response score,PIRS),并进一步探索PIRS对肿瘤微环境(tumor microenvironment,TME)状态的预测效能,以期为肝细胞癌的预防和诊治提供新思路和新靶点。
1 材料和方法
1.1 数据来源 mRNA数据和临床信息从癌症基因组图谱(the cancer genome atlas,TCGA)数据库(https://cancergenome.nih.gov)和国际癌症基因组联盟(international cancer genome consortium,ICGC)数据库(https://dcc.icgc.org/projects/LIRI-JP)获得[9]。纳入标准:(1)可通过mRNA数据计算PIRS;(2)符合肝细胞癌病理诊断;(3)年龄、性别、总生存期(overall survival,OS)、组织学分级以及病理学分期等临床数据完整。最终从TCGA数据库和ICGC数据库分别筛选出365例和231例肝细胞癌患者。查阅相关文献提取细胞焦亡相关基因[3-8],并从基因集富集分析(gene set enrichment analysis,GSEA)数据库(http://www.gsea-msigdb.org/gsea/index.jsp)下载炎症反应基因集。
1.2 肝细胞癌预后风险评估模型构建 使用R语言的limma包提取出TCGA数据库中245个细胞焦亡和炎症反应基因的mRNA数据。采用单变量Cox回归分析筛选与OS显著相关基因,计算HR和95%CI。通过Kaplan-Meier生存分析得到其最佳截断值,将mRNA数据进行二分类转换:低表达组为0,高表达组为1。最小绝对收缩和选择算子(least absolute shrinkage and selection operator,Lasso)Cox回归分析得到回归系数,其绝对值定为>0.2,构建由15个基因组成的肝细胞癌预后风险评估模型。通过模型公式计算出PIRS,并通过其在TCGA数据库的中位值(0.2)分别将TCGA数据库和ICGC数据库中患者分为高风险组和低风险组。
1.3 模型的有效性验证 Kaplan-Meier生存分析比较两组患者的预后。通过AUC比较PIRS预测患者预后的准确性。通过prcomp函数进行主成分分析(principal components analysis,PCA),对高低风险样本分类进行降维模拟。通过单因素和多因素Cox回归分析研究PIRS与肝细胞癌临床病理特征间的关系。
1.4 评估TME状态以及机制探索 通过单样本GSEA(single sample GSEA,ssGSEA)计算出免疫浸润细胞的含量和免疫相关通路的活性[10]。基于肿瘤免疫功能障碍与逃逸(tumor immune dysfunction and exclusion,TIDE)网站(http://tide.dfci.harvard.edu/)已有的免疫治疗数据,上传肝细胞癌患者表达谱数据预测TME的状态。通过前期收集TCGA数据库的免疫景观图谱,研究者已将所有TCGA样本分为C1~C6免疫亚型[11],分别为创伤愈合型、IFN-γ为主型、炎症反应型、淋巴细胞耗竭型、免疫沉默型和转化生长因子β(transforming growth factor-β,TGF-β)为主型。从分子标签数据库网站(http://www.gsea-msigdb.org/gsea/msigdb/index.jsp)下载京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)和基因本体论(gene ontology,GO)数据库,通过GSEA提取细胞焦亡与炎症反应相关的信号通路以及生物学功能。
1.5 统计学处理 采用R 4.0.3(www.r-project.org)统计软件。基因表达与患者预后的关系分析采用Kaplan-Meier生存分析,两组生存率比较采用logrank检验。不同临床病理分期患者的基因表达水平比较采用单因素与多因素Cox回归分析。计量资料两两比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 肝细胞癌预后风险评估模型的构建 在TCGA数据库中,通过对245个细胞焦亡与炎症反应基因的mRNA数据进行单变量Cox回归分析和Kaplan-Meier生存分析比较预后,筛选出与OS显著相关的62个基因(P<0.05,图1a,见插页)。因为速激肽受体3(tachykinin receptor 3,TACR3)基因的HR值高达211,为排除不同数据库之间存在的测量误差,TACR3基因不参与预后模型的构建。采用Lasso Cox回归分析确定15个基因参与模型构建(图1b,见插页),其中C-C基序趋化因子受体(C-C motif chemokine receptor 7,CCR7)、颗粒酶 A(granzyme A,GZMA)、HPN(hepsin)、白细胞介素18受体辅助蛋白(interleukin 18 receptor accessory protein,IL-18RAP)、白细胞介素7受体(interleukin 7 receptor,IL-7R)和核苷酸寡聚结构域样受体家族含pyrin结构域 6(the nucleotide oligomerization domainlike receptor family pyrin domain containing 6,NLRP6)为保护因素;而C-C基序趋化因子配体20(C-C motif chemokine ligand 20,CCL20)、GSDMC(gasdermin C)、早老蛋白-1(presenilin-1,PSEN1)、金属蛋白酶 α(meprin α,MEP1A)、核苷酸寡聚结构域 2(nucleotide oligomerization domain 2,NOD2)、整合素亚基 α5(integrin subunit α5,ITGA5)、ras同家族 G(ras homolog family G,RHOG)、集落刺激因子3受体(colony stimulating factor 3 receptor,CSF3R)和白细胞介素15受体亚基α(interleukin-15 receptor subunit α,IL-15RA)为危险因素(图1c,见插页)。根据模型公式计算每个患者的风险评分:PIRS=(-0.452)×CCR7 值+(-0.404)×GZMA 值+(-0.561)×HPN 值+(-0.710)×IL-18RAP 值+(-0.514)×IL-7R 值+(-0.385)×NLRP6 值+(0.332)×CCL20 值+(0.402)×GSDMC 值+(0.419)×PSEN1+(0.445)×MEP1A值 +(0.515)×NOD2 值 +(0.516)×ITGA5 值 +(0.601)×RHOG 值+(0.602)×CSF3R 值+(0.759)×IL-15RA 值。

图1 肝细胞癌预后风险评估模型构建相关图(a:预后相关差异基因森林图;b:15个基因的部分似然偏差图和系数;c:15个基因mRNA表达热图)
2.2 PIRS对肝细胞癌患者预后的评估及验证 在TCGA数据库中,高风险组患者预后较差,其中位OS明显低于低风险组(P<0.01,图2a,见插页)。随着PIRS升高,肝细胞癌患者OS明显缩短(图2b,见插页),PIRS的中位值可以将患者分为高、低风险两组(图2c,见插页)。通过随时间变化的ROC曲线,PIRS的 AUC 值在 1、2、3年分别为 0.871、0.846和 0.831(图2d,见插页)。
同时,经外部ICGC数据库验证,相比低风险组,高风险组患者预后较差(P<0.01,图2e,见插页)。PIRS与OS生存状态的动态分布图和PCA结果如图2f、g所示,在验证数据库中得到一致的结果。AUC值在1、2、3年时分别为 0.844、0.733和 0.751(图 2h,见插页),证明PIRS对预测肝细胞癌患者的预后具有较高的准确性。

图2 PIRS对肝细胞癌患者预后的评估及验证(a、e:PIRS与预后的关系;b、f:PIRS与总生存期散点图;c、g:主成分分析分布图;d、h:ROC 曲线图)
2.3 PIRS与临床病理指标预测患者预后的有效性比较 临床病理指标在患者预后的评估上有指导意义,但现有的指标不足以满足临床个体化治疗的需求,需进一步完善预后评估体系。在TCGA数据库中,通过单因素Cox回归分析,肿瘤的病理分期和PIRS与预后相关(P<0.05);多因素回归分析显示,PIRS是患者预后的独立预测指标(HR=2.802,95%CI:2.286~3.433,P<0.01,图 3a);病理分期处于晚期(Ⅲ~Ⅳ期)患者的PIRS较Ⅰ~Ⅱ期明显升高(图3b)。根据AUC结果提示,相比现有的临床病理指标,PIRS对预后预测的有效性更高(AUC=0.870>0.643,图 3c)。
通过ICGC数据库进行验证,单因素Cox回归显示,患者性别、肿瘤病理分期和PIRS与预后有关(P<0.05);多因素回归分析显示,PIRS为患者预后的独立预测指标(HR=1.873,95%CI:1.427~2.460,P<0.01,图3d)。病理分期处于晚期(Ⅲ~Ⅳ期)患者的PIRS较Ⅰ~Ⅱ期明显升高(图3e)。相比临床病理指标,PIRS对预后预测有更高的有效性(AUC=0.844>0.767,图3f)。说明PIRS预测肝细胞癌患者预后的有效性不亚于现有的临床病理指标,具有临床价值。
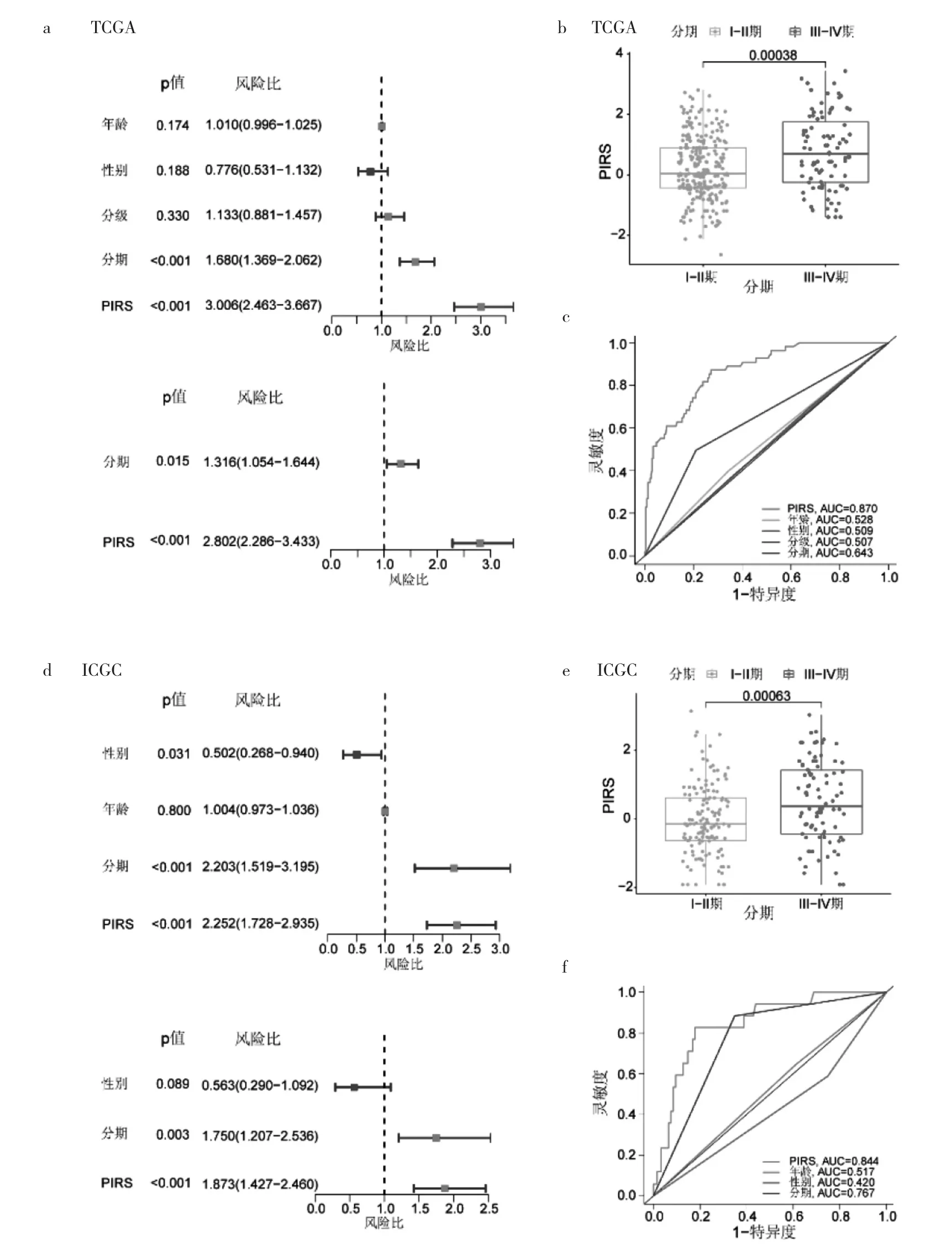
图3 肝细胞癌预后风险评估模型的独立预后分析(a、d:单因素与多因素Cox回归分析结果图;b、e:PIRS与病理分期关系;c、f:PIRS与临床指标ROC曲线图)
2.4 PIRS评估TME免疫浸润状态 在TCGA数据库中,高风险组的B细胞、CD8+T细胞和自然杀伤(NK)细胞含量均明显低于低风险组(均P<0.01),但高风险组中巨噬细胞含量高于低风险组(P<0.01);上述结果在ICGC数据库中均得到验证(图4a、b)。同时,通过TIDE对TCGA数据库的mRNA数据进行计算,高风险组中T细胞驱逐(exclusion)评分和免疫功能障碍相关的TIDE预测评分相比低风险组均明显升高(均 P<0.01,图 4c、d)。综上,高风险组的 TME处于“冷肿瘤”状态,是肝细胞癌患者免疫系统被抑制的重要因素。
高风险组患者发生的免疫抑制可能与T细胞的细胞毒性减弱以及干扰素反应性减低有关。在TCGA数据库中,高风险组细胞毒性通路、免疫促进通路、T细胞共刺激通路以及Ⅱ型干扰素反应通路的活性均低于低风险组(均P<0.01,图4e)。在ICGC数据库中,高风险组的Ⅰ型干扰素反应通路活性较低风险组低(P<0.05,图4f)。通过对TCGA免疫景观图谱的分析,发现创伤愈合型(C1)的PIRS最高,分别与IFN-γ为主型(C2)、炎症反应型(C3)及淋巴细胞耗竭型(C4)比较差异均有统计学意义(均P<0.01,图4g)。C1与血管生成基因的高表达相关,促进肿瘤的增殖[11]。上述研究结果均提示高风险组预后差可能与肿瘤细胞的免疫逃逸有关。

图4 基于肝细胞癌预后风险评估模型的肿瘤免疫微环境评估(a、b:PIRS与免疫浸润细胞含量关系;c:PIRS与T细胞驱逐评分关系;d:PIRS与肿瘤免疫功能障碍与逃逸预测评分关系;e、f:PIRS与免疫相关通路关系;g:PIRS与TCGA免疫景观图谱关系)
2.5 PIRS相关通路以及生物学功能 在TCGA数据库中,通过KEGG富集分析,细胞周期、碱基切除修复、同源重组、错配修复、p53信号通路及血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路富集在高风险组,与肿瘤细胞增殖及血管新生有关。除此之外,高风险组中富集了TGF-β信号通路,其能调控肿瘤免疫逃逸过程,进一步促进肿瘤的发生、发展(图5a)。低风险组主要富集了与代谢有关的一系列通路,其中包括脂肪酸代谢、初级胆汁酸生物合成代谢、视黄醇代谢以及色氨酸代谢等,低风险组主要与维持机体自身的生理活动有关(图5b)。
通过GO富集分析,高风险组富集了细胞周期相关的生物学活动,此外,发现PIRS与大分子的甲基化相关(图5c)。低风险组则与脂肪酸代谢以及蛋白质激活级联反应等生物学活动密切相关(图5d)。
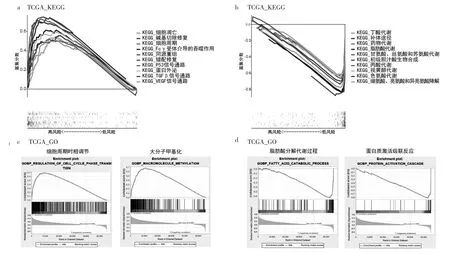
图5 PIRS相关通路生物学功能与通路富集分析结果(a:高风险组KEGG通路富集图;b:低风险组KEGG通路富集图;c:高风险组GO功能富集图;d:低风险组GO功能富集图)
3 讨论
细胞焦亡的概念最早可追溯至1992年,研究发现小鼠巨噬细胞感染志贺氏菌可导致细胞死亡[12]。随后发现细菌感染引起的巨噬细胞死亡是一种完全不同于凋亡的细胞死亡方式[13]。随着半胱氨酸天冬氨酸酶-1(caspase-1)以及gasdermin蛋白家族的发现,细胞焦亡的机制被逐渐阐明。细胞焦亡信号通路分为依赖caspase-1的经典途径和依赖caspase-4/5/11的非经典途径。gasdermin-N结构域的质膜成孔活性是引起细胞焦亡的必要条件[14],其可通过诱导质膜孔的形成,释放IL-1β和IL-18,导致细胞膜破裂从而发生焦亡[15]。2018年,细胞死亡命名委员会将pyroptosis定义为一种调节性细胞死亡[2],严重依赖于gasdermin蛋白家族成员的质膜孔形成,通常(但并不总是)由于caspase的激活所导致。
在15个基因中有4个基因编码的蛋白直接参与细胞焦亡的炎症级联反应,包括GZMA、NLRP6、GSDMC以及NOD2。NK细胞和CD8+T细胞通过GZMA诱导细胞焦亡的方式来杀伤GSDMB阳性的肿瘤细胞,起到抗肿瘤作用[16]。同时,IFN-γ能上调GSDMB表达并促进肿瘤细胞发生凋亡[16]。此外,炎症小体已被证明可通过介导炎症反应参与细胞焦亡。NLRP6是炎症小体的组成部分,可介导中性粒细胞炎症反应[17]。但有研究发现,在NLRP6基因敲除的小鼠肺中,NK细胞介导的IFN-γ水平升高,且NLRP6可抑制革兰阳性球菌感染所致的肺内中性粒细胞招募[18]。NLRP6通过激活caspase-1诱导牙龈成纤维细胞发生焦亡以及加重氧/糖剥离再灌注模型的神经元损伤[19-20]。上述研究结果均提示NLRP6参与炎症反应的调控,但具体调节机制有待进一步明确。GSDMC是gasdermin蛋白家族中的一员,同样具有诱导质膜孔形成的能力。在低氧条件下,磷酸化信号转导和转录激活因子3与程序性死亡受体-配体1(PD-L1)相互作用增强GSDMC基因转录,GSDMC的高表达与预后不良有关[21]。GSDMC/caspase-8介导癌细胞中的非经典的焦亡途径[21]。此外,NOD2除了可以促进细胞凋亡和加重炎症反应,还能诱导细胞焦亡[22]。
此外,有5个受体蛋白的编码基因和1个配体的编码基因,都参与肿瘤微环境中的免疫调节,分别是IL-7R、IL-18RAP、IL-15RA、CCR7、CSF3R 以及 CCL20。IL-7R编码一种具有特异性α链和共细胞因子受体γ链的异二聚体受体。在乳腺癌、肺癌、肾癌和结肠癌组织中,IL-7R和(或)IL-7的表达增加[23],促进肝细胞癌细胞的增殖和转移[24]。IL-18RAP通过IL-18和IL-18RAP轴在炎症和免疫调节中发挥作用[25]。IL-15和IL-15RA作为共刺激因子可提高TME内NK细胞和CD8+T细胞的浸润水平,在胶质瘤治疗中能提高溶瘤病毒治疗联合免疫治疗的协同效应,提高抗肿瘤作用[26]。除此之外,TGF-β可下调 NK细胞活化标志物和细胞毒性颗粒的表达,研究发现IL-15和IL-15RA是TGF-β信号通路的抑制剂[27]。在抑制性肿瘤微环境中,IL-15和IL-15RA有潜力成为重新激活NK细胞的靶点,从而逆转NK细胞的功能障碍。CCR7主要在未发生细胞焦亡的树突状细胞(dendritic cells,DC)中发挥作用,过度活跃的DC依赖于CCR7,提高自身迁移到淋巴结引流区的能力和T淋巴细胞的细胞毒性[28]。CSF3R基因缺失突变导致先天性中性粒细胞减少症,粒细胞巨噬细胞刺激因子刺激机体生成粒细胞,调节免疫[29]。CCL20是趋化因子受体CCR6的配体,首先在肝脏中被检测到并且表达在巨噬细胞中,其能激活辅助性T细胞17产生IL-17。同时,IL-17也是CCL20表达的强诱导因子[30]。因此,上述正反馈关系表明 CCL20水平与IL-17信号激活密切相关,参与机体的固有免疫。
参与模型构建的另外5个基因同样与TME息息相关,参与肿瘤的恶性生物学行为。MEP1A编码是一种锌金属内肽酶,有蛋白酶活性,通过调节上皮间质转化参与肝癌的疾病进展[31]。HPN编码丝氨酸蛋白酶,主要在肝脏中表达,也与前列腺癌和卵巢癌的发生、发展有关[32]。PSEN1编码的蛋白是组成膜蛋白γ分泌酶的成分,研究发现PSEN1可通过抑制应激活化蛋白激酶/c-Jun氨基末端激酶途径从而抑制机体免疫激活信号的传导[33]。RHOG是控制癌细胞恶性生物学行为的信号元件,影响内皮细胞的迁移和细胞间的黏附,介导胶质母细胞瘤细胞的侵袭[34]。ITGA5是整合素家族成员,mir-26a通过ITGA5诱导肝癌细胞失去归巢能力而发生凋亡[35]。
肝脏是一个沉默的器官,肝癌一旦发现大多数已是晚期,其恶性程度高,严重威胁着国人的身体健康[1]。肝细胞癌预后风险评估模型的高风险组患者TME表现出的免疫抑制状态,可能与T细胞的细胞毒性减弱以及干扰素反应性减低有关。研究表明病毒侵袭引发Ⅰ型干扰素的产生影响细胞中脂肪酸代谢,促进胞内ATP含量升高,使细胞产生抗病毒效应[36]。因此,高风险组的干扰素反应性减低,可能更容易患HBV、HCV等病毒感染,进一步引起肝硬化以及肝癌的发生。同时,高风险组中富集的TGF-β通路可通过T细胞驱逐降低对PD-L1检查点抑制剂的疗效[37],促进肿瘤免疫逃逸,对患者预后造成不利影响。
免疫治疗是基于肿瘤细胞的免疫逃逸机制而设计,如靶向血管新生,激活效应免疫细胞,抑制巨噬细胞和调节性T细胞释放TGF-β等。值得关注的是,信迪利单抗联合贝伐珠单抗已经获批用于肝细胞癌一线治疗[38]。生物制剂的出现为肿瘤治疗提供更多的可能性,研究人员发现在黑色素瘤的免疫治疗过程中,一部分患者对免疫治疗有先天抵抗作用。加入细胞周期蛋白依赖性激酶4/6抑制剂可以提高肿瘤对免疫治疗的敏感性,同时抑制肿瘤细胞的生长[39]。本研究结果发现细胞周期通路在高风险组显著富集。由于目前肝细胞癌单用免疫治疗的疗效不理想,或许联合细胞周期抑制剂能提高肝细胞癌患者对免疫治疗的敏感性。
综上所述,联合用药为肝细胞癌的精准治疗提供可能,而细胞焦亡和炎症反应相关通路将成为其中一个重要的靶点,值得深入研究。

