建立术后肠梗阻大鼠模型的新方法及评价
李倩 莫黎 何永恒
术后肠梗阻是腹部外科手术后早期常见的并发症之一[1],以恶心、呕吐、腹胀、腹痛、排气时间延长及肠鸣音异常为主要临床表现[2],其发病率可高达17%~20%,尤其以肠道手术后更为常见[3]。术后肠梗阻症状通常持续2~4 d,有时甚至会长达7 d以上,部分患者(尤其是经肠吻合后的患者)肠梗阻时间会显著延长[4],术后肠梗阻治疗周期长、恢复慢,患者术后住院时间延长使患者和社会的医疗负担增加[5]。目前该疾病的主要治疗策略是在常规腹部外科手术后治疗的基础上减轻胃肠负担(如禁食及使用鼻胃管等),针对性的治疗措施少,因此理想术后肠梗阻造模方式的建立有着重要意义。目前国内外主要采用Kalff教授[6]及王李教授[7]的方法,即通过摩擦小肠来建立术后肠梗阻模型,但其与临床实际情况尚有差距,因此本实验研究了不同造模方法对SD大鼠术后胃肠动力及血清IL-6、TNF-α水平的影响,旨在建立操作便捷、能真实模拟临床腹部手术术后肠梗阻且重复性好的动物模型,现报道如下。
1 材料和方法
1.1 实验动物 SPF级SD大鼠60只,雌雄各半,体重(200±20)g,由湖南斯莱克景达实验动物有限公司提供,许可证号:[SYXK(湘)2016-0002]。购入后于湖南中医药大学实验动物中心动物房适应性喂养5 d,所有针对大鼠的实验操作均遵守实验动物使用和保护条例,本研究经湖南中医药大学伦理审查批准(批准编号:LL2019092005)。
1.2 实验主要试剂 IL-6、TNF-α酶联免疫检测试剂盒由上海晶天生物提供,生产批号分别为E20200103010、E20200103012。
1.3 动物分组及建模方式 将60只SD大鼠采用随机数字表法分为模型A、B、C、D组、假手术组和空白组,每组10只。模型A、B、C、D组和假手术组大鼠手术前均禁食24 h,不禁饮,术后禁食不禁饮,麻醉方式为10%水合氯醛(0.25 ml/100 g)腹腔注射。模型A组开腹后以沾有0.9%氯化钠溶液棉签自小肠近心端向远心端擦拭3次,手术后顺序还纳肠管;模型B组开腹后提出盲肠,结扎并切除部分盲肠;模型C组结扎并切除部分盲肠,再以0.9%氯化钠溶液棉签行小肠擦拭1次;模型D组结扎并切除部分盲肠后,再于小肠中部离断,以3-0可吸收线间断全层缝合小肠;假手术组开腹后静置20 min关腹;空白组不予手术处理。
1.4 取材及检测 所有大鼠术后23.5 h均给予0.15 ml活性炭溶液灌胃,0.5 h后以10%水合氯醛腹腔注射麻醉大鼠。
1.4.1 血清IL-6、TNF-α水平检测 大鼠麻醉后将其固定,心尖采血,静置 1 h后,4 000 r/min、4℃离心 15 min,取上清液,干冰即时冷冻保存,采用ELISA法检测血清 IL-6、TNF-α 水平。
1.4.2 胃肠推进率及胃残留物质量检测 开腹后,轻柔分离展开肠管,夹闭胃贲门、幽门及回肠下端,计算胃肠推进率(胃肠推进率=小肠染黑长度/全小肠长度×100%),并分离胃体测量胃残留物质量(胃残留物质量=全胃重量-洗净后胃体重量)。
1.4.3 小肠病理切片观察 靠近幽门取2 cm近端小肠肠管,0.9%氯化钠溶液洗净后以4%多聚甲醛固定液固定,用于 HE染色。
1.5 统计学处理 采用SPSS 22.0统计软件。符合正态分布的计量资料以表示,满足方差齐性的计量资料多组间比较采用单因素方差分析,两两比较采用LSD-t检验;不满足方差齐性的计量资料则应用Welch检验,多重比较采用Tamhane's T2检验;Pearson相关分析胃肠推进率与血清IL-6、TNF-α水平的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 6组大鼠血清IL-6、TNF-α水平比较 术后24 h,空白组 IL-6、TNF-α 水平均明显小于模型 A、B、C、D组,差异均有统计学意义(均P<0.01);模型C、D组IL-6、TNF-α水平均明显高于模型A、B组、假手术组、空白组,差异均有统计学意义(均P<0.01)。见表1。

表1 6组大鼠血清IL-6、TNF-α水平比较(ng/L)
2.2 6组大鼠胃肠推进率、胃残留物质量比较 术后24 h,空白组胃肠推进率均明显高于模型A、B、C、D组,胃残留物质量均明显低于模型B、C、D组,差异均有统计学意义(均P<0.01);模型C、D组胃肠推进率均明显低于模型A组、假手术组、空白组,胃残留物质量均明显高于模型A组、假手术组、空白组,差异均有统计学意义(均P<0.01),其中模型C组胃肠推进率明显低于模型A组,差异有统计学意义(P<0.01)。见表 2。

表2 6组大鼠胃肠推进率及胃残留物质量比较
2.3 6组大鼠小肠病理切片观察 模型A、B组的肠黏膜坏死、脱落;模型C、D可见黏膜坏死、脱落并有大量炎症细胞浸润;空白组及假手术组肠黏膜上皮排列有序,绒毛结构清晰,组织结构正常,未见损伤,见图1。
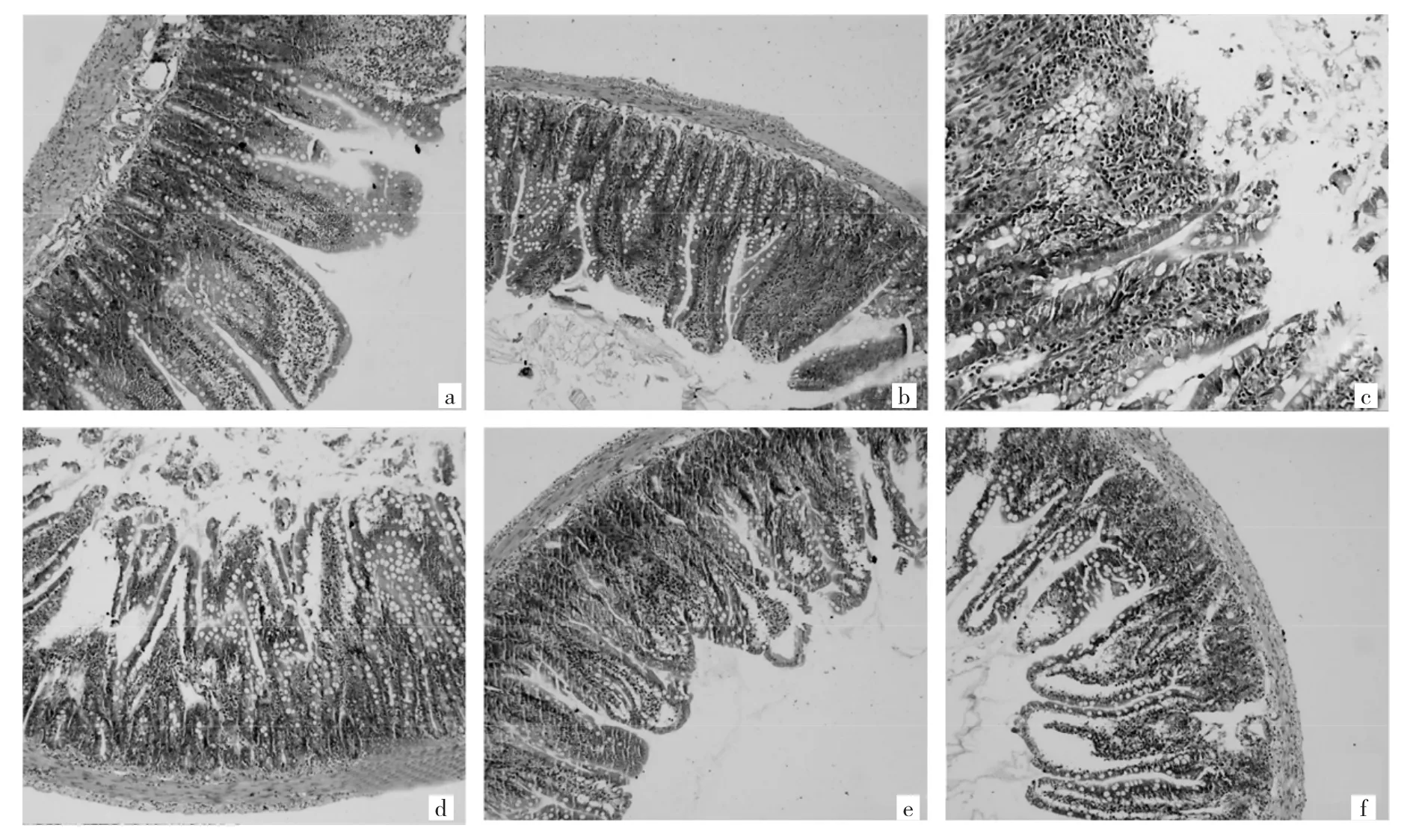
图1 6组大鼠小肠病理切片所见(a:空白组;b:假手术组;c:模型A组;d:模型B组;e:模型C组;f:模型D组;HE染色,×200)
2.4 大鼠胃肠推进率与血清IL-6、TNF-α水平的相关性分析 大鼠胃肠推进率与血清IL-6水平呈负相关(r=-0.85,P<0.01),与血清 TNF-α 水平呈负相关(r=-0.79,P<0.01),见图 2、3。
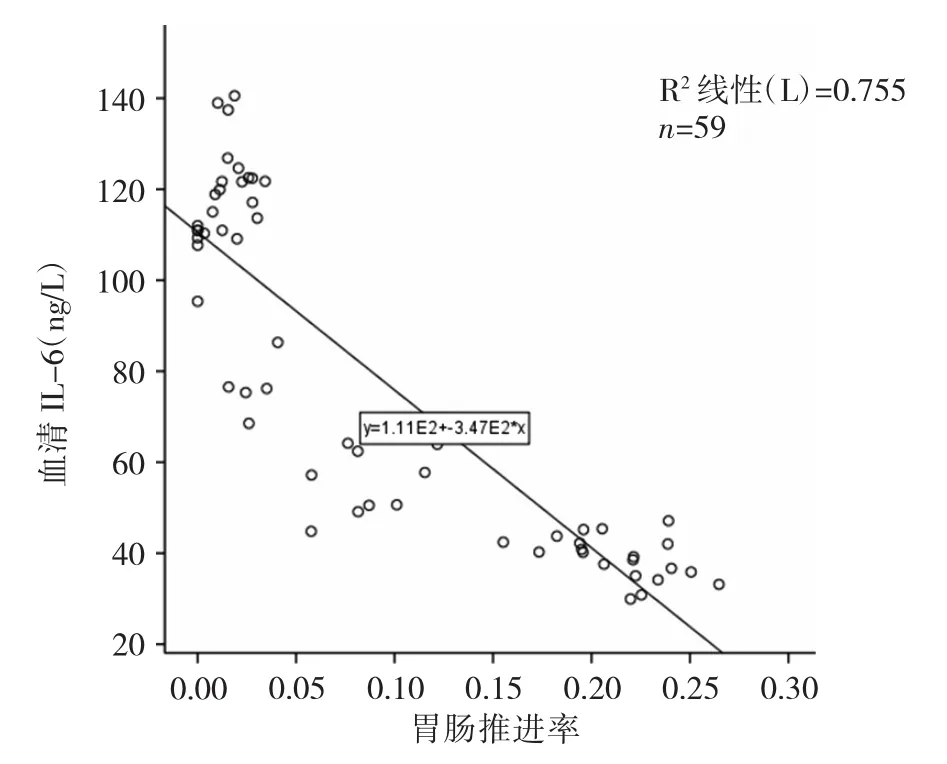
图2 胃肠推进率与血清IL-6水平关系的散点图
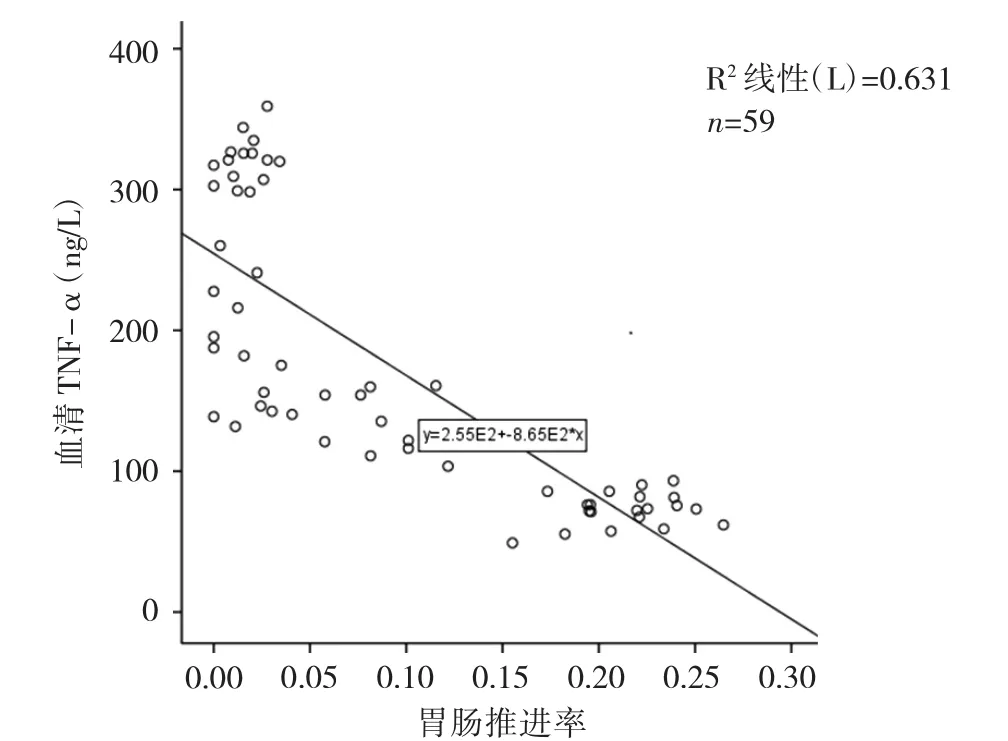
图3 胃肠推进率与血清TNF-α水平关系的散点图
3 讨论
现代研究普遍认为术后肠梗阻大致有两个不同的阶段:(1)以过度抑制反应为特征的短暂神经介导阶段;(2)较长的炎症反应阶段[8]。而炎症反应在术后肠梗阻的后续维持阶段起关键作用[9]。在20世纪90年代后期,研究发现手术操作会引发白细胞在相应肠段中的流入,损害发炎肠管的收缩能力,导致肠管持久性运动障碍[10-11]。之后,许多研究结果表明肥大细胞在术后肠梗阻的炎症级联反应中起关键作用,如术后肠梗阻模型小鼠的腹腔液中肥大细胞蛋白酶-I水平显著增加,且肠肌层有明显的炎性浸润,而用肥大细胞稳定剂酮替芬预处理小鼠能够防止肠肌层的炎性细胞募集,并且可改善手术后小鼠的胃排空现象[12];肥大细胞缺陷型术后肠梗阻小鼠也同样表现出手术后炎症反应减弱的现象[13]。而在结肠切除术后发生术后肠梗阻患者中,肥大细胞的激活也有明显增加[14]。此外,研究发现循环单核细胞和常驻巨噬细胞也与肠管炎症反应有关[10]。而肠壁内相关细胞的激活,部分由与损伤相关的分子模式和病原体相关的分子模式引起,前者是响应机械释放的大分子或化学细胞损伤(例如肠管的手术操作),后者是由与炎症相关的渗透性增加而通过肠壁移位所引起,网络状分布的常驻巨噬细胞、肥大细胞活化后,诱导促炎细胞因子TNF-α、IL-1B、IL-6和单核细胞趋化蛋白-1等的分泌,组织随后进入细胞炎症期,大量的单核细胞和中性粒细胞进入肌层,进而导致肠管收缩力受损[1]。而在临床中术后肠梗阻患者的血清IL-6以及TNF-α水平较术前均有明显升高[15],因此本研究中选取此两种促炎细胞因子作为模型评价标准。
目前国内外术后肠梗阻动物模型的建立主要承自Kalff教授建立的模型制造方法:开腹后,将小肠移出腹腔,以0.9%氯化钠溶液湿润棉签或纱布擦拭小肠肠管表面,再按顺序还纳肠管,关腹。擦拭的具体操作各个实验项目略有不同,有以时间记,5~20 min不等;有以次数记,3~5次不等;方向均为近端至远端,模拟腹部手术造成的腹腔内的刺激。传统的造模方式虽然操作简单,但没有模拟肠管离断对机体的刺激,而研究表明术后5 h,肠管切口处附近肌肉会出现电慢波和相性收缩,这个现象会随着切除上下距离的增加而减少[16]。因此肠管离断对胃肠动力的影响是实际存在且不能忽视的,且其单纯对小肠进行手术操作,忽略了腹部空腔脏器吻合带来的感染风险。
本研究综合了以往的造模方式并结合临床实际情况,创新地建立了几种手术造模方式:模型B组盲肠结扎并切除;模型C组盲肠结扎并切除后以0.9%氯化钠溶液棉签擦拭小肠1次;模型D组首先部分盲肠切除,缝扎闭合远端,然后在小肠中部离断行肠管吻合术。根据术后肠梗阻的临床特征及现有的机制研究结果,本研究团队选取了血清IL-6、TNF-α水平、胃肠推进率及胃残留物质量作为主要检验指标。
本研究结果表明,术后24 h,空白组胃肠推进率均明显高于模型A、B、C、D组,胃残留物质量均明显低于模型B、C、D组,模型C、D组胃肠推进率均明显低于模型A、假手术、空白组,胃残留物质量均明显高于模型A、假手术、空白组,其中模型C组胃肠推进率高于模型B组,证明盲肠切除手术操作对胃肠推进率的影响要大于传统的小肠擦拭法,且C组能更好的模拟临床腹部手术患者术后的胃肠功能显著减低的状态;术后24 h,各模型组血清IL-6水平均明显高于空白组,与郭薇等[17]研究结果一致。在各组小肠病理切片观察中也发现,各模型组均可见肠黏膜坏死、脱落及大量炎症细胞浸润,以模型C、D两组最为明显。再从操作便捷度来看,模型A组为传统造模方法,操作较为复杂,在多次擦拭小肠的过程中容易出现浆膜损伤及血管断裂等情况,且模型的重复性不佳,易出现个体差异,而盲肠切除的操作相对简单,模型D组虽然也能较好的模拟术后肠梗阻,但手术难度较高,在实验过程中,因出现吻合口瘘导致大鼠死亡1例,不适合推广。
综合来看,模型C组在胃肠动力及促炎细胞因子等方面很好地模拟了临床实际情况,且造模方式便捷,减少了擦拭过程中的意外,采用盲肠切除术更贴近于胃肠道手术术后肠梗阻的动物模型;此外,盲肠切除+小肠擦拭1次的造模方式使得操作刺激量更加可控,此方法操作便捷度好,模型重复性好,适合推广应用。

