重组酶聚合酶扩增技术在植物病毒检测中的应用
罗雪琮 安梦楠 吴元华 夏子豪
(沈阳农业大学植物保护学院,沈阳 110866)
在过去几十年中,占植物病害数量第二位的植物病毒病一直制约着粮食、果蔬等作物的产量[1]。因此,快速准确地检测植物病毒是病害防控工作中的重要部分[2]。常见的病毒检测方法有生物学测定、电子显微镜观察、血清学检测与分子生物学技术等多种手段。其中,生物学测定技术是利用病毒的寄主范围、传播方式与侵染后寄主的反应而检测病毒的方法[3]。该方法具有直观、可靠、反映病毒生物学特性的优点,但选择指示植物较复杂,目前已不再是植物病毒检测的主要手段[4]。电镜检测主要通过观察病毒结构和宿主细胞结构的变化来确定病毒的种属,需要价格高昂的电子显微镜,且不易分辨亲缘关系近的病毒。血清学检测法的原理则是抗原与抗体的特异性结合,常用方法包括酶联免疫吸附法(enzyme-linked immuno-sorbent assay,ELISA)、用硝酸纤维素膜取代酶联板以简化程序的点免疫结合测定技术(dot immunobinding assay,DIBA)及胶体金标记的抗体检测技术。但血清学检测法需要特异的抗体,且不能准确鉴定病毒含量低和具有大量干扰物质的样品,易产生假阳性结果[5]。另外,随着分子生物学的发展,核酸分子杂交技术、聚合酶链式反应(polymerase chain reaction,PCR)、深度测序技术等逐渐发展成为常用的病毒检测方法。分子生物学检测法具有灵敏便捷、特异性强、检测范围广等优点,但也具有设备与材料成本高等局限性[6]。
近年来,学者们还开发出一些基于特殊酶类的等温扩增方法,如:环介导等温扩增(loop-mediated isothermal amplification,LAMP)、核酸序列扩增(nucleic acid sequence-based amplification,NASBA)、单引物等温扩增(single primer isothermal amplification,SPIA)、重组酶聚合酶扩增(recombinase polymerase amplification,RPA)和滚动循环扩增(rolling circle amplification,RCA)等,为病毒的检测提供了技术支持[7]。其中,RPA技术是一种时间成本较低、适用于资源有限的现场检测方法,从众多需要较复杂材料或仪器的检测方法中脱颖而出,其优点明显,应用范围也越来越广。本文综述了RPA技术的原理、研究进展及存在的问题,总结了目前RPA在植物病毒鉴定领域的发展情况,为其在植物病毒检测中的应用提供参考。
1 重组酶聚合酶扩增(RPA)
RPA是一种新型的核酸等温扩增技术[8]。与PCR类似,RPA的反应体系中除核心酶外,还要加入引物与模板,另外还需Mg2+。RPA的检测过程主要包括样品核酸提取,引物设计与筛选,运用反应试剂盒进行扩增以及将结果可视化。目前研究人员运用RPA检测技术常用的试剂盒主要是其发明者TwistDx公司的TwistAmp 以及美国公司Agdia的AmplifyRP 系列产品。
1.1 RPA的原理
RPA体系中含有3种重要的核心酶,包括重组酶、单链结合蛋白(single-stranded DNA-binding protein,SSB)和DNA聚合酶。重组酶可以与引物结合形成核酸蛋白复合体并定位模板,引发链交换反应形成D环结构,SSB稳定被置换的DNA链,随后DNA聚合酶识别重组酶解离后暴露出的引物3′端,由此开始扩增[9]。DNA聚合酶在延伸引物的同时对模板进行解螺旋,DNA的合成持续进行,直至两条引物扩增完成即形成完整的扩增子(图1)[10-11]。通过使用一对引物,如果存在目标序列,则可以在最佳温度(37-42℃)下启动DNA的指数级扩增,适用于病毒基因组DNA或RNA的快速检测[7]。RPA扩增体系中一般还含有促进重组酶同源重组的成分:如T4 uvsY,更有利于RPA反应的进行[8]。

图1 RPA原理示意图Fig. 1 Schematic diagram of RPA principle[11]
1.2 RPA引物的设计要求
引物设计是RPA技术的关键步骤,为扩增反应的正常进行奠定基础。其设计过程主要由选择靶区域、设计引物候选物与实验筛选3个步骤组成[11]。由于RPA引物的设计过程较为复杂,目前还没有适用的设计软件。不同于PCR引物的设计,为了方便重组酶与引物形成复合物,RPA引物的建议长度一般在30-35 nt。过短的引物会降低反应的重组率,过长的引物则易产生二级结构以及潜在的引物假象[12]。另外,引物应没有直接或倒置重复、回文序列以及二级结构(包括环和发夹结构)等,且在5′端不应有长链鸟嘌呤,GC含量应在30%-70%之间[7]。RPA技术发展至今,可扩增dsDNA、ssDNA以及RNA或miRNA逆转录得到的cDNA[13]。无论使用什么模板,为了获得最佳结果,RPA引物应扩增较短的扩增子,最好控制在100-200 bp。虽然RPA也曾报道过较长的扩增子(1.5 kb)[8],但通常情况下,RPA的扩增产物长度应高于70 bp且低于500 bp。如果需要设计实时荧光定量RPA(real-time RPA)所使用的探针,则需在设计引物时留下足够的空间[14]。
1.3 RPA的优缺点
目前常用的植物病毒检测方法中,PCR技术需要较昂贵的热循环设备;ELISA需要的抗体制备时间较长,易产生假阳性结果;LAMP引物设计复杂;实时荧光PCR快速、灵敏但设备成本较高[15]。在实地调查或条件比较有限的检测环境下,PCR等技术应用困难[16]。相比而言,RPA技术的优点包括:(1)RPA检测所需时间短,30 min左右即可完成反应;(2)RPA样品处理方法简单,适用于无法提取核酸的实地检测,可以扩增提取的DNA、RNA以及样品粗提物;(3)常温下重组酶也有活性,因此RPA技术不需要热循环器,在常温(37-42℃)条件下即可恒温扩增,只需水浴、金属浴或恒温孵化器即可在现场条件下完成反应;(4)与其他的核酸扩增方法(PCR、RT-PCR等)相比,RPA的灵敏度更高或持平;(5)RPA具有较高的特异性,检测时不易与其他病毒发生交叉反应[17];(6)RPA能够耐受试验样品中的各种扩增反应抑制剂[18]。
如今RPA检测方法应用广泛,优势明显但也具有一定的局限性。RPA产物检测方面,在琼脂糖凝胶电泳之前需要进行纯化,因此造成时间和成本的增加;侧流层析试纸条法(lateral flow dipstick,LFD)需要将产物稀释后再使用试纸条进行结果的检测,以防反应底物的干扰;在实时荧光定量RPA技术中,需要使用荧光检测仪对结果进行监测,因此也具有较高的仪器成本。另外,由于缺少RPA引物设计的软件,需经过大量的筛选才有可能获得理想的引物,建立特定核酸检测方法的开发时间与费用成本较高。
2 RPA的发展
RPA在不断的发展过程中,获得了更多的研究和开发策略,也为资源较差的实验室提供合适的快速检测方法。对于RNA病毒的检测来说,需在体系中加入逆转录酶,将RNA作为模板合成cDNA再进行扩增,RPA结合逆转录法形成逆转录RPA技术(reverse transcription-RPA,RT-RPA)。RPA与 其 他方法的结合也使其发展地更加丰富。
2.1 RPA结合琼脂糖凝胶电泳
RPA经过扩增得到的产物DNA可以通过琼脂糖凝胶电泳使结果可视化。需要注意的是,在琼脂糖凝胶电泳检测时,由于RPA反应的混合物中存在阻碍扩增子可视化的蛋白质,以致形成拖带,所以RPA产物需经过酚-氯仿抽提或产物纯化等方法,去除酶等干扰成分才能进行电泳,从而形成更好的成像结果。电泳后将琼脂糖凝胶经过溴化乙锭(ethidium bromide,EB)染色,通过凝胶成像仪在紫外光下获得扩增条带的可视化结果[7]。RPA结合琼脂糖凝胶电泳是实验室内植物病毒检测常用的方法之一,已在多个植物病毒检测中得到应用。例如葡萄卷叶伴随病毒3号(grapevine leafroll-associated virus 3,GLRaV-3)等[15]。
2.2 RPA结合侧流层析试纸条
目前,利用RPA方法的部分研究中,将RPA扩增反应与侧流层析试纸条相结合,以获得可视化结果。与普通RPA体系不同,RPA-LFD需要额外加入核酸外切酶Ⅳ(nfo核酸酶)、带有FAM荧光素标记的nfo探针以及带有生物素(biotin)标记的下游引物[19]。RPA反应过程中,重组酶与引物(正向引物和带有生物素标记的反向引物)形成复合物并结合同源链发生链置换反应,在DNA聚合酶的作用下进行扩增;同时,带有生物素标记的扩增产物能够与nfo探针杂交,含有四氢呋喃(THF位点)的nfo探针被nfo核酸酶识别并切割,产生的羟基端与DNA聚合酶结合形成新的延伸底物,最终扩增得到3′端含生物素、5′端含FAM的双标记扩增子[20]。
测流层析试纸条可利用胶体金免疫层析原理的“夹心法”进行检测[21]。LFD前端含有FAM荧光标记,试纸条上有一条带有生物素抗体的检测线和一条包被固定抗体的对照质控线[14]。当扩增产物流过试纸条时,在扩散过程中通过抗原抗体结合的原理与FAM抗体以及生物素抗体结合形成免疫复合物[22]。在测试区,含生物素的复合物于检测线被生物素配体捕获并显出红色,未被捕获的免疫复合物扩散至对照区,被固定抗体捕获并形成红色条带[23]。RPA-LFD一般在30 min内即可完成扩增与可视化检测,观察检测线和质控线形成的条带即可判断检测结果,若未显示对照线(control line)则结果无效[20]。另外,反应底物可能会干扰试纸上的抗体,因此需注意RPA产物应经过稀释再进行试纸条检测[14]。
RPA-LFD在植物病毒检测中的应用较为常见。在紫云英矮缩病毒(milk vetch dwarf virus,MDV)的检测过程中发现,当RPA结合琼脂糖凝胶电泳与测流层析试纸条时检测限一致,并比PCR结合琼脂糖凝胶电泳灵敏100倍。当进一步试验PCR结合测流层析试纸条时,其灵敏度与RPA相同。这表明测流层析试纸条在检测MDV的PCR产物时比琼脂糖凝胶电泳更灵敏[24]。测流层析试纸条操作快速简便,不需要精密仪器,其灵敏度等于或高于琼脂糖凝胶电泳,十分适合植物病毒的现场检测。
2.3 RPA结合探针法荧光定量
与荧光定量PCR(real-time PCR)的原理相同,为实时监测RPA扩增的情况,可以将含有荧光标记的探针加入扩增体系中,通过检测反应中的荧光信号观察扩增过程中产物积聚的变化情况。在传统PCR常用的TaqMan探针法中,Taq酶具有5′-3′的外切酶活性,以此来切断探针链产生荧光[25]。在RPA反应过程中,Taq酶则会降解被置换的核苷酸链,因此这种探针影响DNA的扩增,不适合荧光定量RPA的反应[11]。在RPA检测技术常用的探针中,Exo与Fpg探针一般应用于实时荧光定量的检测,LF探针则可以运用在侧流层析试纸以及凝胶电泳的检测中。其中,Exo与LF探针一般建议在46-52个核苷酸之间,Fpg 探针通常为35个核苷酸。在RPA反应中可以对探针的浓度进行优化,其浓度范围可在50-150 nmol/L,其推荐浓度为120 nmol/L[19]。
结合探针的RPA扩增过程中需要来自大肠杆菌的核酸外切酶Ⅲ(exonuclease Ⅲ,exo)和exo荧光探针的加入。Exo探针与靶序列具有同源性,其上含有THF位点,THF两侧分别携带一个荧光基团(fluorophore)和一个荧光淬灭基团(quencher),3′端有阻断物以防探针延伸。Exo探针能够结合靶序列形成双链杂合DNA结构,随后核酸外切酶Ⅲ识别THF位点并切割探针,两基团分离并产生荧光信号[26]。目前,结合exo探针法的荧光定量RPA在植物病毒检测领域中已有应用,例如利用RT-exoRPA检测黄瓜花叶病毒(cucumber mosaic virus,CMV)、玫瑰丛簇病毒(rose rosette virus,RRV)等[27-28]。该技术一般使用荧光定量PCR仪、Twista等能够监测荧光信号的装置来完成定量检测,反应只需不到20 min,比琼脂糖凝胶电泳更方便快捷,利于实验室快速检测植物病毒,具有较高的灵敏度与特异性[29]。未来研究将继续开发适应现场检测的荧光定量RPA技术,以更好地控制和减少病毒的传播。
2.4 RPA结合金纳米粒子(AuNP)探针与比色法
近年来,基于DNA的新型便携式生物传感器作为一种快速而灵敏的诊断工具被用来定性或定量检测病原物[30]。研究人员将RPA与金纳米粒子(AuNP)探针相结合开发出一种新的视觉诊断方法,利用肉眼进行AuNP聚集的比色检测,成为一种可靠手段以促进AuNP探针在DNA检测中的应用[31]。该视觉诊断方法主要包括3个步骤:RPA、AuNP探针杂交以及视觉检测。首先利用RPA扩增目的片段,然后将AuNP探针加入到RPA反应体系中,并与H2NOH和HAuCl4混合促进AuNP的生长。DNA的数量和序列相似性会影响AuNP的生长与其大小形状,而它们大小和形状的不同会拥有不同的颜色与紫外或可见光谱[32]。
用生物传感器AuNP探针识别RPA扩增子能够形成不同颜色的可见溶液,如紫红色,紫色,蓝紫色,深蓝色[31]。RPA结合AuNP探针与比色法应用于番茄黄化曲叶病毒(tomato yellow leaf curl virus,TYLCV)的检测中,方法简单,反应时间较短(共20 min),通过观察AuNP的颜色变化快捷简便地用肉眼完成DNA的可视化检测,且具有较高的灵敏度[31]。这种技术提供了一种植物病毒检测结果可视化的新方法,可以提高AuNP聚合的比色检测在定性和定量分析中的可靠性,从而促进AuNP探针在DNA检测中的应用,在植物病毒检测的发展过程中具有一定潜力。
2.5 RPA结合CRISPR/Cas系统
研究人员最初在大肠杆菌中发现了规律间隔成簇的短回文重复序列(clustered regularly interspaced short palindromic repeat,CRISPR)的 存 在,后 来又发现了CRISPR相关蛋白(CRISPR associated protein,Cas)。近年来,CRISPR/Cas系统广泛应用于基因工程、分子免疫以及转录调控中[33-35]。如今,RPA可与CRISPR/Cas技术结合起来,用于快速简便地检测病毒核酸,且RT-RPA-CRISPR/Cas12a已被开发并应用于植物RNA病毒的检测[36-37]。该技术首先通过RT-RPA于等温条件在单独离心管中扩增目标序列,而后将扩增产物转入含有Cas12a、crRNA等检测试剂的新管中,CRISPR/Cas12a激活核酸酶活性并进行检测[37]。将RPA与CRISPR/Cas12a相结合的检测技术具有高特异性与敏感性,在植物病毒检测领域还属于有待发展的新技术。
3 RPA在植物病毒检测中的应用
近年来,RPA技术被广泛应用于生物学、医学、动植物研究等许多领域的各类核酸的检测中[38]。RPA于2006年首次报道,直到2014年才开始运用在植物病毒检测领域,发表文献数量在发展初期没有明显增长,2017年之后文献数量逐年呈上升趋势。可见在各类研究中已发展成熟的RPA在植物病毒检测方向还是一个新兴的技术,直到近几年才产生较大影响并逐渐成为热点。
不断发展的RPA与其他检测手段相结合,逐渐成为代表性的恒温扩增方法,已应用于多种植物病毒的检测中(表1),并在不断改进中成为一种被许多研究学者运用的重要手段。截至2021年1月31日,通过在NCBI PubMed以及知网数据库的检索,将RPA在植物病毒及类病毒中应用的中文与外文文献总结成表,共包含46篇文献(图2),检测出35种植物病毒及4种类病毒。

图2 植物病毒领域发表的RPA相关文献数量Fig. 2 Number of RPA-related literature published in the field of plant viruses

表1 RPA在植物病毒检测中的应用Table 1 Application of RPA in plant virus detection
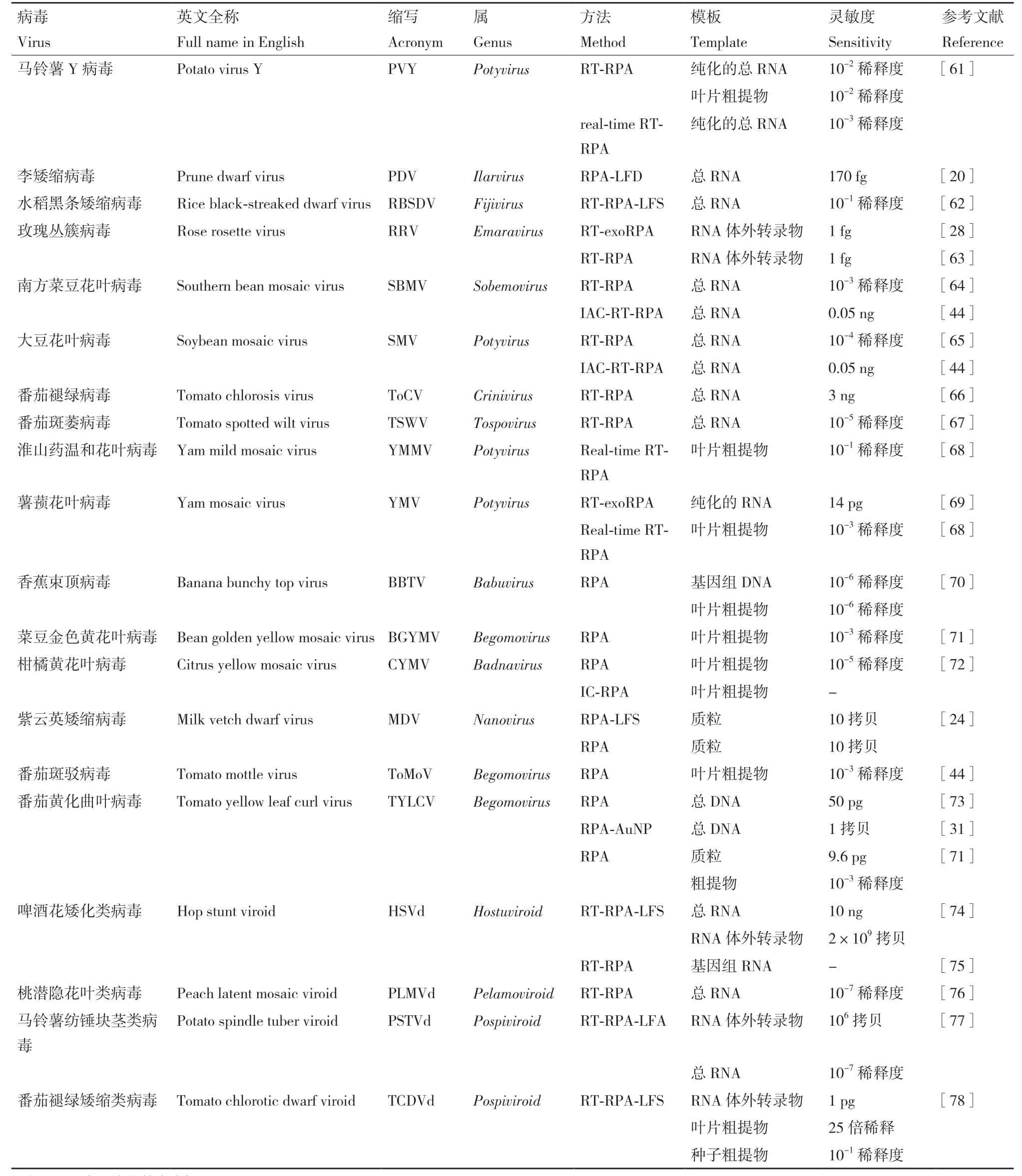
续表 Continued
在植物病毒检测中,温度与反应时间是RPA技术最常见的优化方向,大多数研究都将温度控制在37-42℃的范围内,反应时间则主要集中在20-40 min。在灵敏度方面,RPA技术的检出限能够达到10-7稀释度的RNA、1拷贝的DNA或1 fg的RNA体外转录物。RPA技术的一大优势是在样品的准备过程中,除利用核酸提取试剂盒提取RNA或DNA之外,还可使用较为便捷的粗提物作为模板,避免复杂的样品制备过程,减少时间成本,适合应用于条件有限的现场检测[74]。
经过十几年的发展,RPA技术已经在世界上成功应用于动植物病原体、转基因生物等多领域的分子检测与鉴定中。植物病毒为害农作物并在世界范围内造成重大经济损失,许多基于RPA的方法被开发用于检测不同植物病毒,这些报道已成为植物病毒学发展的重要基石。相比需要核酸提取等试剂盒与热循环仪器的PCR等分子检测手段,作为一种成功的替代方法,RPA不但特异性、灵敏度高,还能加快植物病毒检测的过程,显著降低时间与人力成本,有助于减少植物病毒的传播并限制病毒的流行[41,69]。不过,RPA还存在一些问题有待进一步发展,如引物设计软件的开发等。即便如此,RPA作为一种简单快捷的检测技术,已成为植物病毒检测研究中一笔宝贵财富。
4 结语
RPA技术最大的潜力是方法相对直接简便,不具备相关技能的人员也能迅速掌握,未来在田间植物病毒检测应用中具有广阔的前景。基于其稳定性、灵敏性、便捷性,RPA被称为有望替代甚至超越PCR的技术,已经进入飞速发展时期。虽然目前RPA试剂成本比PCR高,但其时间与人力成本相对较低,相信在不断深入研究后可降低试剂成本,获得更加完善的反应装置与技术,在植物病毒检测领域更好地应用与发展。

