利用小RNA深度测序技术检测灰飞虱病毒种类
朴君 张璐婕, 朴敬爱, 周益军 李硕
(1. 辽宁师范大学生命科学学院,大连 116081;2. 江苏省农业科学院植物保护研究所,南京 210014)
灰飞虱(Laodelphax striatellusFallén)属半翅目(Hemiptera)飞虱科(Delphacidae)昆虫,主要在东亚、东南亚、欧洲等地发生,其生长期短、暴发性高,具备较强的耐饥和耐低温能力,是一种严重危害粮食作物的农业害虫[1]。灰飞虱在我国南方地区一般每年发生5-6世代,但种群密度相对较低,其寄主范围十分广泛,可取食水稻、小麦、大麦、玉米、看麦娘、稗草等禾本科植物[2]。21世纪初以来,灰飞虱在我国黄淮和长江三角洲地区发生严重,其传播水稻条纹病毒(rice stripe virus,RSV)引起的水稻条纹叶枯病在江苏、浙江、安徽、河南等地大面积爆发,重症田块发病率50%以上,对我国水稻生产造成了严重的损失[3]。此外,灰飞虱还可传播水稻黑条矮缩病毒(rice black streaked dwarf virus,RBSDV)和小麦丛矮病毒(wheat rosette stunt virus),引起水稻黑条矮缩病、玉米粗缩病和小麦丛矮病[4-5]。因此,有效控制灰飞虱的再次暴发以及降低其扩散风险对于保障粮食安全生产具有重要意义。
病毒与昆虫在长期进化过程中形成了复杂多样的关系。灰飞虱传播的多种植物病毒(如RSV和RBSDV)都可以在其体内增殖,因此,这些病毒既是植物病毒,又属于昆虫病毒。昆虫病毒作为天然的生物杀虫剂,具有对人畜环境安全无害、在环境中滞留时间短、毒力强以及能引起害虫种群流行病而长期控制其密度等优点[6],应用昆虫病毒杀虫剂防治农业害虫已成为目前生物防治的一个理想途径。德国早在19世纪末就已开展利用昆虫病毒防治害虫的研究,并利用昆虫核型多角体病毒防治模毒蛾[7]。1973年联合国粮农组织(FAO)和世界卫生组织(WHO)将昆虫杆状病毒作为防治农作物害虫的生物杀虫剂。我国也在同年开展关于昆虫病毒防治的研究工作,当时应用较广泛的病毒是松毛虫CPV病毒和棉铃虫NPV病毒[8],其防治效果显著高于化学农药,且在环境中不造成大面积有毒化学物质残留,有利于农业生产的可持续发展,维持生态平衡。目前,已鉴定出涵盖15个科的600多种昆虫致病性病毒[9]。之前研究人员在灰飞虱体内鉴定出多种昆虫病毒,如Himetobi P virus(HiPV)、Laodelphax striatellusiflavirus 1(LsIV1)等[10-12],这暗示灰飞虱体内有较多昆虫病毒种类。鉴定灰飞虱体内病毒种类,不仅可以丰富我国昆虫病毒资源库,同时也为利用昆虫病毒进行生物防治灰飞虱打下良好的基础,对灰飞虱的综合防治具有参考价值。
常规的病毒检测方法主要有核酸检测法、酶联免疫法、电镜法以及近年发展起来的高通量测序技术,但只有高通量测序能满足对新病毒的鉴定和检测。高通量测序技术主要通过宏基因组测序、宏转录组测序、小RNA深度测序3种方法来鉴定病毒,具有检测成本较低、无序列依赖性等优点[13],还可检测到生物体内大部分含量较低的病毒基因[14]。昆虫具有天然的RNAi抗病毒机制[15-16],当外来的病毒在其体内复制时,会激活该机制产生针对入侵病毒靶RNA的siRNA,并结合和降解病毒RNA。siRNA通常只有18-30 nt,可轻易与细胞中的mRNA、tRNA和rRNA区分开,因此使用小RNA深度测序技术分析昆虫体内siRNA,进而鉴定病毒种类成为一种简便可行的方法。本研究利用小RNA深度测序技术对灰飞虱体内昆虫病毒资源进行分析鉴定,为今后利用昆虫病毒进行生物防治灰飞虱奠定基础。
1 材料与方法
1.1 材料
1.1.1 昆虫种群 供试昆虫灰飞虱种群采集自江苏省海安县,由江苏省农科院植保所植物病毒研究室经多代筛选获得RSV高带毒种群(带毒率90%以上)和无毒(RSV)种群,两个种群在实验室常年维持。灰飞虱种群参照刘海建等[17]的方法筛选获得。
1.1.2 主要试剂 Trizol试剂购自Invitrogen公司;Small RNA Sample Pre Kit购自Illumina公司;PrimeScriptTM1st Strand cDNA Synthesis Kit、高保真DNA聚合酶和pMD18-T克隆载体购自TaKaRa公司;大肠杆菌DH5α菌株由本实验室保存;其余试剂为国产分析纯。
1.2 方法
1.2.1 灰飞虱总RNA的提取 灰飞虱RSV高带毒和无毒种群中各取4-5龄若虫100头,样品混合后液氮研磨,用Trizol试剂提取总RNA(参照Trizol试剂说明书进行)。取少量RNA用NanoDrop 2000微量紫外分光光度计测定浓度和纯度(OD268/280比值),1%琼脂糖凝胶电泳检测RNA质量和完整性。
1.2.2 文库构建和测序 RNA检测合格后,使用Small RNA Sample Pre Kit构建文库。利用小RNA的5′端和3′端特殊结构(5′端有完整磷酸基团,3′端有羟基),以总RNA为起始样品,直接将小RNA两端加上接头,然后反转录合成cDNA。随后经PCR扩增、PAGE胶电泳分离目标DNA片段,切胶回收即得到cDNA文库。库检合格后,在Illumina HiSeq 2000测序平台进行高通量测序,委托测序公司完成。
1.2.3 样本病毒分析 测序获得的原始数据序列(raw reads)中,去除不合格reads(低质量、N比例大于10%、5′接头污染、无3′接头序列和插入片段、含有polyA/T/G/C),得到高质量clean reads,筛选其中长度为18-26 bp的sRNA进行后续分析。用bowtie将过滤后的sRNA与GenBank Virus RefSeq核酸数据库进行比对(允许1 mismatch),对样品中的病毒种类进行初步鉴定。使用velvet[18-19]和PFOR[20]软件对sRNA进行短序列拼接,获得contigs。Velvet软件拼接的K-mer参数为17,PFOR软件拼接的参数为“-x 5”。将拼接所得contigs进行分类注释,使用数据库为:NCBI Nr(NCBI nonredundant protein sequences)、NCBI Nt(NCBI nonredundant nucleotide sequences)、GenBank Virus Ref-Seq Nucletide和GenBank Virus RefSeq Protein数据库。比对采用Blast算法,参数限制e-value(Blastn:1E-6,BlastX:1E-4),得到候选病毒列表。将用bowtie初步鉴定的病毒种类与候选病毒列表比较,评估候选病毒的有效性,鉴定出灰飞虱病毒种类。
1.2.4 新病毒的RT-PCR检测和序列分析 根据测序分析结果,在灰飞虱体内发现一种与类复制酶置换四体病毒存在较高同源性的病毒,这类病毒尚未在半翅目昆虫中报道,故对该病毒进行基因检测。根据匹配的contigs序列,设计2对特异性引物,Plv1-F:5′-ACAACGACAATGGACGCAAGCAACCC-3′,Plv1-R:5′-TGATCCGTCCATCTGTTTGAAATCTGG-3′,Plv2-F:5′-CCCAGATTTCAAACAGATGGAC GG-3′,Plv2-R:5′-GTAGAGGGCCAGGCAGAACTCC-3′。用Trizol试剂提取灰飞虱总RNA,利用PrimeScriptTM1st Strand cDNA Synthesis Kit和Random 6 mers引物反转录为第一链cDNA后,进行PCR扩增反应。PCR产物经1%琼脂糖凝胶电泳分析,回收目的基因片段与pMD18-T载体连接,转化大肠杆菌DH5α感受态细胞,挑取阳性单菌落测序。引物合成和测序由生工生物工程(上海)公司完成。
测序完成后根据引物去除两端冗余序列,获得病毒基因片段信息。序列同源性分析和多重比对使用NCBI的BLAST程序(http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi)和DNAstar软件的MegAlign程序完成。聚类分析及进化树构建利用MEGA-X软件[21]采用邻接法[22](neighbor-joining)完成,核酸序列选择Kimura-2 参数(Kimura 2-parameter)模型,氨基酸序列选择泊松修正(Poisson Correction)模型,进化树的可信度使用1 000次Bootstrap Replications进行验证。
2 结果
2.1 小RNA测序获得灰飞虱体内病毒序列信息
灰飞虱小RNA深度测序后得到16 551 978条原始序列,经质控后获得16 316 588条高质量clean reads,其中长度为18-26 bp的sRNA为15 342 565条(94.03%)。sRNA总长度380 355 818 bp,拼接后共获得13 816条contigs,分类注释后共得到病毒序列296条,与13种病毒序列一致或具有较高同源性(表1)。sRNA经bowtie比对GenBank Virus RefSeq核酸数据库,有35 134条reads可匹配的病毒序列,所属病毒种类涵盖上述13种病毒,验证了这些病毒种类的有效性。
2.2 灰飞虱体内病毒种类鉴定
鉴定的13种病毒分别属于8个病毒科和2种未分类RNA病毒(表1)。由于测序所用昆虫种群携带RSV,因此在获得的全部病毒contigs中,匹配RSV的contigs占绝对数量优势(78.04%),该病毒属于白纤病毒科纤细病毒属,既是植物病毒,也是昆虫病毒。其余7个病毒科均是专性寄生昆虫的病毒科,与昆虫RNA病毒相关的科2个,传染性软腐病病毒科和双顺反子病毒科,有3种病毒Laodelphax striatellushoneydew virus 1、LsIV1和HiPV,此前均已在灰飞虱体内发现并报道。鉴定的5个属于昆虫DNA病毒的科分别为浓核症病毒亚科、昆虫痘病毒亚科、虹彩病毒科、多分体DNA病毒科和杆状病毒科,除虹彩病毒已在灰飞虱体内发现外,其余尚未在灰飞虱体内报道,但浓核症病毒已在半翅目的蚜虫和木虱体内报道,杆状病毒已在与灰飞虱亲缘性最近的昆虫褐飞虱体内发现。2种分类地位暂不明确的正链RNA病毒中,一个与Nilaparvata lugenscommensal X virus同源,在褐飞虱体内发现,推测为一种卫星病毒[23]。另一个与果蝇A病毒(Drosophila A virus,DAV)存在较高相似性,DAV是一种存在于果蝇体内特殊的类复制酶置换四体病毒[24],目前研究较少,故认为在灰飞虱体内发现了一种新病毒。

表1 灰飞虱中经测序比对鉴定的病毒Table 1 Identified viruses in Laodelphax striatellus via alignment
2.3 一种新病毒的基因检测和序列分析
为了获取新病毒的基因序列,根据其与DAV匹配的contigs序列设计引物,以灰飞虱总RNA为模板,经RT-PCR扩增出2个符合目的基因大小的特异条带(图1)。经克隆测序表明,所扩增2个片段长度分别为1 167和803 bp,2个片段拼接得到长度为1 932 bp的序列。经Blastn比对,其核苷酸序列在NCBI数据库中没有发现有意义的匹配。BlastX比对发现,与其氨基酸序列相似性最高的主要为下列病毒依赖RNA的RNA聚合酶(RNA-dependant RNA polymerase,RdRP):Smithfield permutotetra-like virus(GenBank登录号:QIJ25871.1)1-642位(56.68%)、一株野田村病毒科病毒(A Nodaviridae virus)(QIJ25871.1)1-644位(56.90%)、Culex Daeseongdong-like virus(AXQ04818.1)1-642位(56.59%)、DAV(AKH67411.1)1-645位(53.70%)、Vespa velutina associated permutotetra-like virus 2(QGL51736.1)1-645位(52.47%) 以 及Hubei permutotetra-like virus 11(YP_009337276.1)1-642位(51.08%)。这些RNA病毒的分类地位暂不明确,但它们有一个共同特点,即在复制酶RdRP的掌型亚结构域(Palm subdomain)中,保守区域的排列发生了置换,GDD box(C motif)位于A和B motif之前,呈“C-A-B”样式排列,这一特点与复制酶置换四体病毒科(Permutotetraviridae)病毒的RdRP相同。将这些病毒进行氨基酸序列比对,在新病毒RdRP序列中也发现了保守的A、B和C motif,并且C motif同样发生了置换,位于A motif上游(图2),说明其RdRP掌型亚结构域保守区同样呈“C-A-B”样式排列。这些结果暗示扩增的病毒基因片段确实来源于一种新的类复制酶置换四体病毒,将其暂命名为Laodelphax striatelluspermutotetra-like virus(LsPLV),这是首次在半翅目昆虫中发现类复制酶置换四体病毒。

图1 LsPLV RdRP基因片段的扩增Fig.1 PCR amplification of RdRP gene segment

图2 类复制酶置换四体病毒RdRP氨基酸序列比对显示“C-A-B”motif的排列Fig.2 Amino acid alignment of permutotetra-like virus RdRP showing C-A-B motif arrangement
2.4 新病毒LsPLV RdRP基因的系统进化分析
从上述NCBI数据库BlastX比对结果中,选取15个代表性病毒分离物,利用MEGA-X软件将LsPLV与这15个病毒RdRP序列进行系统进化分析。结果显示,核酸和氨基酸序列系统进化树相似,这些病毒的RdRP可聚类到2个大的分支中(图3),但均没有病毒分离物与LsPLV构成最小分支,说明LsPLV与已报道的类复制酶置换四体病毒存在较大的进化差异,其核苷酸序列在NCBI数据库中匹配不到有意义的结果也说明了这一点。在病毒聚类的2大分支中,分离物采集地没有明显的地域界限,由于很多分离物的寄主信息不完善,仅显示“节肢动物”、“昆虫”等信息,因此,也很难区分出这些分离物的寄主界限,但可以初步说明这类病毒在昆虫中是广泛存在的,不同寄主来源的病毒之间基因差异较大。最后,已知自然条件下类复制酶置换四体病毒仅侵染无脊椎动物,但16个分离物中,有2个病毒并不是在昆虫体内发现,而是利用高通量测序从鸟类(A Nodaviridae virus)和植物紫花地丁(VpPLV)中检测到。
3 讨论
病毒几乎可以感染所有的生命体,是全世界种类十分庞大的微生物,也是引起人类和动植物疾病的主要病原体类型之一。一般来说,有两大类病毒与农业生产密切相关,一类是引起动植物病害的病毒,一类是作为生物防治资源的病毒。昆虫病毒是一类理想的生物防治资源,利用昆虫病毒研制的病毒杀虫剂具有致病力强、专一性强、抗逆性强和生产简便等优点[6],发展前景十分广阔。目前研究较多、应用较广的昆虫病毒主要是核型多角体病毒(NPV)、颗粒体病毒(GV)和质型多角体病毒(CPV)等[25],这些病毒主要靶向鳞翅目害虫,而防治半翅目害虫的昆虫病毒在生产上尚不多见。灰飞虱是半翅目中重要的病毒媒介昆虫,鉴定灰飞虱体内昆虫病毒种类,对于挖掘昆虫病毒资源以及今后的生防研究和应用具有重要意义。
利用传统测序技术鉴定病毒可能会漏检含量较低的病毒,与之相比,高通量测序技术可避免这一缺陷,提高病毒种类筛查的效率和全面性。近年来,随着高通量测序技术的发展,依靠该技术报道出来的病毒种类越来越多,试剂成本越来越低,应用领域越来越广,该技术已成为一个方便快捷的研究工具[13-14],它极大地缩短了分析工作所花费的时间。本文图3系统进化分析所涉及的16个病毒分离物中,除Thosea asigna virus(TaV)[26]、Euprosterna elaeasa virus(EeV)[27]和DAV[24]是通过传统测序方法获得,其余均是2015年之后通过高通量测序技术陆续发现的,便是该技术推动病毒鉴定研究的直观体现。
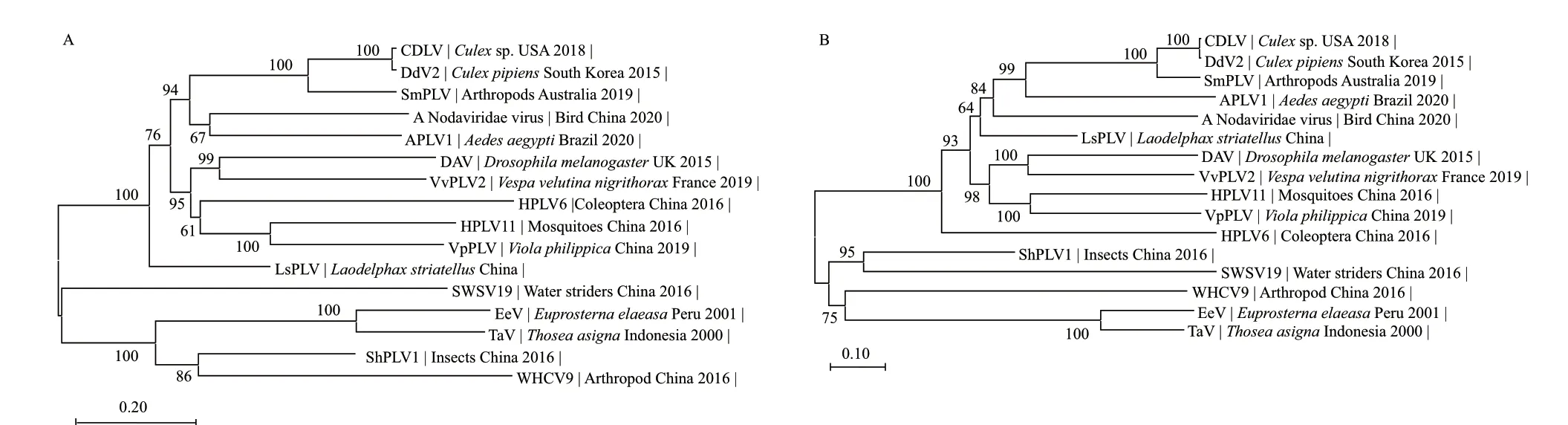
图3 根据不同类复制酶置换四体病毒RdRP序列构建的系统进化树Fig.3 Phylogenetic tree based on RdRP sequence consistency of different permutotetra-like viruses
本研究对灰飞虱携带的病毒种类进行了全面分析,通过小RNA深度测序检测灰飞虱RNAi免疫机制产生的siRNA,再根据小RNA之间存在重叠序列这一特点,将其组装成较长的contigs,通过数据库比对鉴定病毒种类,最终从灰飞虱中鉴定出13种病毒,涉及8个病毒科和2种未分类病毒。由于测序所用昆虫种群携带RSV,因此匹配RSV的contigs在数量上占绝对优势。其余病毒均为专性寄生的昆虫病毒,其中,3种RNA病毒和1种DNA病毒(虹彩病毒)已在灰飞虱体内报道[10-12,28],5种病毒已在半翅目的褐飞虱、蚜虫、木虱等昆虫体内发现[29-31],只有昆虫痘病毒、茧蜂病毒(多分体DNA病毒科)和一个类似DAV的病毒尚未在灰飞虱以及其它半翅目昆虫中发现。本研究所用灰飞虱来自实验室常年饲养种群,灰飞虱不同地理种群所携带的昆虫病毒种类也不尽相同[32],因此,本次鉴定的病毒种类是少于自然界中实际可侵染灰飞虱的病毒种类,更多的病毒种类仍需今后进一步挖掘。在鉴定的病毒中,很多DNA病毒的相似分离物已经被用于农业害虫生物防治研究和应用,而RNA病毒相关生物防治研究还较少,这些病毒的发现为今后生防研究和应用提供了候选病毒资源。
对灰飞虱中类似DAV的病毒进行基因检测,获得了RdRP基因1-1 932位核酸序列,经Blast比对和系统进化分析,在氨基酸序列中发现RdRP掌型亚结构域保守区呈现复制酶置换四体病毒科病毒所具有的“C-A-B”排列样式[26-27],确定该病毒是一种新的类复制酶置换四体病毒,暂命名为LsPLV。系统进化分析显示,类复制酶置换四体病毒在昆虫中广泛存在,不同寄主来源的病毒之间基因差异较大。与LsPLV同源性较高的病毒分离物中,有2个病毒并不是在昆虫体内检测到,而是在鸟类和植物样品中发现。根据已知信息,自然条件下这类病毒仅侵染无脊椎动物,因此,我们认为这2个病毒来自测序样本的“环境污染”,一个可能来自鸟消化道中尚未消化的昆虫体内的病毒残留,另一个可能来自植物叶片表面上昆虫排泄物中病毒残留。这一现象也说明自然界中这类病毒在昆虫体内广泛存在,同时也暗示这类病毒粒子结构相对稳定、不易降解,能在自然环境下存活一定时间,较高的结构稳定性使得该病毒具备进一步开发为昆虫病毒杀虫剂的一个潜在优势。
本研究首次在半翅目昆虫中发现类复制酶置换四体病毒。目前,LsPLV的全基因组测序正在进行中,其对灰飞虱的致病性还不明确,该病毒是否可侵染其他稻飞虱(褐飞虱、白背飞虱)及其它半翅目昆虫也不清楚,这些问题都将在今后的工作中进一步研究,为LsPLV在生物防治中的早日应用奠定基础。
4 结论
本文利用小RNA深度测序技术在灰飞虱体内鉴定了13种病毒,涉及8个病毒科和2种未分类病毒,并首次在半翅目昆虫中发现一种新的类复制酶置换四体病毒LsPLV。

