超氧化物歧化酶翻译后修饰的研究进展
贾海红 李冰清
(山东第一医科大学(山东省医学科学院)基础医学院(基础医学研究所)病原生物学实验室,济南 250062)
氧对于需氧生物来说极其重要,氧参与的代谢活动是正常生命活动不可或缺的,它经常会伴有活性氧(reactive oxygen species,ROS)的产生[1]。活性氧在机体中有双重作用,生物体内活性氧的含量通常处于平衡状态。当机体内吞噬细胞在细胞膜受到刺激时,通过呼吸暴发机制,产生大量ROS,这时候ROS是吞噬细胞发挥吞噬和杀伤作用的主要介质。但是在ROS的产生和清除失去平衡时,常常会造成ROS对机体的损伤,比如造成酶失活、蛋白质损伤、脂质过氧化和DNA突变等[2]。为了控制ROS的水平,防止氧自由基对细胞的破坏,保护细胞免受不良环境的影响,几乎所有需氧生物都进化出了一套发达的氧化防御体系,来清除细胞有氧代谢产生的各种ROS[3]。其中,超氧化物歧化酶(superoxide dismutase,SOD)便是该体系中的抗氧化酶之一,它是一种能够催化超氧化物通过歧化反应转化为O2和H2O2的酶[4]。
SOD在需氧生物中普遍存在,所有SOD催化中心都包含有一个金属离子,根据其结合金属离子的不同,SOD可以分为4种类型:Cu/ZnSOD、FeSOD、MnSOD和NiSOD。在哺乳动物中含有3类:SOD1(Cu/ZnSOD)、SOD2(MnSOD)、SOD3(胞外Cu/Zn SOD)。最近发现NiSOD只存在于某些极少数原核细菌中[5-6]。SOD被认为是抗氧化系统的第一道防线,在保护细胞免受氧自由基的毒害中发挥着重要作用[4]。研究表明,SOD与胃病、帕金森综合征、老年痴呆症、心血管疾病等有着密切关系[7-10]。近年来,SOD也在农业、食品、化妆品领域表现出很大的应用潜力。随着分子生物学的发展,对该酶进行了广泛深入的研究,尤其是在酶基因的表达、调控方面。目前对于SOD活性调节,无论是从相关基因的转录水平还是翻译水平都有大量的文献报道[11-13]。翻译后修饰在调节SOD 活性中也起重要作用,但是通过翻译后修饰来调控SOD活性仍处于起步阶段,是一个新的研究热点领域。
目前报道的SOD的翻译后修饰方式主要有硝基化、磷酸化、S-谷胱甘肽化、糖基化以及蛋白翻译后修饰新方式次磺酸化等,这些修饰方法的生理意义包括影响酶的活性、稳定性,调控与其他蛋白相互作用,调控酶的细胞内定位等[14-15]。但是目前对SOD的翻译后修饰的调控研究仍不深入。本文对近年来SOD的翻译后修饰的研究进展进行综述,总结了几种翻译后修饰的方式及翻译后修饰对SOD酶活性影响,并讨论其病理生理意义。
1 硝基化对SOD酶活性的调控
蛋白质酪氨酸(Tyr)和色氨酸(Trp)硝基化是一种重要的蛋白质翻译后修饰,能引发一系列病理生理过程,其被认为与炎症、神经退行性疾病、心血管疾病和癌症等疾病相关[16-18]。在SOD翻译后修饰领域中,硝基化是研究最广泛修饰之一[14]。
1.1 硝基化对Cu/ZnSOD酶活性的影响
Ischiropoulos等[19]首次报道了牛Cu/ZnSOD与过氧亚硝酸盐(ONOO-)反应生成3-硝基酪氨酸残基。晶体结构表明,Cu/ZnSOD的硝基化位点为Tyr108[20]。修饰后的酶活性与野生型Cu/ZnSOD酶活性相同[19]。与牛Cu/ZnSOD不同的是人Cu/ZnSOD的氨基酸序列中没有Tyr残基,只有一个色氨酸残基(Trp32)。通过质谱(MS)和高效液相色谱(HPLC)-光电二极管阵列分析发现,人重组Cu/ZnSOD与ONOO-/CO2和髓过氧化物酶/H2O2/亚硝酸盐体系反应生成的6-硝基色氨酸是主要硝化产物。而6-硝基色氨酸可能是内源性活性氮(RNS)存在的一种新的生物标志物[21-22]。修饰后的人Cu/ZnSOD酶活性均降低,在ONOO-修饰和髓过氧化物酶系统修饰时分别有30%和15%的酶活性损失[21-22]。但是,Alvarez等[23]报道人Cu/ZnSOD经过ONOO-修饰后失去了90%的酶活性。因为他们在硝化体系中没有使用CO2,从ONOO-裂解中产生的羟基自由基类似物可能对酶活性造成了影响。之后,Taylor等[24]报道W32F突变体降低了SOD的G93A突变体的细胞毒性及在家族性肌萎缩侧索硬化小鼠模型(FALS)中形成细胞质内含物的倾向。这一证据表明,Trp32的硝化作用可能对Cu/ ZnSOD在FALS中的细胞毒性产生一定影响。
1.2 硝基化对Fe/MnSOD酶活性的影响
1996年,MacMillan-Crow等[25]首次报道了人MnSOD中的酪氨酸硝化作用在人移植肾慢性排斥反应中的作用。研究发现虽然病人体内MnSOD总蛋白升高,但是硝化后酶活性降低。体外研究发现重组人MnSOD与ONOO-反应完全抑制了酶的活性,并诱导了硝基酪氨酸和二酪氨酸的生成。作者利用质谱分析发现MnSOD的9个酪氨酸残基中有3个(Y34,Y45,Y193)发生了硝基化反应。其中ONOO-能完全使Y34F MnSOD突变体活性消失,除了Y34位点,其他两个位点也可以灭活Y34F MnSOD突变体。研究表明,硝基化Tyr残基的氧化产物二酪氨酸也有助于MnSOD酶的失活,尤其是在突变酶中更有效[26-27]。相反地,有研究发现Tyr34残基是ONOO-唯一的硝化位点,该Tyr残基位于锰活性位点约5.5Å之内,并且随着Tyr残基硝化速率的增加,MnSOD活性逐渐丧失[19,28]。Quijano等[29]也发现MnSOD中加入一个硝基后,大部分酶活性丧失。Quint等[30]研究表明,约75%的Tyr34被硝化,而其他Tyr残基未被硝化,而且硝化后酶活性被抑制了将近80%,此外他们还解析出了硝基化的人MnSOD的晶体结构。Neumann等[31]通过使用氨基酰-tRNA合成酶和tRNA对在基因编码位点进行3-硝基酪氨酸位点特异性结合,使人类MnSOD的Tyr34加入3-硝基酪氨酸。他们发现,对人MnSOD中Tyr34进行定量硝化可以使其酶活性丧失97%。总之,可以得出这样的结论:ONOO-几乎只硝化Tyr34,而且单独硝化Tyr34足以降低人MnSOD的酶活性。ONOO-首先与蛋白质金属中心反应,并促进金属中心相邻蛋白质Tyr残基的硝化。这一机制可以解释MnSOD的Tyr34与其他8个酪氨酸残基相比更容易被特异硝化。根据以上研究结果提出了3种被硝基化修饰后MnSOD失活的机制,即(1)与底物结合后对空间的干扰,(2)在催化过程中支持质子转移的氢键网络减弱,(3)硝基的存在和由硝基引起的氧化还原反应有关的静电效应[28-32]。
研究发现ONOO-同样催化大肠杆菌和卵圆假单胞菌Fe-SOD发生硝基化反应,使酶活性降低[19,28]。Larrainzar等[33]报道,来自植物豇豆细胞的重组FeSOD通过与ONOO-供体 SIN-1(3-吗啉斯德酮亚胺,3-morpholinosydnonimine,SIN -1)孵育被硝化灭活,同时产生NO和O2。最近有科学家报道,克氏锥虫的两种亚型Fe-SOD(线粒体Fe-SODA和胞质Fe-SODB)均能被ONOO-硝化和灭活[34]。因此,我们认为活性氮(RNS)可能是通过硝化关键的Tyr残基,比如人MnSOD的Tyr34位点,来灭活大部分的Fe/MnSOD。
2 磷酸化对SOD酶活性的调控
丝氨酸(Ser)/苏氨酸(Thr)/酪氨酸(Tyr)残基的磷酸化是蛋白质典型的翻译修饰之一。Csar等在用粒细胞集落刺激因子(G-CSF)治疗髓细胞时首次报道了胞浆Cu/ZnSOD的短暂磷酸化。他们发现用G-CSF处理后,Cu/ZnSOD的表达量和活性都降低,这可能是磷酸化修饰后Cu/ZnSOD容易水解。在这种情况下,SOD水平的降低和O2水平的升高可能有助于G-CSF对髓系细胞信号转导的调控[35]。Archambaud等[36]报道了细菌SOD的磷酸化,研究发现李斯特菌细胞质MnSOD在丝氨酸和苏氨酸上发生了磷酸化,当细菌达到平台期时酶活性降低。而最活跃的非磷酸化MnSOD在细菌培养过程中能分泌到细胞外,而且分泌的MnSOD可能是该细菌的一个毒力因子,可以抵消宿主吞噬细胞的作用。此外,他们观察到在感染细胞中分泌的MnSOD被磷酸化并且下调表达,这可能是由一种未知的细胞激酶介导的。该机制可作为宿主吞噬细菌控制细胞内感染的新策略。磷酸化蛋白组学分析也观察到了一种革兰氏阴性细菌空肠弯曲杆菌中也发现了磷酸化的FeSOD[37]。线粒体MnSOD也被预测为磷酸化底物,之后利用双向电泳和[γ-32P]-ATP标记的MS分析,首次报道了在马铃薯线粒体中被磷酸化的MnSOD,但未进行活性研究[38]。Hopper等[39]利用磷酸化蛋白组技术也报道了离体猪心脏线粒体中MnSOD的磷酸化。此外,Ca2+诱导的线粒体MnSOD去磷酸化能使酶的活性最多增加2倍。这一证据表明MnSOD活性可能被Ca2+依赖的信号通路控制,以调节基质中超氧化物或H2O2的稳态水平。将大鼠神经母细胞瘤细胞线粒体蛋白提取物及同位素标记的[γ-32P]-ATP孵育,测定大鼠线粒体MnSOD磷酸化位点为Ser82,但尚未进行活性研究[40]。
综上所述,磷酸化作为SOD的一种新的调控机制在生物界可能是普遍存在的无论是细菌还是脊椎动物。虽然与SOD磷酸化相关的疾病还没有报道,但是这一领域的进一步研究可能导致SOD在细胞氧化损伤和氧化还原信号传导中的功能有轻微调整。为了解析整个调控机制,还需要筛选催化SOD磷酸化的特异性激酶和去磷酸化磷酸酶、鉴定SOD的磷酸化位点,以及更详细地分析磷酸化后SOD功能的变化。
3 S-谷胱甘肽化对SOD酶活性的影响
S-谷胱甘肽化是通过添加谷胱甘肽对蛋白质半胱氨酸(Cys)残基进行翻译后修饰,氧化或亚硝化应激可促进这种修饰,这种修饰也发生在未受应激的细胞中。它可以通过调节蛋白质功能和防止蛋白质硫醇的不可逆氧化来调节多种细胞过程[41]。从人红细胞中分离到谷胱甘肽化的Cu/ZnSOD,Cys111为修饰位点,Cys111位点谷胱甘肽化修饰后酶活性没有显著变化,但促进了Cu/ZnSOD突变体酶活性的降低,使Kd增加了2倍[42]。家族性肌萎缩侧索硬化(FALS)是一种以进行性运动神经元丧失为特征的致命疾病。研究提出人Cu/ZnSOD的S-谷胱甘肽化导致其酶活性降低,促进其聚集,而聚集后与FALS的发生有关[43]。从嗜碱假交替单胞菌(Ph)中也分离得到S-谷胱甘肽化的FeSOD,其S-谷胱甘肽化位点是一种活性很高的半胱氨酸残基(Cys57)。这种修饰可以发生在假交替单胞菌中也可以发生在过表达的大肠杆菌细胞中。虽然与未修饰的酶相比,修饰后酶活性降低了不到10%,但是FeSOD的S-谷胱甘肽化修饰保护了酶免受Tyr硝化和ONOO-硝化而失活,并且细胞遭受氧化胁迫时这种修饰会增强[44]。因为假交替单胞菌在寒冷条件下能很好地抵抗活性氧的损伤,这种修饰被认为是一种提高细胞抗氧化能力的冷适应策略[44]。研究还发现了重组大鼠MnSOD在大肠杆菌中表达时发生了S-谷胱甘肽化,但在这种情况下还没有酶活性相关的研究报告[43]。
4 糖基化对SOD酶活性的影响
糖基化是在糖基转移酶作用下将糖类转移至蛋白质和蛋白质特殊的氨基酸残基上形成糖苷键的过程。蛋白质的糖基化是一种重要的蛋白翻译后修饰,有调节蛋白质功能的作用。糖尿病患者肾脏、肝脏等器官的蛋白易被糖基化修饰。Cu/ZnSOD的糖基化是SOD最早发现的翻译后修饰之一[42]。Cu/ZnSOD的糖基化能导致酶的降解,而酶活性的丧失可能是导致糖尿病患者患病的的生理原因[45]。虽然我们在Cu/ZnSOD的糖基化方面有很多研究,但关于Cu/ZnSOD的糖基化有了很好的综述,本文不做进一步的详细介绍[43]。
根据上文介绍的4种关于SOD的翻译后修饰,图1总结了硝化、磷酸化、S-谷胱甘肽化和糖基化对SOD活性的影响。由图中可以看出,以上各种修饰对酶活性的调控大部分都是负调控。
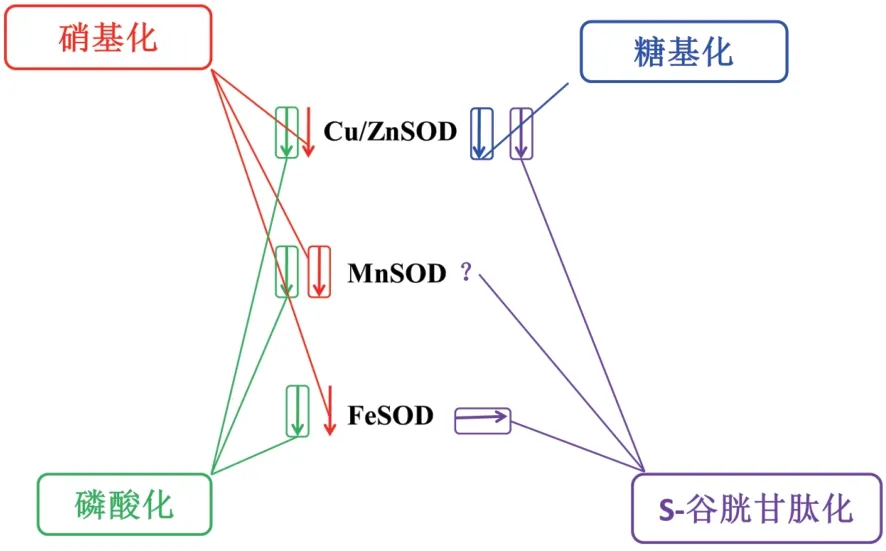
图1 翻译后修饰对SOD活性的影响Fig. 1 Effect of post-translational modification on SOD activity
5 乙酰化修饰对SOD酶活性的调控
乙酰化修饰(acetylation)是指在酶(或非酶)的作用下将乙酰CoA的乙酰基团转移至蛋白质氨基酸残基上,是重要的蛋白质翻译后修饰类型之一。其在表观调控过程中至关重要,参与了生命活动的各个方面,并且修饰过程是可逆的。乙酰化修饰分布十分广泛,无论是真核还是原核生物,都大量存在这种修饰。乙酰化修饰普遍存在于代谢酶之中,并且调节代谢通路及代谢酶的活性。大肠杆菌FeSOD蛋白12、44、51位的Lys均能发生乙酰化修饰,另外CobB能催化FeSOD去乙酰化,同时发现去乙酰化后FeSOD的酶活降低[46]。子宫平滑肌瘤中MnSOD乙酰化增加导致其酶活性降低,而恢复去乙酰化的MnSOD则能抵抗高浓度的ROS[47]。位于线粒体中的去肿瘤抑制因子SIRT3可以去乙酰化并激活MnSOD以清除ROS。从而保护细胞免受氧化损伤[48]。肾透明细胞癌786-O中MnSOD的去乙酰化能增强其细胞增殖能力[49]。研究表明SOD能被乙酰化和去乙酰化修饰并且修饰影响了SOD酶活性。
6 次磺酸化修饰对SOD酶活性的调控
次磺酸化(sulfenation)是2018年公布的生物物理学名词。次磺酸化是蛋白质半胱氨酸的自由巯基(-SH)被氧化形成次磺酸(-SOH)的过程。次磺酸化出现在一些酶类的中间反应过程中,进一步可能氧化为更高级产物(如亚磺酸、磺酸),也可以被可逆还原为自由巯基。ALS是一种致命的神经退行性疾病,其重要病理特征之一就是由Cu/ZnSOD(SOD1)以及TAR DNA结合蛋白43(TDP-43)在中枢神经系统的运动神经元以及星形胶质细胞中形成纤维样聚集体[44,50]。但是散发型ALS发病的根本原因仍不清楚。2018年,梁毅教授研究组发现病理浓度H2O2都可以使得野生型SOD1发生次磺酸化修饰,而且这种可逆的修饰对于SOD1生长纤维和发挥病理功能至关重要。研究发现散发型ALS病人脑脊液样本中的次磺酸化修饰SOD1水平显著高于对照组脑脊液样本,因此次磺酸化修饰SOD1可能是散发性ALS早期诊断生化指标。脑脊液中次磺酸化修饰的SOD1与散发型ALS的相关性这一发现将为早期ALS的诊断和治疗提供一条全新的途径[13]。
7 SUMO化修饰对SOD酶活性的调控
SUMO是一类重要的类泛素蛋白,SUMO化蛋白翻译后修饰(SUMOylation),又称为“小泛素化”,是一种普遍存在、动态可逆的蛋白翻译后修饰类型,在细胞中起调节蛋白的结构、增强蛋白质的活性和功能稳定性作用。哺乳动物细胞中有3种比较常见的SUMO化蛋白:SUMO1、SUMO2和SUMO3。研究报道SOD1可被SUMO1、SUMO2/3修饰,其中SUMO-1对SOD1在第75位赖氨酸(Lys75)和Lys9修饰,SUMO-1修饰后野生型和突变型SOD1所形成的胞浆内聚集均会增加,而且SUMO-1能够被招募至SOD1所形成的聚集上,与SOD1在细胞内聚集体上有共定位现象,SUMO-1可以稳定野生型和突变型SOD1而不易降解,进而可能对由SOD1突变所引起的FALS的发病产生影响。而SUMO2/3的修饰位点为Lys75,可增加SOD1突变蛋白的聚集,增加突变蛋白的稳定性[51]。
8 亚磺酸化修饰对SOD酶活性的调控
香港浸会大学环境与生物分析国家重点实验室蔡宗苇课题组近日于Small Structures上发表的研究成果表明,1-硝基芘(1-nitropyrene,1-NP)可以通过攻击SOD1的Cys111位点产生亚磺酸化,进而抑制SOD活性并导致ROS增加。因此,提出了1-NP诱导细胞毒性和ROS生成的新机制[52]。
9 总结与展望
酶活性的发挥是一个复杂的过程,仅仅转录或者翻译水平的上调或者下调,并不能推断最后酶活性的增强或减弱,同时涉及到翻译后修饰,在组织、细胞及亚细胞中的定位以及与其他的蛋白质之间的相互作用。鉴于 SOD在抗氧化过程中发挥的重要作用,对其各个环节的调控都应引起足够的重视。随着分子生物学的迅猛发展,翻译后修饰对酶活性的影响得到广泛的重视。蛋白质翻译后修饰是影响SOD酶活性的重要环节,如前所述,目前发现的对于SOD的翻译后方式主要是硝基化、磷酸化、糖基化和S-谷胱甘肽化等。其中硝基化和磷酸化对SOD酶活性影响的研究较多,而且修饰后酶活性都降低。除了以上几种常规的修饰,越来越多小众修饰也逐渐成为研究热点,次磺酸化修饰、亚磺酸化修饰、SUMO化修饰等。此外,对于甲基化等一些常见的修饰也对SOD酶活性产生影响[53],目前相关研究尚不多,但是很多研究具有开创性。对于修饰后SOD酶活性降低的生理意义,我们推测翻译后修饰有利于维持体内正常的氧化还原状态。但是,目前翻译后修饰对SOD酶活性影响的研究相对较少,翻译后修饰影响SOD酶活性的机制也尚不明确,修饰后的生理意义也不清楚。因此,对翻译后修饰影响SOD酶的方式和机制的进一步研究,以及各种新修饰方式的研究将会是未来关注的焦点。

