生物脱氮中工程纳米颗粒的毒害作用及减毒措施的研究进展
张漫漫 何腾霞 丁晨雨 陈梦苹 吴启凤
(贵州大学生命科学学院/农业生物工程研究院 山地植物资源保护与保护种质创新教育部重点实验室 山地生态与农业生物工程协同创新中心,贵阳 550025)
氮化合物在生命代谢过程中起着重要的作用,通常以有机氮和无机氮两种形式存在,有机氮包括蛋白质、氨基酸、酰胺和尿素等;无机氮主要为铵态氮、硝态氮和亚硝态氮等[1]。然而水体中积累过多的无机氮,尤其是铵态氮大量积累易消耗水体中的溶解氧,阻碍氧在鱼鳃中传递,威胁水生生物的生存,并引发大量细菌繁殖,使水体进一步恶化并发出难闻的气味,从而影响人体健康[2];硝态氮和亚硝态氮作为铵态氮的硝化产物,会阻碍血氧的正常运输,引起机体缺氧窒息。此外,还会引发氯离子流失,扰乱细胞内外钾离子水平等[3-5]。因此,高效去除水体中的无机氮成为近些年的热点。据文献报道,生物脱氮具有高效、低耗及绿色环保等特点,涉及微生物的硝化和反硝化过程,其中硝化过程是在硝化菌的作用下将铵盐逐步氧化为硝酸盐,反硝化除氮是在反硝化细菌的作用下将硝酸盐或亚硝酸盐逐步还原为气态氮的过程,该过程可从根本上解决污水中无机氮超标的问题[6]。
然而,脱氮过程中会受到各种因素的影响,自2005年以来,新型污染物纳米颗粒(nanoparticles,NPs)逐渐兴起,根据其性质可分为金属纳米颗粒和非金属纳米颗粒,按其来源可分为天然纳米颗粒和工程纳米颗粒(engineering nanoparticles,ENPs),因ENPs的径粒较小而具有独特的光学、热学、量子效应等物理化学性质[7-8],被广泛开发应用于化工、医药、航天航空等领域,在生产发展及不合理的使用过程导致大量ENPs排放到土壤及水体中,据研究,全球超过 26-30.9 万t的ENPs产量中有 63%-91% 最终进入垃圾填埋场,8%-28%、0.4%-7%和0.1%-1.5%的ENPs分别释放到土壤、地表水和大气中[9]。目前国内外均有报道ENPs对污水处理中脱氮微生物的影响,如1.25 mg/L的CuNPs会抑制硝化过程的厌氧氨氧化活性[10];CuONPs能阻碍一些硝化或反硝化细菌的生物活性及代谢过程[11];ZnONPs通过影响污泥中硝化细菌的生物活性进而抑制硝化过程等[12]。此外,Gatti作为ENPs毒理学领域研究的首发者,也揭示了ENPs会对人类生命健康造成威胁[13]。因此,明确ENPs对生物的毒害作用尤为重要。
目前降低ENPs毒害作用的研究主要集中在抑制金属纳米颗粒的释放以及提高细菌的抗性方面,通过包裹颗粒[14]、添加硫化物[15]、加入配体[16]或上调细菌糖代谢途径[17]来达到降低毒害作用,但脱氮细菌如何降低ENPs的毒害作用及解毒方式缺乏系统性研究。此论文为进一步研究ENPs在水环境毒害作用提供参考,并为提高生物脱氮处理工艺提供理论支撑。
1 环境中纳米颗粒的来源
环境中存在大量的NPs,源于自然及人为活动,自然存在的NPs包括黏土、多糖、肽聚糖等,生物对自然存在的NPs有较强的适应性,且目前关于天然纳米颗粒在脱氮过程中的相关影响未见报道;人为来源的NPs即ENPs主要是指在人类活动中所产生的NPs如纳米Cu、Ag和ZnO等[18]。与天然NPs相比,ENPs使用更广、生产量更大,由此产生的环境危害更严重。
此外,ENPs可在水、土壤与空气中进行交换和转移,例如汽车及工厂排放的废气含有ENPs,与空气中的微小颗粒发生吸附包裹,伴随降雨进入土壤,随后渗入土壤进而影响地下水或饮用水源,最后危及人类健康。图1概括了ENPs在环境中的存在及转移方式,目前,ENPs主要通过3个途径进入水环境中:(1)通过工业废水、养殖废水、生活污水等大量排放到污水处理系统,随后进入水环境;(2)由于地表垃圾堆积和土壤垃圾填埋所产生的垃圾渗滤液,通过地表与地下径流进入水环境;(3)通过汽车尾气及工业燃烧排放进入到大气,随着降雨或薄雾流进入水环境[19]。进入水体的ENPs会对水生植物或微生物的结构与功能产生潜在的破坏作用,而污水处理收集管网作为ENPs进入环境的重要环节,迫切需要对ENPs在水处理系统的毒害作用进行系统分析及安全性评价。

图1 纳米粒子在环境中的存在和转移方式Fig. 1 Existence and transfer of nanoparticles in the environment
2 工程纳米颗粒对水处理系统的影响研究
随着科技发展,ENPs对水处理系统的影响研究已取得一定的进展,主要集中于ENPs对活性污泥系统与生物膜废水处理系统的影响,其中对脱氮除磷与化学需氧量(chemical oxygen demand,COD)的去除及水处理系统中微生物群落结构变化方面的探究较广泛。大多数ENPs都对废水处理过程存在一定的阻碍作用,其抑制程度与ENPs的浓度及暴露时间呈正相关关系,如Gu等[20]在研究絮凝污泥和颗粒污泥对AgNPs的去除效果中发现,该ENPs会使细菌产生活性氧(reactive oxygen species,ROS)并破坏细胞膜进而抑制生物脱氮过程,具体表现为:在短时间内(12 h)分别添加1、10、50和100 mg/L AgNPs会使絮凝污泥的氨氧化率降低21.0%-24.9%。同样,在Yuan等[21]的研究中,5 mg/L AgNPs会减小活性污泥的絮凝物尺寸,改变生物膜与细菌群落结构,进而降低COD和磷的去除效率,但在持续暴露下会趋向稳定。与之类似,如Zhang等[22]研究AgNPs对生物膜活性和脱氮的效率时发现,0.1 mg/L的AgNPs不会显著抑制生物膜的活性,其可能原因为低浓度的AgNPs可通过生物膜吸附或者沉淀作用降低毒性,而当AgNPs的浓度增加至5 mg/L时,细胞的胞外聚合物(extracellular polymeric substances,EPS)浓度会明显增加,导致膜污染进而抑制生物膜活性。以上结果表明AgNPs的抑制程度与自身的浓度及暴露时间相关。此类情况在其它纳米颗粒的研究中也有体现,如Zheng等[23-24]在研究SiO2NPs对活性污泥系统的影响发现,添加1 mg/L的SiO2NPs对短期和长期系统的脱氮效率均没有显著抑制作用,但当SiO2NPs浓度增加至50 mg/L并暴露70 d后,总氮的去除率从79.6%降至51.6%;而ZnONPs存在条件下,添加10和50 mg/L的ZnONPs于脱氮除磷活性污泥系统中发现,与不存在ZnONPs时总氮去除率(81.5%)相比,4.5 h后总氮的去除率分别降至75.6%和70.8%,相应的出水磷浓度从0 mg/L分别增加至10.3和16.5 mg/L,可能是污泥对其具有聚磷作用,加入ENPs可能会使其从污泥中释放出来,高于进水中磷的浓度(9.8 mg/L),这表明较高浓度的ZnONPs能同时抑制氮和磷的去除。Ni等[25]研究发现,向活性污泥系统添加1 mg/L的ZnONPs,10 h后氨氮去除率从100%降为87%。Tan等[26]研究ZnONPs对MBR系统性能的长期影响及其在系统中的去除行为时发现,ZnONPs浓度为10.0 mg/L时,污泥絮凝物尺寸减小,沉降性较差,引起COD、氮和磷的去除率下降,其原因是纳米粒子吸附到生物膜上使其功能受损。尽管对于ENPs在废水处理方面已经有了大量探究,但主要集中在活性污泥中开展,而活性污泥是一个比较复杂的系统,对ENPs具有吸附和沉淀作用,且存在着多种污染物,会影响对ENPs毒害强度的评估。所以,采用活性污泥作为研究对象很难准确地反应ENPs对硝化与反硝化过程的影响。
3 工程纳米颗粒对微生物脱氮过程的毒害效应
3.1 工程纳米颗粒对微生物硝化过程的毒害作用
硝化过程是指微生物在氨单加氧酶(Amo)、羟胺氧化还原酶(Hao)和亚硝酸盐氧化还原酶(Nxr)的作用下将铵盐(NH4+)逐步氧化为硝酸盐(NO3-)的过程,分为氨氧化(NH4+-NO2-)和亚硝酸盐氧化(NO2--NO3-)两个阶段,分别由氨氧化微生物和亚硝化盐氧化菌完成,氨氧化微生物又包括氨氧化细菌和氨氧化古菌,古菌的发现证实了氨氧化细菌不是唯一的氨氧化微生物[27]。催化氨氧化过程的Amo是由3种不同亚基构成的三聚体膜结合蛋白,只能催化非离子氨(NH3)的氧化,而不能催化NH4+的氧化,这是Amo限速氨氧化过程的主要原因[28];亚硝酸盐氧化需要在亚硝酸盐氧化还原酶的催化作用下进行,Nxr由Nxr A、Nxr B和Nxr C三个不同亚基构成,可催化亚硝酸盐的氧化及硝酸盐的还原,可诱导细菌完成不同的代谢途径,具有多样功能[29]。随着对脱氮过程的深入研究,近年来全程氨氧化微生物(一种可同时进行氨氧化和亚硝酸盐氧化的微生物)[30]的发现打破了硝化阶段分两步反应的结论,且细菌和硝化古菌均可以进行硝化过程。
目前报道的ENPs对硝化过程的影响,主要集中于硝化细菌介导的硝化途径,而对于硝化古菌、全程氨氧化微生物的影响未见报道,其毒害作用主要概括为两方面:一是通过铵盐或羟胺的去除效率来反映ENPs对硝化过程的抑制,且抑制程度与颗粒浓度、种类、大小及时间有关,通常来说,纳米颗粒比表面积越大、浓度越高、暴露时间越长、对硝化作用抑制程度越高;第二方面是通过影响硝化菌来反映ENPs对硝化过程的毒害。参与硝化过程的氨氧化细菌(ammonia-oxidizing bacteria,AOB)较敏感,与亚硝化细菌(NOB)相比,更易受到ENPs的抑制,致使丰度下降,且ENPs的存在会使类核仁解体并聚集在细胞膜附近进而破坏细胞膜、细胞壁,甚至造成细胞畸形[31];从酶活性检测可知,ENPs能抑制Amo、Hao、Nxr酶活;在基因表达方面,也会抑制与硝化相关的基因例如AmoA1、AmoC2表达;再者,通过抑制硝化细菌蛋白质的功能进而影响菌体内物质合成、能量产生、电子传递等[32-33]。综上,ENPs就是通过抑制铵盐或羟胺去除、破坏硝化细菌、降低硝化相关基因表达来抑制硝化过程的。虽然研究表明了ENPs会对硝化细菌酶活、基因表达、蛋白质功能有一定的抑制作用,但是具体的抑制途径及机理并未明确,未来还有待研究。
3.2 纳米颗粒对微生物反硝化过程的毒害作用
反硝化过程作为氮循环的重要组成部分,对硝酸盐从陆地和水生环境返回大气具有重要意义,其主要过程包括硝酸盐(NO3-)还原为亚硝酸盐(NO2-),再通过亚硝酸盐还原为一氧化氮(NO)、一氧化二氮(N2O)、二氧化氮(NO2)气体和氮气(N2),参与此过程的重要酶包括硝酸还原酶(Nar)、亚硝酸盐还原酶(Nir)、一氧化氮还原酶(Nor)和一氧化二氮还原酶(Nos),这些酶分别由基因NarA及NarG、NirS及NirK、NorB及NorC、Nos编码[34]。
目前对于ENPs在反硝化过程中的毒害机制具体分析已有大量的研究报道,与硝化过程抑制作用类似,根据去除率的降低以及反硝化细菌的损伤来反映ENPs对反硝化过程的毒害程度。首先,由于ENPs的大小、种类、比表面积等本身的性质会延迟硝酸盐还原过程以及增加亚硝酸盐的积累量,导致硝酸盐或亚硝酸盐的去除率降低[35],ENPs通过与反硝化细菌接触产生活性氧、释放游离金属离子,破坏膜蛋白使乳酸脱氢酶渗漏并进一步阻碍电子传递呼吸链、电子转移和物质转运,关键电子转移蛋白包括NADH脱氢酶的活性和细胞色素的表达都会受到抑制,从而改变反硝化细菌的生长和代谢[36-37];除此之外,在ENPs的作用下,与反硝化作用直接相关的重要基因如NarI、NarP、NapD表达均下调,参与葡萄糖降解的葡萄糖激酶和醛缩酶的酶活、硝酸还原酶(Nar)和亚硝酸还原酶(Nir)的活性均下降[38-39]。由此可知,与之相关的抑制机理除了纳米颗粒本身的性质外,还与反硝化细菌接触有关,通过这些方式来破坏反硝化细菌进而抑制反硝化途径(表1)。
综上,ENPs对硝化和反硝化过程的毒害作用主要概括为:(1)抑制脱氮菌的酶活性,包括硝化过程的Amo、Hao和Nxr及反硝化过程的Nar、Nir、Nor和Nos酶活性,抑制酶活使脱氮效率降低;(2)破坏硝化或反硝化细菌的细胞壁、细胞膜及膜蛋白,阻碍生物脱氮过程;(3)抑制基因表达,包括硝化过程的AmoA1、AmoC2基因及反硝化过程的NarI、NarP和NapD基因等,进而延缓或抑制脱氮作用;(4)抑制硝化或反硝化细菌蛋白质的功能进而影响菌体内物质合成、能量产生和电子传递。通过以上几方面来抑制脱氮过程。故探明ENPs对脱氮过程造成的风险,更有利于采取合适措施减小其毒害作用。

表 1 工程纳米颗粒对脱氮过程的毒害作用Table 1 Toxic effects of engineered nanoparticles on the nitrogen-removing process
3.3 工程纳米颗粒对脱氮微生物的毒性机制及影响
充分了解ENPs在废水处理系统及脱氮微生物的毒害机制对减缓ENPs在脱氮微生物的毒害作用和提高废水处理效率十分重要。目前ENPs在微生物毒害机制方面已有大量研究,主要概括为两方面:(1)根据ENPs自身的性质(如尺寸、形状和表面电荷等)产生的毒害;(2)通过纳米颗粒与微生物的相互作用而产生毒害。造成的影响主要包括细菌群落的丰度及结构被破坏;单个细菌细胞内及细胞外的物质被破坏。
据报道,粒径越小的纳米颗粒,比表面积越大,其表面的原子、分子和活性基团的数量越多,更易聚集并增强反应活性,导致更多的金属离子释放,所以对生物脱氮菌的毒性越强[41-42]。此外,纳米颗粒的表面特征如表面电荷是导致纳米毒性的另一个因素,因为带电荷的粒子能通过静电作用与硝化菌接触,降低硝化菌膜电位及还原酶活性,进而抑制脱氮过程[43]。
除了自身性质,ENPs毒害作用还可通过与细菌接触产生,如图2所示,主要体现在:(1)ENPs附着到细胞表面。金属纳米能吸附到EPS上,当ENPs聚集在EPS中时,会减少EPS的含量并破坏其结构,可降低微生物群落的丰度和破坏群落结构[45]。此外,部分ENPs还会附着到细胞膜上,而细胞膜是控制物质自由进入胞内的结构,其上含有多种酶,对促进细胞代谢或维持稳态都起着非常重要的作用,且膜上也含有一些基团,如磷酸根、羟基、含硫基团,这些是可以供ENPs结合的位点[46]。故细胞膜常为ENPs及其释放的金属离子攻击的部位,通过吸附在膜表面上,破坏一些基团或蛋白进而影响膜的完整性,如ZnONPs能够阻断大肠杆菌膜中的磷酸二酯键进而破坏膜结构[47],还会与呼吸链上的蛋白结合,进而干扰细菌呼吸过程,使细菌脱氮能力减弱[48-49]。此外,一些具有还原性的纳米颗粒如Fe0NPs,可还原分解细胞膜的一些脂多糖和蛋白质官能团,从而降低微生物的活性。带有负电荷的AgNPs可与细胞膜结合,使细菌表面产生小孔,纳米粒子进入胞内与胞内物质反应,导致细胞稳态紊乱,破坏细胞结构,不利于进行各项功能的表达;(2)在ENPs的刺激下,细菌会产生活性氧,高浓度的活性氧会破坏胞内物质、中断电子传递、降低反硝化酶活性,使代谢失衡、部分蛋白功能丧失等,最终导致细胞溶解和死亡,进而抑制脱氮过程,降低氮污染物的去除率[50-51]。(3)ENPs金属离子的释放。纳米颗粒暴露时间长会使大部分纳米粒子团聚体溶解,释放出大量金属离子,进而产生毒害作用,如氧化锌纳米粒子的毒性主要源于从纳米粒子上解离下来的锌离子,这些离子可与细胞内功能基团或与酶代谢位点的金属离子结合,破坏蛋白质结构和功能,使细胞失活[52]。此外,不同微生物对金属离子的敏感度具有差异性,如在AgNPs的亚致死浓度下,与反硝化菌及固氮菌相关的基因表达没有很显著的差异,但调控硝化细菌硝化过程的基因表达量明显下降[53]。综上,通过ENPs的毒害作用,对脱氮微生物造成的危害概括如表2所示,且不同的脱氮菌对同种ENPs和同一种类细菌对不同种ENPs的敏感性不同,故探明ENPs的毒害作用及对脱氮微生物的影响有利于提高废水脱氮效率。
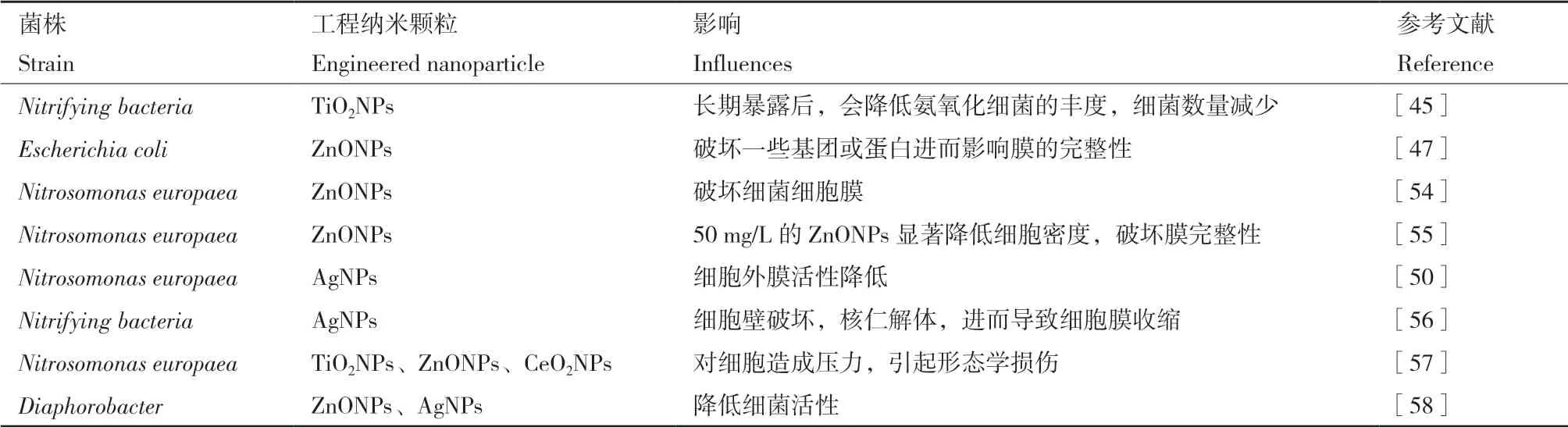
表 2 工程纳米颗粒对脱氮菌的影响Table 2 Influence of engineered nanoparticles on denitrification bacteria

图2 纳米颗粒毒害途径Fig. 2 Poisoning pathway of nanoparticles[44]
4 工程纳米颗粒胁迫条件下脱氮微生物的解毒机制及措施
4.1 解毒机制
近年来由于ENPs对水处理系统及脱氮微生物毒害的广泛报道,有关降低ENPs毒性的探索研究也逐渐受到重视,据报道,细菌的氧化应激机制是应对ENPs胁迫条件下产生毒害的主要机制,了解细菌对ENPs的解毒机制可对采取减缓ENPs对微生物的毒害作用的具体措施提供理论依据。
目前的研究中,细菌的主要解毒机制包括:(1)基因表达的上调。Wu等[55]的研究中,在ZnONPS的刺激下,编码亚硝酸盐和硫酸盐腺苷酰转移酶的基因cysN和yvg等表达上调,来应对及减缓ENPs的毒害;(2)细菌可通过上调蛋白表达及糖代谢来减缓毒害作用,如Ma等[17]利用蛋白质组分析了好氧反硝化菌株HNR对ZnONPs的适应机制发现,蛋白PhoQ、PhoP和PmrA的上调能间接诱导AMT上调,增加脂多糖脂质A带正电的L-Ara4N,增强了脂多糖表面的正电荷,正电荷的增加可排斥ZnONPS释放出的Zn2+,也可通过上调淀粉、蔗糖、氨基酸和核苷酸等的代谢过程来增加EPS的产量,而EPS的增加可使细菌避免直接接触ZnONPs,从而降低其毒害作用。此外,还可通过环磷酸腺苷(cyclic adenosine monophosphate,cAMP)抗性途径的上调来抑制ZnONPs释放Zn2+,进一步降低其对细胞的毒害;(3)相关酶活的上调。在谷胱甘肽代谢途径中,谷胱甘肽过氧化物酶(glycerophosphate oxidase,GPO)及主要参与解毒和氧化还原生化的谷胱甘肽S转移酶(glutathione S-transferase,GST)均上调,这有助于减缓ENPs的毒害作用[59-60]。因此,细菌在ENPs胁迫条件下是可以启动某些应激机制来维持细胞氧化还原稳态,但仅靠细菌自身的调节不足以完全抵制ENPs的毒害,故应从外界条件采取更加有效的措施进行控制。
4.2 具体措施
针对ENPs带来的毒害,目前报道的措施主要有:(1)通过包裹纳米颗粒、添加半胱氨酸来控制ENPs释放金属离子;(2)添加配体、硫酸盐物质形成复合物或者增强细菌的抗逆性,抵制ENPs的毒害。研究表明:(1)可通过各种包裹技术降低AgNPs毒害作用,如Ostermeyer等[14]和Amaout等[41]分别利用蛋白质模型牛血清蛋白(BSA)和柠檬酸盐包裹AgENPs,阻止Ag+的释放,进而降低纳米粒子毒性;(2)半胱氨酸可抑制ENPs金属离子释放,如Guo等[15]在对不同硫化物缓解孢原毛平革菌(Phanerochaete chrysospotium)膜系统中AgNPs的毒性研究时发现,半胱氨酸可通过抑制AgNPs中Ag+的释放来降低金属离子对微生物的毒害作用。然而,这些含硫化合物是否能减轻ENPs对耐冷硝化或反硝化细菌的毒害作用还有待研究。(3)通过添加配体与纳米颗粒反应形成复合物,如Okkyoung等[16]通过添加SO42-、S2-、PO4-和CI-几种不同配体来研究减缓AgNPs对硝化菌的毒害作用时,结果发现硫化物是降低AgNPs毒性的最优的配体,是因为硫化物过量时会形成AgxSy复合物,可稳定存在于厌氧环境中的,进而会降低AgNPs对硝化细菌的毒害作用;(4)硫酸盐能增强细胞活性与微生物的抗逆性,其原因为金属离子与-SH基团有较强的亲和力,两者可形成稳定的化合物从而降低金属离子对微生物的毒害作用。例如,Huang等[61]研究发现当Pb(II)在10 mg/L-200 mg/L时,加入500 μmol/L的NaHS,黄孢原毛平革菌(Phanerochaete chrysosporiumd)的生物活性可提高15%-39%。无机硫化物Na2S能通过提高硫氢基蛋白含量来调节EPS组成成分,从而增强EPS对胞外金属离子的吸附作用,在Na2S为20 mg/L条件下,含有-SH基团的蛋白浓度由104.15 μmol/L增加到154.36 μmol/L,含-SH基团的蛋白浓度可显著提高芽孢杆菌属对重金属的去除效率[62]。综上,通过施加一些物质对抑制ENPs的毒害均有很好的效果。
5 结语
目前关于ENPs在废水活性污泥系统及脱氮微生物毒害方面的报道已经证实了ENPs毒性与其尺寸、浓度、比表面积等自身特性相关,并通过与脱氮菌接触释放金属离子,胁迫细菌产生ROS,进而抑制酶活和基因表达、破坏蛋白质,最终抑制脱氮过程。在已报道的文献基础上,本文系统总结了环境中ENPs的来源以及进入水环境的方式。详细阐述了ENPs对脱氮过程的毒害作用、ENPs毒性机制和对脱氮微生物细胞的影响以及在ENPs胁迫条件下脱氮微生物的解毒机制及措施。然而,以往对废水处理多集中于活性污泥的研究,但活性污泥系统比较复杂且容易吸附和沉淀ENPs,很难准确地评估纳米颗粒对脱氮过程的毒害程度以及毒害机理。此外,已报道的耐冷异养硝化与好氧反硝化菌株比较单一,相关ENPs对纯培养耐冷硝化与反硝化微生物影响的报道也较为缺乏,且未见ENPs对耐冷微生物脱氮过程及分子层面毒害的影响研究。再者,尽管环境中存在的ENPs种类多样,但纳米颗粒种类的研究多集中于ZnO、Ag和CuO等几种常见ENPs对生物脱氮过程的毒害作用。因此,在今后的研究中可从以下几个方面深入探索:
(1)脱氮技术在废水处理中具有高效、低耗、绿色环保且没有二次污染的特点,因此,可更新脱氮菌的分离筛选方法以获得更高效去除无机氮且耐受ENPs的细菌。(2)低温会显著抑制嗜温菌的脱氮效率,耐冷异养硝化与好氧反硝化微生物可提高低温条件下的脱氮效率,目前,关于耐冷菌的报道较少,有待进一步研究和开发,丰富耐冷菌的种类。(3)纳米颗粒对于耐冷脱氮菌的毒害作用及相应的减毒措施在分子层面上的机理有待深入研究。(4)环境中存在的纳米颗粒种类丰富,而对影响生物脱氮过程的纳米颗粒种类研究较为单一,今后可着手于多种类、多浓度、多用途的纳米颗粒探索。(5)对于减缓ENPs对脱氮菌毒害作用的措施,可从分析环境因素着手,探索更高效的解毒措施。