马铃薯bHLH转录因子家族全基因组鉴定与表达分析
冯建英 李立芹 鲁黎明
(四川农业大学农学院,成都 611130)
转录因子(transcription factors,TFs)是植物中一类极其重要的调节因子,在应激调控网络和信号传导通路中起着关键性的作用[1-2]。它们可参与DNA结合和蛋白质二聚化活动,从而在植物不同发育阶段对不同组织中的基因表达进行调控[3]。bHLH转录因子是植物体内存在的第二大类调节蛋白,因具有特定的bHLH结构域而得名[4]。bHLH转录因子既可作为转录激活子又可作为转录抑制子,参与植物生长发育、形态建成及应答环境胁迫等过程,如调节类黄酮与花青素的合成等[5]。研究植物bHLH基因的基本性质、结构及功能,对理解其在植物生长发育及响应胁迫中的作用有重大帮助。
目前,已鉴定的植物bHLH家族成员数量较多,如在拟南芥(Arabidopsis thaliana)中有162个[6],小 麦(Triticum aestivumL.)中有225个[7],白 菜(Brassica rapassp.pekinensis)中有230个[8],苹果(Malus pumilaMill.)中有188个[9],桑树(Morus notabilis)中有173个[10],苦荞(Fagopyrum tataricum)中有164个[11],茄子(Solanum melongenaL.)中有121个[12],银杏(Ginkgo biloba)91个[13],玉米(Zea maysL.)161个[14]。研究表明,拟南芥转录因子bHLH104和bHLH115在其铁稳态中发挥重要作用,bHLH104和bHLH115突变使拟南芥在铁缺乏时耐受性明显降低,而其过表达会强烈促进铁的积累[15-16]。在缺铁条件下存在的NtbHLH1作为转录激活子定位于烟草细胞核,其过表达会导致根系变长,铁螯合物还原酶的活性增强[17]。OsbHLH107可通过影响穗壳纵向细胞数量,进而调节水稻籽粒大 小[18]。FtbHLH2、FtbHLH55及FtbHLH155等 基因在苦荞花中高表达,而FtbHLH67、FtbHLH70及FtbHLH157等基因却在果实中高表达,证实了苦荞bHLH基因的组织表达特异性[11]。121个茄子bHLH转录因子成员中,SmbHLH1与SmbHLH117参与到茄子花青素的生物合成过程中[12]。SlbHLH95表达上调会促进番茄果实的成熟,并且对乙烯的敏感度会升高[19]。与此同时,植物的bHLH成员还参与了胁迫响应。如,西瓜的ClabHLH32、ClabHLH41、ClabHLH71、ClabHLH58以及拟南芥bHLH68、水稻bHLH035均参与了脱落酸(ABA)胁迫应答[20-22];甜橙的bHLH18能够调控抗氧化酶基因的表达,从而增强其抗寒能力[23]。
马铃薯(Solanum tuberosum)属于茄科茄属的一年生草本植物,适应力强且产量大,是世界四大粮食作物之一,具有较高的营养价值与药用价值。目前,国内外关于马铃薯bHLH转录因子方面的报道较少,刘玉汇[24]发现StbHLH1是调控花色素苷重要的协同调控因子,Tai等[25]研究发现bHLH家族在马铃薯中可能具有一定程度抗霜冻的能力。
本研究通过对马铃薯bHLH转录因子进行全基因组鉴定,分析其序列特征、理化性质、组织表达与胁迫响应表达情况,并构建其蛋白互作网络,以期为其功能研究提供理论基础。
1 材料与方法
1.1 材料
供试材料为马铃薯组培苗,品种为川芋10号,由四川农业大学马铃薯研究中心提供。
1.2 方法
1.2.1 马铃薯bHLH家族的鉴定 从Pfam获得bHLIH保守结构域PF00010,并以此为参考序列,利用HMMER3.0软件对马铃薯基因组数据库(http://solanaceae.plantbiology.msu.edu/index.shtml)进行检索获得候选序列。为保证候选序列的可靠性,运用SMART在线软件和NCBI-CDD(https://www.ncbi.nlm.nih.gov/cdd/)对其进行完整保守域检测,去除冗余及不完整序列,保留仅有一个HLH结构域的氨基酸序列。
1.2.2 bHLH蛋白理化性质分析 利用在线软件ExPASy中 的ProtParam(https://web.expasy.org/protparam/),对马铃薯bHLH家族候选蛋白的氨基酸数、分子量等理化性质进行分析[26]。
1.2.3 功能保守域和保守基序分析 利用WebLogo网站,对马铃薯bHLH氨基酸序列进行保守域分析。同时利用MEME在线程序(http://meme-suite.org/tools/meme)对马铃薯bHLH基因序列进行保守基序分析。
1.2.4 同源性分析 从PlantTFDB网站下载拟南芥bHLH家族蛋白在TAIR上的序列号,并获取其氨基酸序列。使用软件MEGA-X的NJ法和iTOL(https://itol.embl.de/itol.cgi)构建系统进化树,bootstrap值设为1 000[27]。
1.2.5 马铃薯bHLH家族成员在染色体上的位置从马铃薯基因组数据库中查找每个StbHLH基因的染色体位置信息,利用在线软件MG2C(http://mg2c.iask.in/mg2c_v2.0/)进行染色体定位作图。
1.2.6 表达模式分析及qRT-PCR验证
1.2.6.1 生物信息学分析 从马铃薯基因组数据库获得StbHLHs基因在根、叶、块茎组织及盐、热、甘露醇与脱落酸胁迫下的FPKM值[28-29],利用软件TBtools绘制出其表达模式图。
1.2.6.2 组织表达模式分析 分别采集马铃薯组培苗的根、茎、叶,液氮速冻后,进行总RNA的提取,并 采 用qRT-PCR方 法,对StbHLH2、StbHLH14、StbHLH15、StbHLH34、StbHLH39、StbHLH53、StbHLH57、StbHLH59、StbHLH66、StbHLH80、StbHLH90、StbHLH108等12个基因在马铃薯根、茎、叶中的表达量进行分析。引物如表1所示。

表1 引物序列Table 1 Primer sequences
总RNA的提取方法以及qPCR的反应程序如下:采用Trizol法提取总RNA,再将其反转录为cDNA,利用荧光定量PCR技术进行基因相对表达量的测定。PCR扩增程序为94℃ 2 min;94℃ 5 s,60℃ 30 s,40个循环。选用马铃薯EF1αL为内参基因(EF1αL-F:5′-CTTGTACACCACGCTAAGGAG-3′;EF1αL-R:5′-GTCAATGCAAACCATTCCTTG-3′)。
1.2.6.3 响应非生物胁迫的表达模式分析 对生长30 d的马铃薯组培苗进行低钾(10 μmol/L)、ABA(1 μmol/L)、干旱(5% PEG-6000)、高盐(200 mmol/L Nacl)以及H2O2(10 mmol/L)处理,在处理后0、3、6和12 h取样。采用qRT-PCR的方法,分析上述12个基因响应非生物胁迫的表达模式。总RNA的提取方法以及qPCR的反应程序见1.2.6.2。
1.2.6.4 总RNA的提取及qPCR反应程序 总RNA的提取方法以及qPCR的反应程序见1.2.6.2。所有样品设置为3次生物学重复,用2-ΔΔCt方法计算相对表达量,运用Excel 2010进行统计学分析。
2 结果
2.1 马铃薯bHLH家族成员的鉴定
利用软件HMMER 3.0对马铃薯蛋白数据库进行检索,并通过NCBI和SMART等网站对保守结构域进一步验证,剔除冗余,最后筛选出108个具有典型bHLH结构域的马铃薯bHLH家族成员。根据各家族成员所在染色体的位置,将其编号为StBHLH1-StbHLH108。
通过分析马铃薯bHLH家族蛋白的基本理化性质(表2)。马铃薯bHLH转录因子蛋白序列所含的氨基酸数目为62(StbHLH62)-694(StbHLH84)。分子量为7 527.78(StbHLH62)-75 939.94 Da(StbHLH84)。理论等电点为4.55(StbHLH46)-10.40(StbHLH62)。

表2 基本理化性质分析Table 2 Analysis of basic physical and chemical properties

续表Continued
2.2 bHLH转录因子的保守基序分析
利用WebLogo在线程序,对马铃薯bHLH家族保守域进行分析(图1)。并通过在线工具MEME对马铃薯bHLH转录因子家族成员进行Motif的预测,得到5个不同Motif保守元件(图2)。其中,Motif1和Motif2为马铃薯bHLH家族成员所共有,并且位置相邻。而Motif5却仅在StbHLH1、StbHLH11、StbHLH12、StbHLH14这4个成员中存在。以上结果表明,HLH结构域不是由一个或几个特定的保守元件构成的。

图1 bHLH保守结构域的logoFig. 1 Logo of bHLH conservative domain

图2 马铃薯bHLH转录因子的保守基序分析Fig. 2 Conserved motif analysis of bHLH transcription factor in S. tuberosum
2.3 马铃薯bHLH家族蛋白的同源性分析
根据鉴定出的马铃薯bHLH家族蛋白序列与随机选取的拟南芥bHLH家族的30条氨基酸序列间的相似度,使用软件MEGA-X构建系统进化发育树。结果(图3)表明,138个bHLH转录因子被划分为16个亚家族,其中,第10亚族的bHLH成员最少,为2个,第16亚族最多,为27个。同一亚族成员具有相似保守基序。表明同一亚家族成员可能具有相类似的功能,在马铃薯生长发育中发挥类似的作用。

图3 马铃薯bHLH家族蛋白系统发育进化树Fig. 3 Phylogenetic tree of bHLH family proteins in S. tuberosum
2.4 马铃薯bHLH基因在染色体上的位置
根据马铃薯基因组数据库提供的StbHLHs的染色体位置信息,绘制其染色体定位模式图(图4)。结果表明,108个StbHLHs在马铃薯12条染色体上呈现不均匀分布。第1染色体分布的StbHLHs数量最多,为15个;第11染色体分布的StbHLHs数量最少,为3个。其中第9和第10染色体上分布的StbHLH家族成员均为7个。以上结果表明,StbHLHs在马铃薯染色体上分布密度是不等的。第1和第2染色体上共有3对基因紧密连锁,分 别 为StbHLH11/StbHLH13、StbHLH12/StbHLH14、StbHLH24/StbHLH26,属于旁系同源基因。
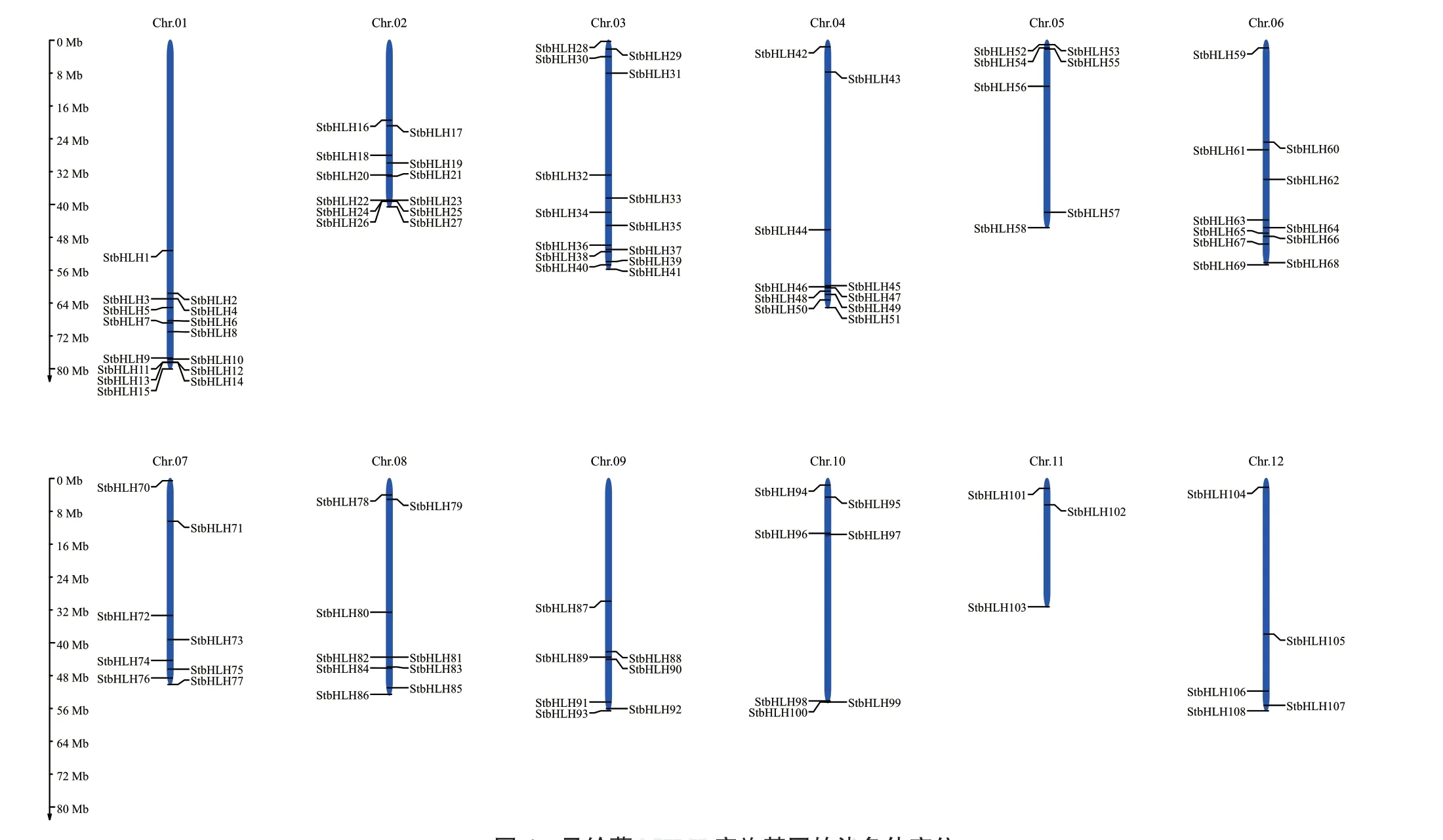
图4 马铃薯bHLH家族基因的染色体定位Fig. 4 Chromosome localization of bHLH family genes in S. tuberosum
2.5 马铃薯bHLH转录因子的表达模式分析
利用数据库信息,分析108个StbHLHs在根、叶、块茎中的表达模式,以及响应盐(150 mmol/L NaCl)、甘露醇、生长素、脱落酸及赤霉素、热(35℃)等非生物胁迫的表达行为,并利用软件TBtools绘制了聚类表达模式图(图5)。
从图5可以看出,StbHLHs在不同组织中的表达具有特异性。StbHLH2、StbHLH5、StbHLH18和StbHLH99等在3个组织中均具有较高的表达丰度,尤其是前两者在叶片和块茎中的表达值均为最高,表明它们可能主要参与马铃薯叶片及块茎发育过程。然而,也有基因在这3个组织中均不表达,如StbHLH1、StbHLH4、StbHLH10等。StbHLH12和StbHLH13仅在马铃薯叶片中有较低的表达量,而StbHLH17和StbHLH76却只在叶片中不表达。StbHLHs的组织表达特异性进一步揭示了马铃薯StbHLHs行使功能时的空间特征。

图5 马铃薯bHLH转录因子的表达模式分析Fig. 5 Expression pattern analysis of bHLH transcription factor in S. tuberosum
马铃薯StbHLHs还响应了非生物胁迫的诱导。在盐(150 mmol/L NaCl)、甘露醇、生长素、赤霉素及脱落酸、热(35℃)等胁迫处理下,这108个StbHLHs的表达模式明显不同。其中,StbHLH84、StbHLH87及StbHLH89等基因,在所有胁迫处理下表达均上调;StbHLH47、StbHLH56及StbHLH80等 基 因 表 达 均 下 调;StbHLH12、StbHLH14及StbHLH55等基因表达无变化。在盐和甘露醇胁迫下,StbHLH83表达程度明显提高,StbHLH20表达量下降,而StbHLH11、StbHLH74和StbHLH82等基因均无明显响应。内源激素诱导条件下,StbHLH46和StbHLH65相较其他成员有较高的表达丰度;StbHLH103唯独在ABA胁迫下表达量明显增加,暗示其可能正调控ABA信号传导途径,从而提高马铃薯抗旱性。热处理时,StbHLH15、StbHLH50及StbHLH73等基因表达均显著下调;StbHLH20、StbHLH48及StbHLH60等基因表达均显著上调,表明这些基因在马铃薯热激反应中具有正向调节的作用。
2.6 马铃薯部分bHLH转录因子的组织表达模式分析
采用qRT-PCR方法分析StbHLH14等12个基因在马铃薯根、茎、叶中的表达情况(图6)。可得StbHLH14、StbHLH34、StbHLH66及StbHLH90均在茎中相对较高的表达量;StbHLH39在叶中的表达量是最高的;而StbHLH59在根中有较高表达量。StbHLH2和StbHLH15在马铃薯根、茎及叶中的表达量均无明显差异。

图6 马铃薯bHLH转录因子组织表达模式分析Fig. 6 Tissue expression pattern analysis of bHLH transcription factor in S. tuberosum
2.7 马铃薯部分bHLH转录因子在非生物胁迫下的表达模式分析
为了对生物信息学分析结果进行验证,分析了StbHLH2等12个基因在低钾、脱落酸(ABA)、干旱、高盐及H2O2处理不同时间的表达量(图7)。StbHLH15和StbHLH53在低钾及ABA处理下,表达量有明显的上调;StbHLH15和StbHLH59在模拟干旱胁迫环境下,表达丰度显著增加,说明其可能参与调控ABA信号通路;StbHLH90在高盐处理3 h后表达量达到了最高;StbHLH108在5个胁迫处理下的表达均明显增加,暗示其可能在马铃薯响应逆境中起着至关重要的作用。StbHLH2在低钾和高盐处理下,表达量均有显著的上调;StbHLH15在高盐处理后发生了下调;StbHLH39在低钾、高盐、H2O2处理后均有显著下调。

图7 马铃薯bHLH转录因子胁迫处理表达模式分析Fig. 7 Expression pattern of bHLH transcription factor in S. tuberosum under stress
3 讨论
bHLH转录因子广泛存在于植物体内,它主要调控植物生长发育,如花的形态建成、表皮毛的发育及种子萌发等,同时在植物养分吸收、生物合成及信号转导过程中具有重要作用[30-31]。本研究鉴定出108个马铃薯bHLH家族成员,保守元件分析后,共获得5个Motifs。其中,Motif1和Motif2相邻,并存在于所有bHLH家族成员中,推测两者共同组成了bHLH保守结构域,该结果与陈红霖等[6]对绿豆全基因组的研究结果相似。聚类分析表明,138个bHLH被分为16个亚家族,而同一亚族的成员大多具有相似的保守元件。进化及染色体定位表明,108个马铃薯bHLH家族成员不均匀地分布在12条染色体上。在1号和2号染色体上共存在3对旁系同源基因,并且紧密连锁,该结果与王寻等[32]研究结果相吻合。
植物的bHLH基因往往具有组织表达特异性。黄芩bHLH3在根中表达值最高,而叶片中基本不表达,bHLH6的表达情况与其恰恰相反[33]。NtbHLH93在烟草盛花期子房组织,及不同生育期侧根中的表达量很高[34]。与上述研究结果相似,马铃薯转录组数据分析结果显示,StbHLH18和StbHLH99等在根、叶及块茎组织中均具有较高的表达丰度,StbHLH13仅在叶片中有低表达。此结果表明,马铃薯bHLH家族成员在其特定发育阶段及特定组织中有独特的表达特点。
植物的bHLH转录因子,也参与了生长发育及胁迫响应过程。番茄bHLH22过表达会促进乙烯生成及激活SlSFT或SlLFY,从而促进果实成熟[35]。在ABA胁迫诱导下,西瓜的ClabHLH32和ClabHLH71随着时间的推移表达量呈先降低后升高的趋势,而ClabHLH41和ClabHLH58先上调后下降[20]。拟南芥bHLH68参与了ABA信号传导及代谢过程,并在干旱胁迫响应时有重要功能[21]。盐胁迫下,水稻bHLH035突变体出现种子萌发延迟的现象,且盐诱导的ABA分解基因在种子萌发过程中表达下调,导致了ABA过度积累[22]。甜橙bHLH18可直接或间接地调控抗氧化酶基因的表达,从而能够增强其抗寒能力[23]。
本研究热图分析中,在盐(150 mmol/L NaCl)、甘露醇、生长素、脱落酸及赤霉素、热(35℃)等非生物胁迫下,马铃薯StbHLHs呈现出不同的表达模式,暗示了其参与植物发育进程及环境胁迫的普遍性。其中,StbHLH84、StbHLH87和StbHLH89均上调表达,则说明了其可能以正向调控的方式,参与马铃薯生长以及响应多种逆境胁迫的调节。StbHLH103在ABA的诱导下,表达量显著上升,说明该基因可能参与了ABA的信号转导途径,并可能在马铃薯的ABA依赖的非生物胁迫(如干旱)响应中发挥重要作用。
qRT-PCR分析结果表明,StbHLH14、StbHLH34在茎中表达量较高,而StbHLH59和StbHLH39分别在根和叶中有高表达,说明了马铃薯bHLH转录因子具有不同的组织表达特异性。StbHLH15和StbHLH53在不同的胁迫处理后会有明显的上调,然而有少数基因在胁迫处理后表达会减少,如StbHLH39等,说明这些基因分别作为不同信号转导途中的正调控及负调控因子。StbHLH108在低钾、脱落酸、高盐、干旱及H202这5个胁迫处理下均发生了上调。综上,马铃薯bHLH家族成员在响应逆境胁迫时均发挥着一定的作用。
4 结论
在马铃薯全基因组中,共鉴定出同属于bHLH基因家族的108个StbHLHs。它们不均匀地分布在马铃薯12条染色体上,均具有典型的HLH结构域,且同一亚族成员的保守基序相似。马铃薯bHLH基因具有组织表达特异性,并且响应盐、热、旱、ABA等非生物胁迫。