拟南芥AtTERT对大肠杆菌非生物胁迫抗性的影响
杨佳慧 孙玉萍 陆雅宁 刘欢 卢存福 陈玉珍
(北京林业大学生物科学与生物技术学院 教育部林木花卉育种与基因工程重点实验室,北京 100083)
端粒酶的生物学功能研究在寄生虫[14]、老鼠[15]、人[16]等领域取得较大进展。植物端粒酶的研究最初是在烟草细胞的提取物中检测到端粒酶活性[17];并首次从拟南芥悬浮细胞中克隆出拟南芥AtTERT的cDNA,端粒酶分子量131 kD,等电点9.9[18];Heller-Uszynska等[19]采用同源序列比对的方法克隆出单子叶植物水稻中的端粒酶逆转录酶基因,为植物端粒酶功能研究奠定了基础。端粒酶的研究在非模式植物中取得较大进展,建立了不同植物材料端粒酶活性检测方法[20-21]。已有研究表明,在大肠杆菌中可成功表达出有活性的逆转录酶,Tanese等[22]构建了莫洛尼鼠白血病病毒的pol核心区域的表达载体,在大肠杆菌中成功表达出具有活性逆转录酶。
目前,人hTERT已在大肠杆菌中实现活性重建[23],但尚未见植物TERT在大肠杆菌中发挥功能的报道。本研究拟在前期研究基础上,将拟南芥AtTERT转入大肠杆菌中,诱导表达可溶性AtTERT蛋白,研究其对大肠杆菌生长及非生物胁迫的影响,为深入研究TERT蛋白非端粒功能奠定基础。
1 材料与方法
1.1 材料
所用植物材料为哥伦比亚(Col-0)拟南芥。菌株为实验室保存的转pET32a-AtTERT原核表达菌株。
IPTG、考马斯亮蓝、GST亲和层析纯化试剂、镍柱亲和层析纯化试剂、Western blotting相关试剂及试剂盒均购自北京拜尔迪生物科技公司。
1.2 方法
1.2.1 原核表达载体构建与遗传转化 引物设计:利用Primer5软件分析AtTERT的CDS序列,结合pET32a和pGEX-4T-1原核表达载体上的多克隆位点信息,确定酶切位点BamH I和NotI。使用软件CE Design(http://www.vazyme.com)设计引物,pGEX-4T-1和pET32a对应的引物分别为GST-F/R和32-F/R(32-F:5′-gccatggctgatatcggatccATGCCGCGTAA ACCTAGACATC-3′、32-R:5′-tggtggtgctcgagtgcggccgc ATAATTCAACTTCCACAGCGAAG-3′;GST-F:5′-gat ctggttccgcgtggatccATGCCGCGTAAACCTAGACATC-3′、GST-R:5′-tcagtcagtcacgatgcggccgcTCAATAATTCAA CTTCCACAGCGA-3′;小写字母代表载体序列引物部分)。
目的基因的PCR扩增:提取保存测序正确的AtTERT克隆菌株质粒,作为PCR扩增模板,以32a-F/GST-F及引物32a-R/GST-R为引物进行PCR扩增,切胶回收目的基因片段。
1.2.1受试者检查方法 对受试者开展常规治疗。例如胃肠道减压、及时抗感染等等。分别使用彩色多普勒超声诊断设备以及多功能直接数字化X线成像系统,对患儿开展检查。受试者取仰卧位,多切面扫查患儿腹部。开展实时监控肠壁回声,全面判定肠壁厚度和肠管外形形状情况对受试者的肠腔、门静脉以及腹腔加以观察,分析是否存在异常现象。例如扩张积液等等[3]。在此之后,对患儿腹部开展横向以及纵向扫描检查,以免发生积气假象现象发生。对探头加压,分析积气来源。全面明确病变位置位于管壁内还是管腔中。使用阳性以及阴性,来表示X线检查和超声诊断结果。阳性代表肠壁内存在积气。阴性代表肠壁积气、肠壁增厚以及门静脉积气等均未出现。
载体构建:提取pET32a和pGEX-4T-1空载体质粒,利用BamH I和NotI进行酶切,然后与目的基因片段重组连接,构建原核表达载体pET32a-AtTERT和pGEX-4T-1-AtTERT,并转化Trans5α感受态细胞进行PCR鉴定。
遗传转化:选取测序结果正确的重组质粒菌液,转化Transetta(DE3)感受态细胞中,获得转化表达菌株。
1.2.2 AtTERT蛋白的诱导表达 融合蛋白诱导表达:将阳性重组菌及空载菌液置于37℃培养箱培养至对数期(OD600=0.6-0.8);加入终浓度为1.0 mmol/L IPTG诱导12 h,以不加IPTG作为对照。
样品制备:收集菌体,使用细胞破碎仪破碎菌体至菌液澄清,并进行SDS-PAGE检测,融合蛋白纯化试验在4℃条件下操作。
Western blotting检测:将经SDS-PAGE电泳分离蛋白样品电转至0.45 μm硝酸纤维素膜上,加入一抗(HIS抗体)、二抗(羊抗鼠的辣根过氧化物酶HRP抗体),洗膜、拍照。
1.2.3 转AtTERT大肠杆菌的非生物胁迫抗性检测 转AtTERT大肠杆菌的生长特性:将对照菌pET32a及转AtTERT重组菌以1∶100的比例接种至新鲜50 mL LB液体培养基(含有终浓度0.5 mmol/L IPTG),诱导至菌液浓度为OD600=0.6,此时记为初始浓度,继续震荡培养,在2、4、6、8、10和12 h时测量OD600值,做好记录,并做成曲线。
对照菌pET32a及转AtTERT重组菌活化后,加入终浓度为0.5 mmol/L IPTG,20℃、100 r/min过夜诱导培养;将2种菌稀释至相同浓度(OD600=1.2),进行不同非生物胁迫抗性检测存活率,试验重复3次。
氯化钠、甘露醇抗性检测:经实验室前期预试验,确定氯化钠的处理浓度为400和500 mmol/L,甘露醇的处理浓度为400和600 mmol/L。取6 μL两种菌液分别垂直加到LB固体培养基(含有0.5 mmol/L IPTG和NaCl/甘露醇)上,37℃,倒置培养12 h,按照计数法统计存活率。
低温抗性检测:取1 mL的2种菌液于液氮中反复冻融5-6次,然后取6 μL分别垂直加到LB固体培养基(含有0.5 mmol/L IPTG)上,37℃,倒置培养12 h,统计存活率。
过氧化氢(H2O2)耐受性检测:采用点板计数法,取6 μL计数法准备的2种菌液分别垂直加到LB固体培养基(含有0.4 mmol/L H2O2)上,37℃,倒置培养12 h,统计存活率。
2 结果
2.1 AtTERT的PCR扩增及原核表达载体的构建
提取测序正确的菌株质粒作为模板进行PCR扩增(图1),以带有15-20 bp载体序列的引物进行PCR扩增,获得目的基因片段,片段大小与预期一致,为3 409 bp。
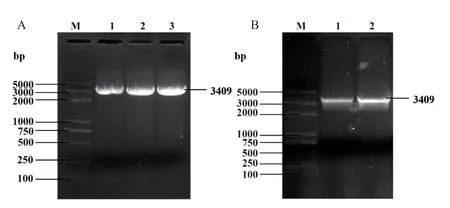
图1 AtTERT的PCR扩增Fig. 1 PCR amplification of AtTERT gene
将测序正确的菌液提取质粒,并用BamH I及NotI酶切鉴定,酶切后片段大小与目的基因片段一致(图2),说明pET32a/ pGEX-4T-1-AtTERT原核表达载体构建成功。

图2 pET32a/ pGEX-4T-1-AtTERT重组质粒的酶切鉴定Fig.2 Double digestion identification of pET32a/ pGEX-4T-1-AtTERT
2.2 AtTERT蛋白的诱导表达及鉴定
2.2.1 诱导表达 GST-AtTERT融合蛋白条件的优化 用Transetta(DE3)感受态细胞对蛋白诱导表达的IPTG浓度(0.3/0.5/1.0 mmol/L)及温度(20/30℃)进行了优化(图3),在温度为20℃时特异性蛋白的表达量明显高于30℃时。在诱导温度为30℃,IPTG浓度为0.5 和1.0 mmol/L时,特异性蛋白条带在上清及沉淀中均有表达,但主要存在于沉淀中;而在温度为20℃,IPTG浓度为0.3、0.5和1.0 mmol/L时,特异性蛋白条带在上清及沉淀中均有表达,但主要存在于上清中,而且在IPTG浓度为0.5 mmol/L时,上清中蛋白表达量相对较高。因此,优化后的蛋白诱导条件为诱导温度20℃,诱导剂(IPTG)浓度0.5 mmol/L。
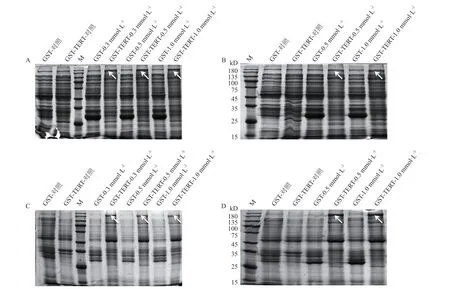
图3 GST-TERT蛋白的SDS-PAGE检测Fig. 3 Detection of GST-TERT protein by SDS-PAGE
2.2.2 GST-AtTERT融合蛋白的纯化及鉴定 为验证SDS-PAGE中的特异性蛋白条带是否为带有GST标签的目的蛋白,利用融合蛋白中的GST标签对全菌液、上清、沉淀及纯化后组分进行了Western blotting验证,结果(图4)显示,在诱导全菌、上清及沉淀中均出现与预期蛋白相对分子量大小相符的条带,为156 kD,与SDS-PADG分析结果一致。

图4 Western blotting鉴定GST-AtTERT融合蛋白Fig. 4 Western blotting identification of GST-AtTERT fusion protein
2.3 转AtTERT大肠杆菌对非生物胁迫的响应
2.3.1AtTERT抑制大肠杆菌的生长 为研究AtTERT对大肠杆菌生长特性的影响,测定空载对照菌(pET32a)和转AtTERT重组菌在同等条件下的生长状况,结果(图5)显示,两种菌株均呈现“S”型生长趋势,在生长4-10 h时,空载对照菌的生长速度总是显著高于转AtTERT重组菌;在生长10-12 h时,空载对照菌生长速度趋于平缓,而转基因重组菌生长仍然相对较快,两者菌浓度差距变小但空载对照菌的菌浓度仍然显著高于转基因重组菌,说明AtTERT抑制了大肠杆菌的生长。
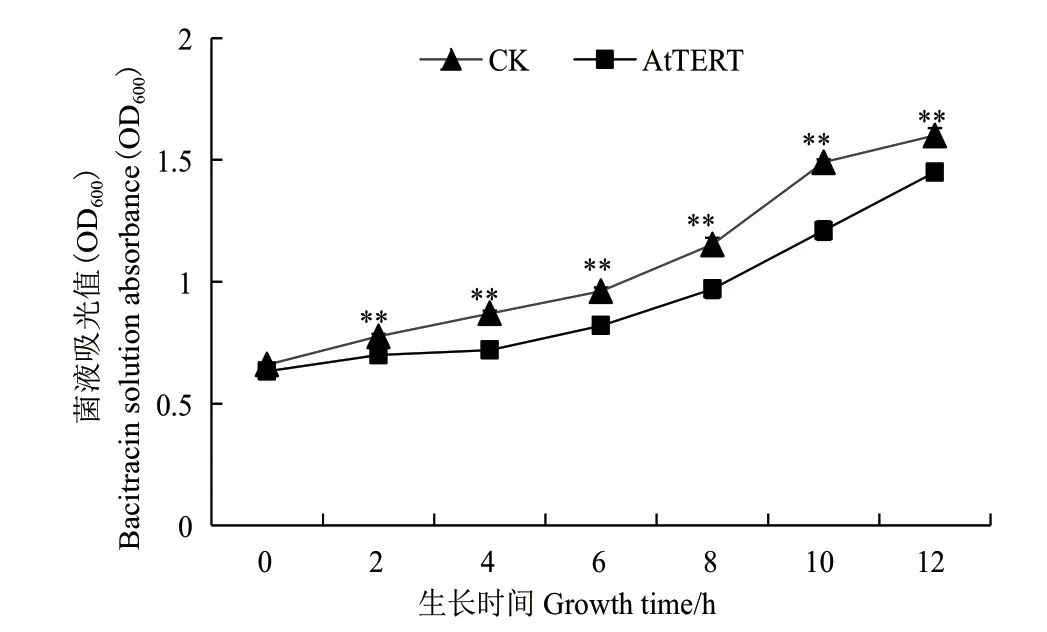
图5 AtTERT对大肠杆菌生长特性的影响Fig.5 Effect of AtTERT on the growth characteristics of E.coli
2.3.2 转AtTERT大肠杆菌的盐胁迫抗性增强 为研究转AtTERT大肠杆菌对盐胁迫抗性的影响,采用点板法对转AtTERT重组菌和空载体对照菌进行了NaCl抗性检测,结果表明,对照菌和重组菌在空白LB基本固体培养基(0 mmol/L NaCl)上生长良好且无显著差异;但采用400和500 mmol/L NaCl处理时,转AtTERT重组菌存活率显著高于空载对照菌(图6),说明转AtTERT大肠杆菌的盐胁迫抗性增强。
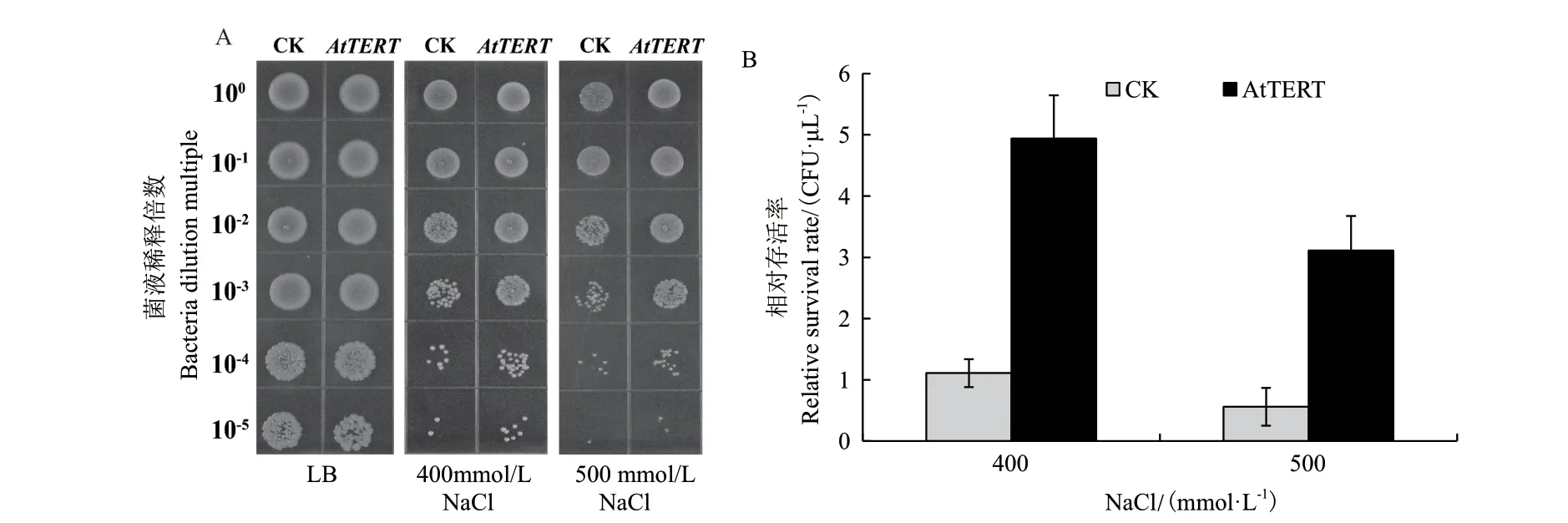
图6 盐胁迫下AtTERT对大肠杆菌存活率的影响Fig.6 Effect of AtTERT on the survival rate of E. coli under salt stress
2.3.3 转AtTERT大肠杆菌甘露醇胁迫抗性增强 采用点板法对转AtTERT重组菌和空载体对照菌进行了甘露醇胁迫处理,发现对照菌和重组菌在空白LB基本固体培养基上生长良好且无显著差异;但经400和600 mmol/L甘露醇处理时,转AtTERT重组菌存活率明显高于空载对照菌(图7),故转AtTERT大肠杆菌甘露醇胁迫抗性增强。

图7 甘露醇胁迫下AtTERT对大肠杆菌存活率的影响Fig.7 Effect of AtTERT on the survival rate of E. coli under mannitol stress
2.3.4 转AtTERT大肠杆菌低温抗性减弱 为研究转AtTERT对大肠杆菌低温胁迫抗性的影响,采用点板法对转AtTERT重组菌和空载体对照菌进行了液氮反复冻融处理,结果(图8)表明,对照菌和重组菌在LB基本固体培养基上生长良好且无显著差异;经过液氮反复冻融5次时,两者的存活率没有显著差异,但是液氮反复冻融6次时,转AtTERT重组菌存活率显著低于空载对照菌,说明转AtTERT大肠杆菌低温抗性减弱。
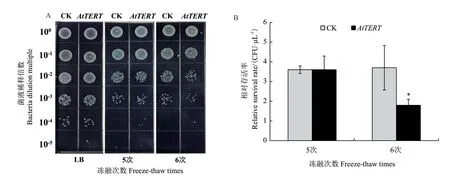
图8 低温胁迫下AtTERT对大肠杆菌存活率的影响Fig.8 Effect of AtTERT on the survival rate of E. coli under cold stress
2.3.5 转AtTERT大肠杆菌H2O2耐受性增强 为研究转AtTERT对大肠杆菌H2O2耐受性影响,采用点板技术法及在菌液中直接添加H2O2测定菌液OD600值2种方法(图9)。点板法结果显示,对照菌和重组菌在空白LB固体培养基上生长良好且无显著差异;但是在含有H2O2的LB固体培养基上生长状况显著高于空载对照菌(图9-B)。
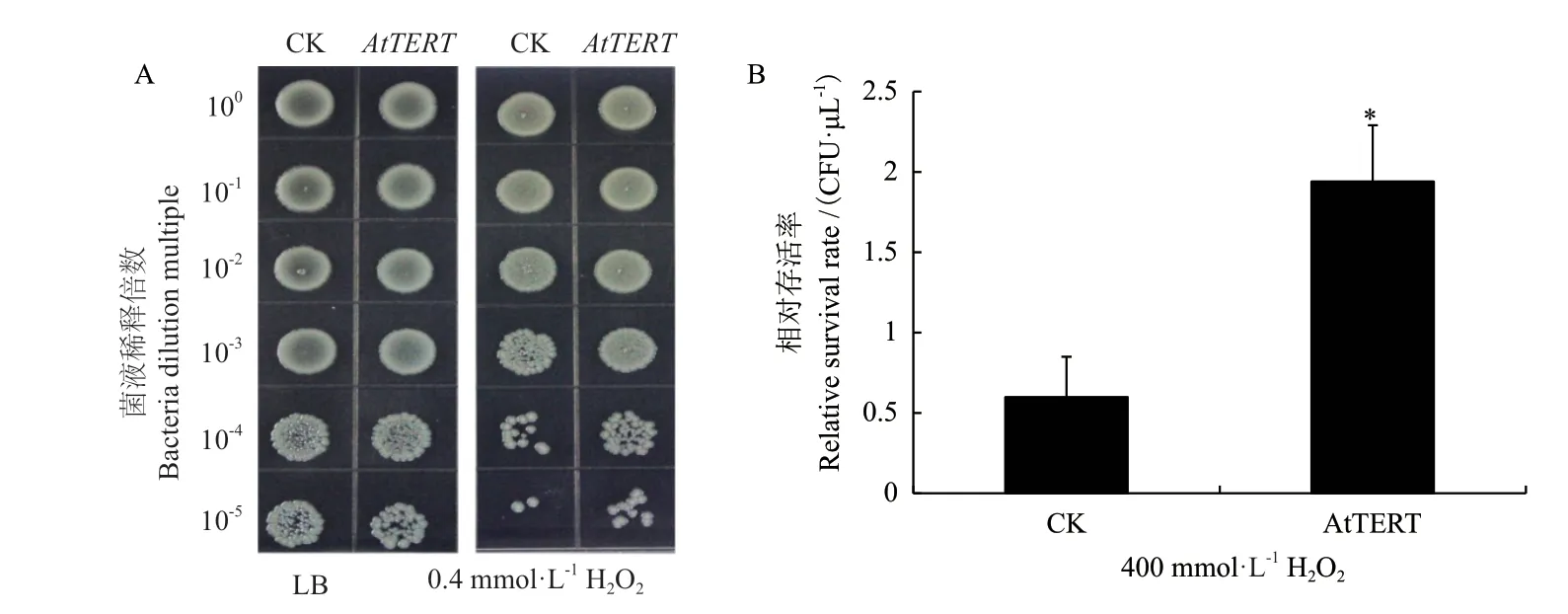
图9 H2O2胁迫下AtTERT对大肠杆菌存活率的影响Fig. 9 Effect of AtTERT on the survival rate of E. coli under hydrogen peroxide stress
3 讨论
端粒酶是基本的核蛋白逆转录酶,在真核细胞中负责端粒延长,把DNA复制损失的端粒填补起来,使端粒不会因细胞分裂而有所损耗,端粒酶在保持端粒稳定、基因组完整、细胞长期的活性和潜在的继续增殖能力等方面具有重要作用[3-5]。已有研究表明,端粒酶除具有端粒DNA的合成作用外,还具有非端粒功能[7],生命活动的多种应激反应与TERT介导相关,如调节与细胞增殖和分化有关的基因表达[24],改善DNA损伤修复[25-26],增加细胞凋亡抗性[27]或减少凋亡信号传导[28]等。在研究模式植物拟南芥AtTERT功能时发现,由AtTERT生物学功能网络结构可推测,AtTERT和多种蛋白相互作用,这些蛋白中部分参与维持端粒长度,具有保护端粒末端结构的作用,值得关注的是SMG7可能在植物防御中发挥作用,这表明拟南芥AtTERT如同动物等TERT,除具有合成端粒末端结构生物学功能外,还可行使其非端粒的生物学功能[29-32]。
Fojtová等[33]研究重金属镉胁迫与DNA修复时发现,大部分DNA链断裂在脱镉48 h内得到修复,端粒酶活性在恢复期增加了2.5倍,表明端粒酶可能与DNA修复有关,认为植物可能已经建立了一套高效的DNA修复系统来应对短暂的环境胁迫。吴晓飞等[34]以胡杨(Populus euphratica)和合作杨(P.simonii×P. pyramibalis)悬浮细胞为材料,0和20 mmol/L H2O2处理提高胡杨细胞端粒酶活性,而合作杨端粒酶对H2O2不敏感,研究认为抗盐性强胡杨细胞的端粒酶对抵御其细胞内氧化损伤具有一定作用。张徐俞等[32]发现,采用500 mmol/L高浓度盐胁迫时,初期端粒酶活性迅速增加,但随后端粒酶活性下降;当高盐处理后移除 NaCl 胁迫,端粒酶活性可增加1.4倍,且DNA稳定性提高;同时孙丽春等[35]采用荧光定量PCR检测到,高盐、干旱、高热及低温胁迫均能导致沙冬青幼苗根和叶中AmTERT的表达量升高,表明植物细胞端粒酶可能和动物细胞一样具有应激保护功能。王杨等[36]发现,采用浓度100 mmol/L NaCl处理模式植物拟南芥幼苗3 d时,其端粒酶活性升高,盐处理时间延长端粒酶活性下降;同时AtTERT表达量也呈现先升高后降低的规律性变化,这些抗性结果说明,虽然不同物种对不同胁迫处理抗性程度表现不同,但在一定胁迫范围内,植物抗性应激反应与其端粒酶活性及TERT的表达量密切相关。
端粒酶的生物发生是一个高度调控的过程,解决了DNA的末端复制问题,但这些研究均是在真核生物背景下完成。Hansen等[23]为了揭示TERT的结构和功能,进行了人类端粒酶在原核生物中的表达研究,在表达序列优化的hTERT基因大肠杆菌细胞提取物中,检测到端粒酶重复扩增(TRAP)阳性活性,尤其是终点TRAP显示的表达水平是HeLa癌细胞的3倍,这些结果首次报道了来自细菌的TRAP活性,并为独立于真核环境的组装因子和抗癌治疗的研究提供了一个简便的系统。而植物TERT在大肠杆菌中的表达还未见报道,本研究将拟南芥AtTERT成功转入大肠杆菌中,构建了pET32a-AtTERT原核表达载体,并优化了AtTERT蛋白诱导条件,获得了纯化GST-AtTERT融合蛋白(156 kD);同时检测了转AtTERT大肠杆菌的非生物胁迫抗性:转AtTERT重组菌在NaCl(400 和500 mmol/L)、甘露醇(400和600 mmol/L)和H2O2(0.4 mmol/L)的LB固体培养基上的存活率显著高于空载对照菌LB固体培养基上的存活率,结果表明,转AtTERT大肠杆菌NaCl盐胁迫、甘露醇渗透胁迫、H2O2氧化胁迫抗性增强,表明拟南芥AtTERT具有提高大肠杆菌的盐渗透胁迫抗性及氧化应激能力。Ahmed等[29]在细胞中过表达hTERT时发现,线粒体膜电位增加,线粒体超氧化物产生和细胞过氧化物水平降低及mtDNA受到保护,但TERT在大肠杆菌中如何参与非生物胁迫过程减少ROS的形成、保护DNA完整性、增强细胞凋亡抗性以及调控相关基因表达等还有待于进一步深入研究。
4 结论
优化AtTERT蛋白诱导条件,获得156 kD纯化GST-AtTERT融合蛋白,转AtTERT重组大肠杆菌获得多种非生物胁迫抗性,表明拟南芥AtTERT具有抗非生物胁迫的非端粒功能。