黄毛草莓F-box蛋白基因FnFBOX1及其启动子的克隆和表达分析
时雅倩 申亚茹 陈漫影 何淑敏 刘予涵 何天楠 陈清西 文志丰
(福建农林大学园艺学院,福州350002)
草 莓(Fragaria ananassaDuch.)为 蔷 薇 科(Rosaceae)草莓属(Fragaria),多年生草本植物,其果实为浆果,含有丰富的鞣花酸、花青素、槲皮素,抗坏血酸和叶酸等,有很高的营养价值和保健价值[1]。栽培草莓具备良好的经济价值和经济效益,近年来,我国草莓栽培面积逐年增加,2018年草莓栽培面积达到173 333 hm2,总产量为500万t,均居世界第一位[2]。然而,草莓病害是制约草莓产业发展的重要因素。草莓生产中常见的病害有根腐病、灰霉病、炭疽病、白粉病等,其中,草莓炭疽病的危害较为严重,可在短时间内对草莓产业造成毁灭性的危害。我国是野生草莓资源最为丰富的国家,世界草莓属约24个种,我国自然分布14个种[2-3],野生草莓因具有特殊风味、香气、抗病虫害和较宽的遗传背景等特点而被利用到草莓遗传育种中,挖掘野生草莓的优良性状基因导入到栽培品种中日益受到育种者的重视[4]。
黄毛草莓(F. nilgerrensis)是野生二倍体草莓,原产于我国,广泛分布于云南、贵州、四川等西南地区,其果实具有独特的蜜桃香味,植株健壮,具有抗旱、抗寒和抗炭疽病等特点,其独特果香和较强的抗逆性,使之成为拓宽栽培草莓遗传背景的重要遗传资源[5]。因此,挖掘黄毛草莓抗炭疽病基因,研究其抗炭疽病机理,通过基因工程及育种手段提高栽培草莓对炭疽病的抗性具有重要意义。
F-box蛋白在真核生物中广泛存在,是SCF(Skp/Cullin/F-box)复合体中泛素连接酶E3的关键组分,通过泛素化途径介导参与了许多重要的生命进程,因最初被发现存在于细胞周期蛋白Cyclin F而得名[6-7]。F-box蛋白在植物体多种代谢过程中发挥着重要的调节作用,如参与植物激素信号转导、植物光信号转导、花器官发育、植物自交不亲和以及对植物抗逆中的响应等[8-10]。植物F-box蛋白可以通过介导泛素化降解逆境相关蛋白来调控植物逆境反应[9],其在抵御生物和非生物逆境胁迫中的作用日益得到广泛关注[10]。Kim等[11]研究表明,拟南芥(Arabidopsis thaliana)son1缺失突变体增强了对霜霉菌(Peronospora parasitica)和丁香假单胞菌(Pseudomonas syringaepv. Tabaci)的抗性。Cao等[12]研究发现,在烟草中过表达水稻OsDRF1,可以增强烟草对番茄花叶病毒(ToMV-S1)和丁香假单胞菌(PstDC3000)的抗性。番茄ACIF1可以增强其对黄萎病(Verticillium dahliae)的抗性[13]。Maldonado-Calderón等[14]以菜豆悬浮细胞为材料,分离获得PvFBS1,并发现在菜豆受渗透胁迫、多种激素诱导及接种丁香假单胞菌(PstDC3000)后PvFBS1表达上调。Li等[15]在棉花中分离到一个F-box蛋白基因GhACF1,在拟南芥中过表达此基因可提高其植株的抗病性;相反,沉默此基因可使棉花更易感大丽轮枝菌(Verticillium dahliae)。以上研究表明,F-box蛋白在植物响应生物胁迫中起着十分重要的作用。
迄今为止,F-box蛋白基因响应病原菌侵染及其抗病功能研究主要集中在模式植物拟南芥上,在园艺作物上的研究较少,关于F-box基因参与草莓抗病的相关报道更少。研究显示,草莓F-box基因是两类新miRNA的潜在靶标基因[16]。通过转录组测序从黄毛草莓中筛选到一个受胶孢炭疽菌(C.gloeosporioides)诱导表达上调的F-box蛋白基因,推测其在黄毛草莓响应病原菌胁迫中发挥了重要功能。
本研究采用同源克隆法克隆F-box蛋白基因的cDNA(命名为FnFBOX1)和启动子序列(命名为pFnFBOX1),分析其序列结构特征,构建FnFBOX1启动子融合GUS载体,并在烟草中验证启动子活性。通过实时荧光定量PCR技术分析抗病黄毛草莓和感病‘妙香 3’草莓在受胶孢炭疽菌胁迫和外施SA下FBOX1的表达水平,为黄毛草莓FnFBOX1抗炭疽病功能研究奠定基础。
1 材料与方法
1.1 材料
所用材料:黄毛草莓(F. nilgerrensis)和‘妙香 3’草莓,栽植于福建农林大学园艺学院果树抗病与遗传育种实验室人工气候室,培养条件为:(20±1)℃,湿度80%,光周期16 h光照/8 h黑暗,光照强度为120 μmol/(m2·s)。草莓胶孢炭疽菌(C. gloeosporioides)菌株(FZ-1)由福建农林大学园艺学院果树抗病与遗传育种实验室分离、鉴定和保存[17]。本氏烟草(Nicotiana benthamiana)种子消毒后,播种于MS固体培养基(Murashige and Skoog Media)中,待种子萌发后,转移至培养瓶中,获得无菌烟草植株。
主要试剂:植物总RNA提取试剂盒、DNA纯化回收试剂盒、质粒提取试剂盒、植物基因组DNA提取试剂盒均购自天根生化科技(北京)有限公司。PCRTaqmix购自弗森斯(北京)科技有限公司。DNA marker购自北京全式金生物科技有限公司。大肠杆菌(Escherichia coli)感受态DH5α细胞、pMDTM20-T、各种限制性内切酶、LATaq、反转录试剂盒、荧光定量试剂盒均购自TaKaRa宝生物(大连)有限公司。其他常用试剂为国产分析纯。用Primer Premier 5.0软件设计引物,并委托福州尚亚生物技术有限公司(福州)合成。pC0380∷GUS、pCaMV35S∷GUS和SA母液均为福建农林大学园艺学院果树抗病与遗传育种实验室保存。
1.2 方法
1.2.1 黄毛草莓接种胶孢炭疽菌和外源SA处理 胶孢炭疽菌处理:选取生长健壮,长势一致的黄毛草莓盆栽植株在人工气候箱进行试验处理。将胶孢炭疽菌的菌饼在PDA液体培养基进行培养后,收集菌液,制成1×106个/mL的孢子悬浮液体,4℃保存备用,喷施前加入0.2% Tween-20。采用喷雾法接种草莓叶片,对照组喷施无菌水。接种后,将植株置于25℃、14 h光照/10 h黑暗、80%湿度条件下培养,每组处理6株盆栽草莓,设3次重复试验。采集接种0、6、12、24、48和72 h后的草莓叶片,液氮速冻,-80℃保存备用。
外源SA处理:将SA(浓度100 μmol /L)均匀地喷施在生长健壮、长势一致的黄毛草莓盆栽植株上(喷施叶片正反面,以叶片湿润不滴水为宜),以喷施无菌水为对照,每组SA处理6株盆栽草莓,设3次重复试验。采集处理0、3、6、12、24和48 h后的草莓叶片,液氮速冻,-80℃保存备用。
1.2.2 黄毛草莓FnFBOX1的克隆 参照植物总RNA提取试剂盒说明书提取黄毛草莓总RNA,使用NanoDropTM2000分光光度计(Thermo Fisher公司,美国)检测RNA的质量和纯度,并用1%琼脂糖凝胶电泳检测RNA的完整性。按照PrimeScriptTMII 1st Strand cDNA Synthesis Kit反转录试剂盒说明书逆转录合成cDNA第一链。使用Primer Premier 5.0设计PCR扩增引物(表1)。PCR扩增体系为LAtaq0.25μL、10× LA PCR Buffer II(Mg2+plus)2.5 μL、dNTP Mixture 4 μL、模板cDNA 2 μL、引物各1 μL,ddH2O补至25 μL。反应程序为94℃ 30 s;94℃ 30 s,58℃ 1 min,72℃ 2 min,32个循环;72℃ 10 min,4℃保存。PCR产物经1%琼脂糖凝胶电泳后,使用胶回收试剂盒(天根)纯化目的条带,并连接至pMDTM20-T克隆载体,转化大肠杆菌DH5α感受态细胞,随机挑选5个阳性克隆菌株送至福州尚亚生物技术有限公司(福州)进行测序。

表1 PCR引物信息Table 1 Information for PCR primers
1.2.3 生物信息学分析 利用ORF Finder(http://www.ncbi.nlm.nih.gov/orffinder)预测FnFBOX1编码的氨基酸序列。将预测的FnFBOX1氨基酸序列使用NCBI protein BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行氨基酸相似性比较。使用DNAMAN 7.0进行相似性比较并构建系统发育进化树。利用在线 网 站ProtParam(https://web.expasy.org/protparam/)计算FnFBOX1编码蛋白的分子量及等电点。利用SOPMA(http://pbil.ibcp.fr/)在线工具对该蛋白的二级结构进行预测。利用PlantCARE在线软件(http://bioinformatics.psb.ugent.be/web-tools/plantcare/html/)预测启动子的顺式作用元件。
1.2.4 黄毛草莓FnFBOX1的亚细胞定位 使用含有Hind III和X-bal的特异性引物FnFBOX1-YFP-F和FnFBOX1-YFP-R(表1)扩增FnFBOX1的ORF区域,并将产物克隆到pYFPc载体中。对所构建的融合载体通过测序进行确认。采用农杆菌介导法将融合表达载体转化到洋葱表皮细胞,培养48 h后,通过激光扫描共聚焦显微镜(OLYMPUS IX83-FV3000)观察洋葱表皮中YFP荧光反应。
1.2.5 黄毛草莓FnFBOX1启动子的克隆 根据森林草莓基因组FvBOX1设计启动子扩增引物(P-FnFBOX1-F和P-FnFBOX1-R),以黄毛草莓叶片基因组DNA为模板进行扩增,PCR扩增条件、体系及后续克隆步骤参照1.2.2。利用PlantCARE对启动子序列进行生物信息学分析。根据启动子测序结果,设计带有BamH I和Hind III酶切位点引物(P-FnFBOX1-GUS-F和P-FnFBOX1-GUS-R)。以测序正确并含有启动子片段的质粒为模板,进行PCR扩增,将扩增的启动子片段克隆到pMDTM20-T克隆载体,连接转化大肠杆菌DH5α感受态细胞,提取质粒。使用BamH I和Hind III进行双酶切后,回收片段,并与已用BamH I和Hind III双酶切的GUS融合载体pC0380∷GUS进行连接,转化大肠杆菌DH5α感受态细胞,使用菌液PCR检测阳性克隆,并用BamH I和Hind III双酶切验证阳性克隆后,随机挑选5个阳性克隆菌株送至福州尚亚生物技术有限公司(福州)合成进行测序。将测序正确的菌株采用冻融法转化农杆菌GV3101感受态细胞。
1.2.6 GUS活性组织化学染色分析与GUS活性测定 配制含有目的质粒的农杆菌重悬液,通过抽真空法使农杆菌侵染到烟草叶片中。取上述叶片放入新鲜配制的X-Gluc染色液中,37℃保温过夜。待充分染色后,用75%(体积比)乙醇脱色2-3次,直到叶片绿色全部褪去,记录拍照[18]。试验重复3次,每次使用10片烟草叶片。
将pFnFBOX1∷GUS和pCaMV35S∷GUS农杆菌重悬液通过叶片背面注射转入烟草叶片中,25℃培养箱中暗培养2 d,均取0.1 g瞬时转化的烟草叶片于1.5 mL离心管中。用浓度为1×106个/mL的炭疽菌孢子悬浮液采用喷雾法接种已转入pFnFBOX1∷GUS质粒的烟草叶片,在接种12 h时取0.1 g瞬时转化的烟草叶片于1.5 mL离心管中;用浓度为100 μmol /L的SA溶液通过叶片喷施的方法处理已转入pFnFBOX1∷GUS质粒的烟草叶片,在处理24 h时取0.1 g瞬时转化的烟草叶片于1.5 mL离心管中,均在液氮中磨碎,采用磷酸缓冲液法提取总蛋白,用考马斯亮蓝法测定样品蛋白质含量;用分光光度法检测各样品中GUS酶活力,并计算GUS酶活值[19]。
1.2.7 黄毛草莓FnFBOX1的实时荧光定量分析 根据克隆测序结果,设计特异性引物(FnFBOX1-F1和FnFBOX1-R1),以草莓Actin(GenBank登录号:AB116565)为内参,按照RR820A SYBRPremix-ExTaqTMII试剂盒(大连,TaKaRa公司)说明书进行实时荧光定量PCR。反应体系为10 μL SYBR Green I、上游引物0.5 μL、下游引物 0.5 μL、cDNA模板1 μL,dd H2O补至20 μL。反应程序为95℃3 min;94℃ 30 s,60℃ 30 s,42个循环。设置3个生物学重复和3次技术重复,采用2-△△CT方法[20]计算FnFBOX1的相对表达量,并用SPSS 18.0软件进行显著性分析(P<0.05)。
2 结果
2.1 黄毛草莓FnFBOX1的克隆与生物信息学分析
以接种病原菌黄毛草莓总RNA反转录成的cDNA为模板,克隆到1条约1 200 bp的条带(图1),经测序,该序列长度为1 227 bp(GenBank登录号:MN709780),编码408个氨基酸,其氨基酸序列的N端36-73个氨基酸处包含一段由38个氨基酸构成的F-box结构域(图1),属于F-box类型基因。利用在线软件ExPASy中的ProtParam程序预测FnFBOX1蛋白的理化性质,结果表明,FnFBOX1蛋白的分子式为C2079H3167N549O602S22,相对分子质量为46 189.65 kD,理论等电点为6.11;氨基酸组分中含有较高的亮氨酸(10.80%)和丝氨酸(10.50%)。带负电荷氨基酸残基总数(Asp+Glu)为41,正电荷氨基酸残基总数(Arg+Lys)为35,说明该蛋白带正电荷。亲水性平均值为-0.155,为亲水性蛋白。不稳定系数为60.73,属于不稳定性蛋白。
这时候,他们的头顶上已经传来鲲鼓翼的声音。他们抬头去看,宇晴师父坐在鹏背上,向他们俯冲过来,李离、上官星雨、袁安三人双足往山路上一点,衣袂飘飘,身形如箭,向鲲鹏的翅背间跳丸飞弹般射来。正是宇晴指点他们练成的“点墨山河”击水兮万里,纵翼兮排云,轻功之俊赏,与当日宇晴在黄梁驿见到时,已经是天差地别,宇晴不由得心里一暖。
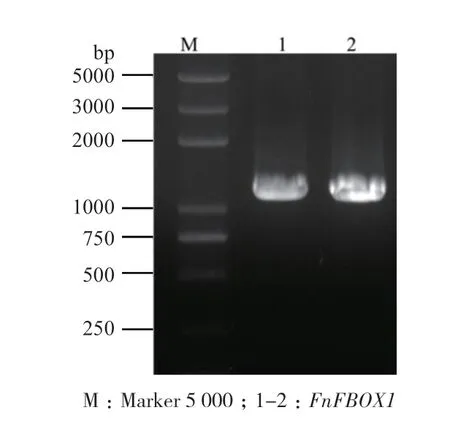
图1 黄毛草莓FnFBOX1的PCR扩增图Fig. 1 Electropherogram of PCR product for FnFBOX1 gene in F. nilgerrensis
利用SOPAM在线软件预测FnFBOX1蛋白二级结构,主要由无规卷曲(random coil,46.93%)、延 伸 链(extended strand,32.9%)、α螺 旋(alpha helix,15.48%)和少量的β转角(beta turn,4.67%)组成(图2-A),并预测该蛋白存在信号肽序列(图2-B)。
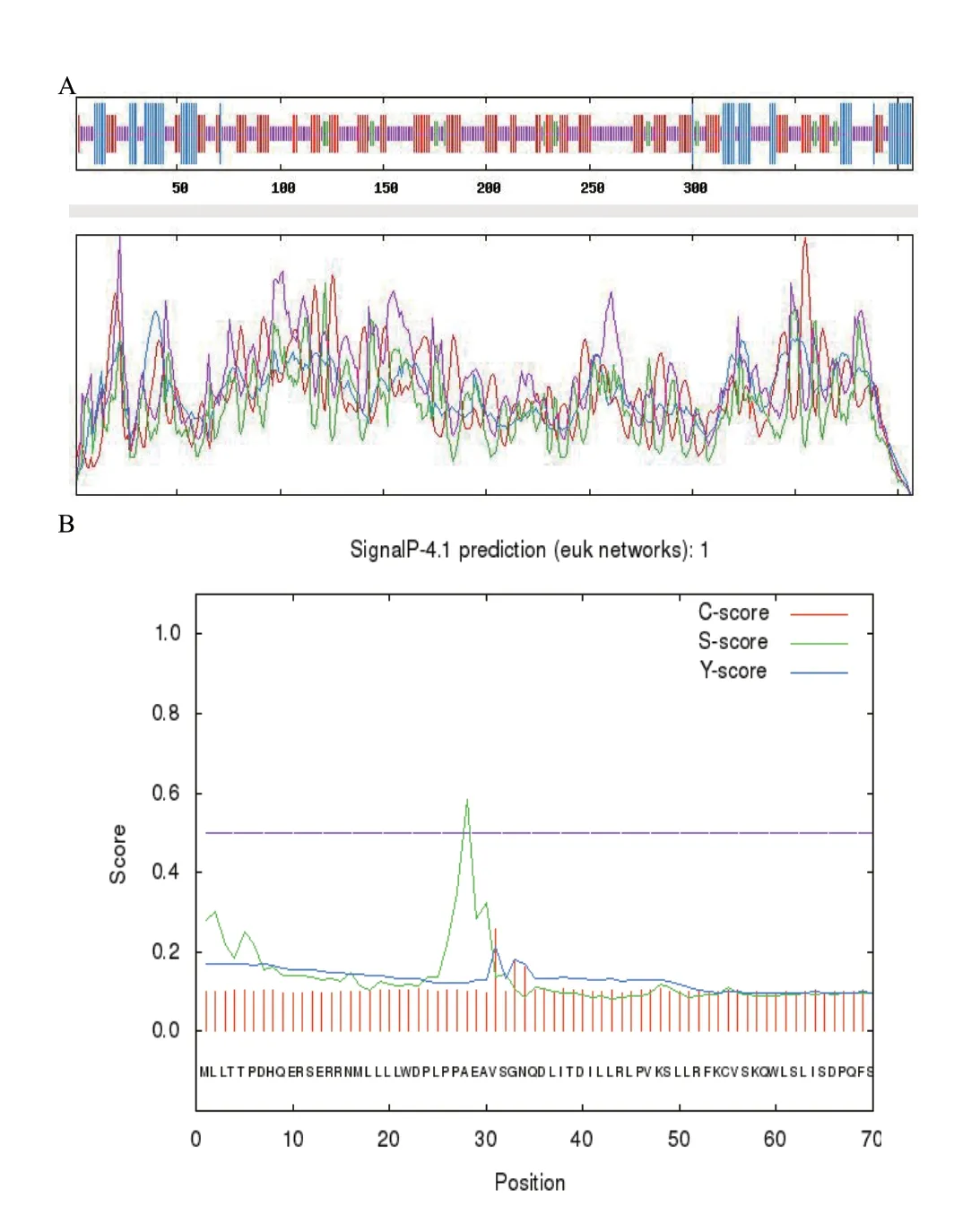
图2 黄毛草莓FnFBOX1的二级结构预测(A)与信号肽预测(B)Fig. 2 Prediction of secondary structure of FnFBOX1 protein in F. nilgerrensis(A)and signal peptide prediction(B)
2.2 黄毛草莓FnFBOX1氨基酸序列比对和系统进化树分析
利用BLAST在NCBI数据库中查找并下载FnFBOX1氨基酸同源序列,在DNAMAN 7.0软件上进行氨基酸同源性比对,结果显示,黄毛草莓FnFBOX1与 森 林 草 莓FvFBOX1(Fragaria vesca,XP_024192373)同源性最高,为95.59%(图3),与月季(Rosa chinensis,XP_021825170)、樱桃(Prunusavium,XP_008223808)、苹果(Malus domestica,XP_008351366)、核桃(Juglans regia,XP_018807-608)、巨桉(Eucalyptus grandis,XP_010050919)、甜橙(Camellia sinensis,XP_028054565)、可可(Theobroma cacao,EOY22796)、木 薯(Manihot esculenta,XP_021634763)的氨基酸序列同源性分别为87.70%、67.16%、66.84%、55.44%、53.44%、50.87%、50.00%和42.00%,这些序列在F-box结构域中有较高的相似性。进一步利用DNAMAN 7.0软件的邻位相连技术法对黄毛草莓和其他9种植物的FBOX1蛋白进行聚类分析,结果(图4)显示,黄毛草莓FnFBOX1氨基酸序列与森林草莓(XP_024192373)聚为一类,表明它们的亲缘关系最近;与月季花(XP_021825170)、苹果(XP_008351366)和樱桃(XP_008223808)亲缘关系次之,它们同属于蔷薇科;与木薯、巨桉等亲缘关系较远。由此可见,黄毛草莓FnFBOX1与其他植物一样,在进化上较保守。

图3 黄毛草莓FnFBOX1与其他植物氨基酸序列的比对和保守结构域分析Fig. 3 Alignment of FnFBOX1 in F. nilgerrensis with other plant amino acid sequences and analysis of conserved domains
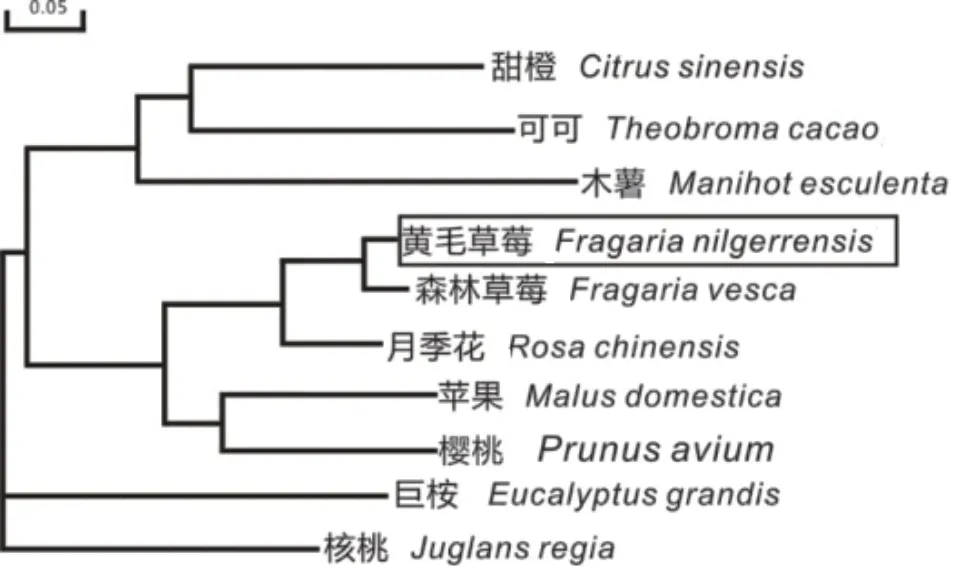
图4 黄毛草莓FnFBOX1和其他植物FBOX1序列构建的系统进化树Fig. 4 Phylogenetic tree of FnFBOX1 in F. nilgerrensis with FBOX1 of other plant species
2.3 亚细胞定位
构建的亚细胞定位载体通过冻融法转化农杆菌GV3101,获得阳性菌株,扩大培养后将其制成悬浮液,以空载作为对照,在洋葱进行瞬时表达。48 h后,将洋葱表皮制成玻片,并在激光共聚焦扫描显微镜下观察。如图5所示,阳性对照35∷YFP在整个细胞中均能观察到绿色荧光;目的基因融合表达载体只在细胞核中观察到绿色荧光,故推测其定位于细胞核中。

图5 FnFBOX1在洋葱表皮中亚细胞定位Fig. 5 Subcellular localization of FnFBOX1 in onion epidermis
2.4 黄毛草莓FnFBOX1启动子的克隆和生物信息学分析
以黄毛草莓基因组DNA为模板,利用引物P-FnFBOX1-F和P-FnFBOX1-R进行PCR扩增,得到1条长约为800 bp片段(图6)。经测序,片段长度为821 bp,命名为pFnFBOX1(GenBank登录号:MN709783)。利用PlantCARE预测启动子的顺式作用元件,结果显示,pFnFBOX1启动子序列含有多个TATA-box(核心启动子元件),CAAT-box(启动子和增强子区的作用元件);含有多个光响应元件,如GATA-motif、G-Box、I-box和TCT-motif等顺式作用元件;脱落酸响应元件ABRE、含有茉莉酸甲酯响应元件CGTCA-motif和TGACG-motif元件、赤霉素响应元件TATC-box、伤害诱导和防御元件WUNmotif和MYC、TC-rich repeats逆境胁迫响应元件等(图7)。说明黄毛草莓启动子pFnFBOX1能响应多种信号诱导(如光、激素、逆境胁迫等),可能在响应逆境胁迫中起重要作用。
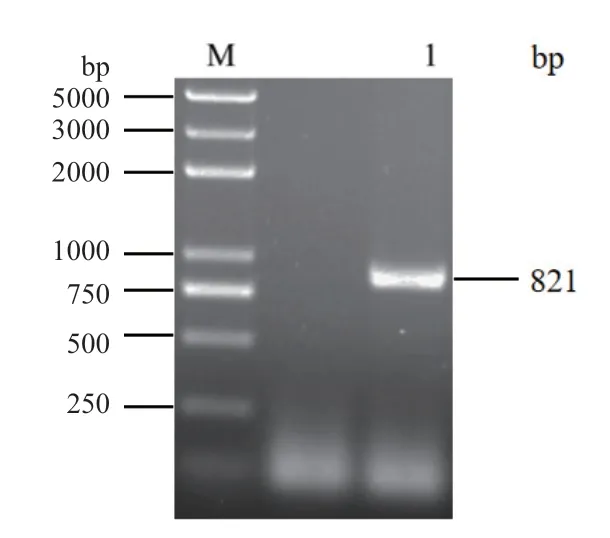
图6 黄毛草莓FnFBOX1启动子的PCR扩增Fig. 6 PCR product of pFnFBOX1 in F. nilgerrensis

图7 黄毛草莓FnFBOX1上游启动子pFnFBOX1序列及预测的顺式作用元件Fig. 7 Sequence and cis-elements in the promoter of FnFBOX1 gene in F. nilgerrensis
2.5 黄毛草莓pFnFBOX1启动子GUS融合载体的构建
以含有pFnFBOX1启动子序列的质粒为模板,利用启动子融合GUS引物进行PCR扩增,回收目的片段,连接pMDTM20-T并转化大肠杆菌DH5α感受态细胞,菌液PCR检测阳性克隆,并用BamH I和Hind III进行双酶切后,与已用BamH I和Hind III双酶切的pC0380∷GUS线性载体连接后,转化大肠杆菌DH5α感受态细胞,菌液PCR检测阳性克隆,并用BamH I和Hind III双酶切验证阳性克隆(图8-C)。并对阳性克隆菌株进行测序,结果显示与预期构建序列一致,成功构建启动子融合GUS表达载体pFnFBOX1∷GUS。
2.6 GUS蛋白染色及活性检测
采用农杆菌介导真空渗透法将pFnFBOX1∷GUS融合载体转入到烟草叶片中,同时转化pCaMV35S∷GUS和pC0380∷GUS载体分别作为阳性对照和阴性对照,暗培养2 d后,进行GUS染色,结果显示,转pCaMV35S∷GUS阳性对照烟草叶片具有很深的蓝色(图9-A),转pC0380∷GUS阴性对照烟草叶片没有蓝色(图9-B),转pFnFBOX1∷GUS烟草叶片有蓝色,但没有阳性对照叶片颜色深(图9-C),试验证明pFnFBOX1具有驱动下游基因转录的活性。采用叶片背面注射法将pFnFBOX1∷GUS融合载体转入到烟草叶片中,同时转化pCaMV35S∷GUS载体作为阳性对照,暗培养2 d后,进行GUS活性测定。结果显示,接种胶孢炭疽菌和喷施SA处理后,pFnFBOX1∷GUS烟草叶片的GUS活性与未处理前相比明显增强,但没有阳性对照的GUS活性强(图9-D)。结果表明,胶孢炭疽菌和SA可促进FnFBOX1启动子启动的GUS活性的提高。
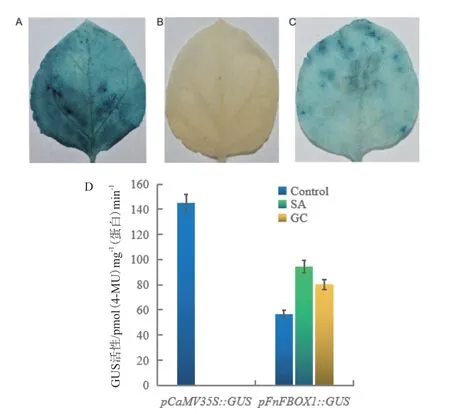
图9 黄毛草莓启动子pFnFBOX1∷GUS载体转化烟草后染色图及GUS酶活测定Fig. 9 Staining and GUS activity after pFnFBOX1∷GUS vector transformed into tobacco
2.7 黄毛草莓中FnFBOX1组织表达模式及病原菌、SA胁迫诱导表达
通过对接种胶孢炭疽菌黄毛草莓叶片中FnFBOX1的qRT-PCR检测,结果显示,在接种0-72 h后呈先升高后降低,再升高后降低的变化趋势,在0-12 h接种后,表达显著上调,接种12 h表达量最高,达到了接种0 h的6.3倍,此后表达量有所下降,而对照(接种无菌水)表达变化差异不显著(图10-A)。以上结果表明,FnFBOX1响应胶孢炭疽菌胁迫,其表达先上调后下降是黄毛草莓对病原菌的一种防御反应,对黄毛草莓协助防御病原菌侵染,提高抗性水平可能起一定的调控作用。外施SA后,通过qRT-PCR检测黄毛草莓叶片FnFBOX1的表达情况,结果显示,在接种6、12、24和48 h后,FnFBOX1表达呈现出先升高后降低,再升高再降低的表达模式,在SA处理24 h后达到最高,为0 h的7.9倍;处理24-48 h时,FnFBOX1表达有所降低,但仍显著高于对照(图10-B)。推测FnFBOX1可能通过SA信号分子途径参与到黄毛草莓抗炭疽病反应。FnFBOX1在黄毛草莓根、匍匐茎、叶片和叶柄中均有表达,在匍匐茎中表达量最高,其次是根、叶片,在叶柄中最低(图10-C)
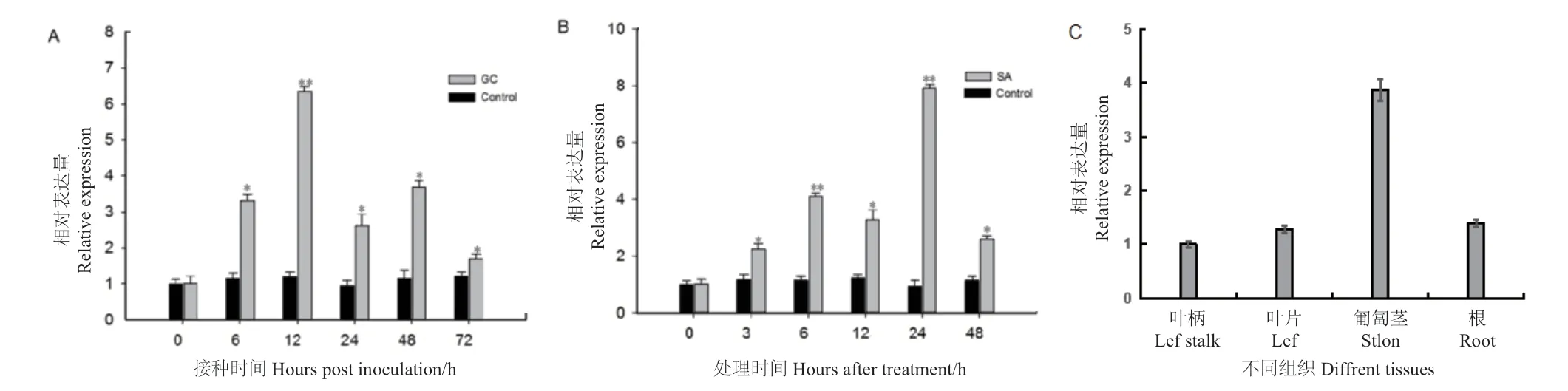
图10 不同处理及黄毛草莓不同组织中FnFBOX1的表达Fig. 10 Expressions of FnFBOX1 after different treatments and in different tissues of F. nilgerrensis
2.8 草莓‘妙香3’接种病原菌和外源SA处理后FBOX1的表达分析

图11 ‘妙香3’叶片接种胶孢炭疽菌和SA处理后黄毛草莓FBOX1的表达Fig. 11 Expressions of FBOX1 in F. nilgerrensis after inoculation with C. gloeosporioides and SA treatment in ‘Miaoxiang 3’leaves
3 讨论
F-box蛋白在植物的生长和发育如叶片衰老[21]、信号转导[22]、生物和非生物逆境胁迫[23-25]及免疫[26]等生命活动中扮演着至关重要的角色。有研究表明,在欧洲葡萄‘红地球’中过表达野生华东葡萄‘白河-35-1’的F-box蛋白基因VpUIFP1增强了对白粉菌(Erysiphe necatorSchw.)的抗性[24]。番茄F-box蛋白基因SlACRE189在识别烟草花叶病毒(Tobacco mosaic virus)过程中可调控细胞死亡和激活防御反应[27]。水稻F-box蛋白基因OsDRF1在烟草中过表达增强了对番茄花叶病毒(Tomato mosaic virus)和PstDC3000的抗性,在烟草OsDRF1过表达植株中,外源SA处理可诱导防御相关基因的表达[12]。棉花F-box蛋白基因GhACIF1在拟南芥中过表达增强了对大丽轮枝孢菌的抗性,而在棉花中沉默GhACIF1增加了对大丽轮枝孢菌易感性[15]。上述研究表明,植物F-box蛋白基因在植物应对生物胁迫和免疫过程中发挥着重要作用。课题组前期从接种胶孢炭疽菌的黄毛草莓中筛选到诱导表达上调的FnFBOX1,推测其在黄毛草莓抗炭疽病中发挥着重要作用。本研究进一步克隆了FnFBOX1的cDNA序列,序列分析显示:黄毛草莓FnFBOX1编码的氨基酸与森林草莓和月季的同源性都在87%以上,进化树分析显示,其与森林草莓和月季聚在同一个小亚类,这3种植物均属于蔷薇科,说明FnFBOX1在进化过程中具有一定的保守性,因此,推测其蛋白质功能也相似。
F-BOX蛋白基因在植物抗病和免疫过程中扮演着非常重要的角色,很多研究表明,F-BOX蛋白基因在病原菌诱导后,呈现上调表达趋势。野生华东葡萄‘白河-35-1’的F-box蛋白基因VpUIFP1被白粉菌侵染后,VpUIFP1在接种病原菌12 h后表达达到最高峰,为对照的5.5倍[24]。小麦F-BOX蛋白基因TaFKOR23在受叶锈菌(Puccinia triticina)侵染后呈现先降低后升高的表达模式[28]。棉花F-box蛋白基因GhACIF1在接种大丽轮枝孢菌后诱导表达上调,24 h表达量达到最高,为对照的18.0倍[15]。F-box蛋白常通过形成SCF复合体介导泛素化降解生物胁迫相关蛋白的机制调控植物逆境反应,在病原菌胁迫下,F-box 蛋白上调表达,诱导降解抗病反应负调节蛋白表达,解除抗病反应的抑制,启动抗病反应[29]。本研究中通过实时荧光定量PCR检测在黄毛草莓和八倍体‘妙香3’草莓中FBOX1在接种胶孢炭疽菌后的表达水平,FBOX1在2个物种中均在接种6 h后表达上调,接种12 h后表达量达到最高,分别为对照的6.3和5.7倍,推测接种病原菌12 h后,FBOX1上调表达,降解了抗病反应负调节蛋白的表达,解除抗病反应的抑制,启动抗炭疽病反应。植物抗病信号分析SA广泛参与活体病原菌和半活体病原菌的抗病反应[30-31],能提高许多病原菌响应基因的表达。外源SA处理谷子(Foxtail millet)幼苗24 h后,F-box蛋白基因SiF-box18的表达量到达了对照的10倍[32],外源SA处理小麦后,F-box蛋白基因TaSKP2在处理24 h后,表达量达到了对照的1.8倍[33]。有研究表明,很多激素受体蛋白都是F-box蛋白,这些蛋白受激素的调节,进一步通过降解目标底物去调控生物进程[29]。本研究表明,在黄毛草莓和八倍体‘妙香3’草莓中,外源激素SA能诱导黄毛草莓FBOX1的表达,推测FBOX1受SA的调节,进一步通过降解FBOX1目标底物参与调控黄毛草莓抗炭疽病反应。
本研究通过亚细胞定位推测FnFBOX1蛋白定位在细胞核,这与谷子中SiF-box18蛋白和胡杨中F-box蛋白定位在细胞核上一致[32,34]。研究发现烟草NtVQ35能够同时被SA和青枯病菌高度诱导表达,对该基因的启动子区域分析,发现其启动子区域含有3个胁迫和防御响应相关的富含TC的重复序列[35]。中国野生葡萄VpTNL1启动子和缺失分析表明富含TC的重复序列可能在其对接种葡萄叶斑病菌的反应中起重要作用[36]。本研究克隆了黄毛草莓FnFBOX1上游821 bp启动子序列pFnFBOX1,序列分析显示,其含有TC-rich repeats顺式作用元件,推测该作用元件对FnFBOX1在响应激素信号分子和逆境胁迫中发挥着重要作用,并通过组织化学染色分析和GUS活性测定证明了黄毛草莓pFnFBOX1具有驱动下游基因转录的活性,且接种胶孢炭疽菌和SA处理后可促进FnFBOX1启动子启动的GUS活性的提高。为进一步探究黄毛草莓FnFBOX1受不同环境因素诱导表达和参与调控抗炭疽病提供了一定的参考。
虽然本研究发现,黄毛草莓FnFBOX1可能在参与抗炭疽病过程中发挥一定的作用,但其参与抗病的具体生物学过程和抗病信号转导途径还未明确,后期拟通过遗传转化等生物技术手段进一步探讨FnFBOX1抗炭疽病生物学功能。
4 结论
从黄毛草莓中克隆到FnFBOX1,全长1 227 bp,编码408个氨基酸,与森林草莓FvFBOX1同源性最高。胶孢炭疽菌和SA可促进黄毛草莓和草莓中FnFBOX1的表达,但FnFBOX1在‘妙香3’的表达量比在黄毛草莓的表达量低。