拟南芥RPP1A参与幼苗生长的蛋白质组学分析
李兵娟 郑璐 沈仁芳 兰平
(1. 中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室,南京 210008;2. 中国科学院大学,北京 100049)
核糖体是生命细胞合成蛋白质的场所。真核细胞中的核糖体主要存在于细胞质中。细胞质核糖体由一个60S大亚基和一个40S小亚基共同构成,包含79-81种核糖体蛋白(ribosomal proteins,RPs)和4种核糖体RNA(ribosomal RNAs,rRNAs)[1-2]。植物RPs由多拷贝基因编码,同一种RP可能存在2个或2个以上同家族基因编码。拟南芥(Arabidopsis thaliana)中81种RPs由254个基因编码,大部分RPs有3个或4个编码基因,同一家族的RPs的氨基酸相似度高达65%-100%[3-5]。拟南芥中RPs同一家族不同成员在不同生长发育时期、不同组织和不同亚细胞中具有表达差异[6]。各种环境刺激下,大部分RPs的转录水平保持稳定,但也有部分RPs在表达水平发生了显著的变化[7]。说明RPs不仅参与蛋白质的合成,而且具有调控功能。解析植物RPs所具有的蛋白质合成以外的功能对于揭示植物生长发育以及胁迫响应的调控机制具有重要意义。
拟南芥RPs基因缺失突变体会表现出异常的生长发育表型,包括叶片形态和种子发育等[8-10]。研究表明,拟南芥rpl7b和rps6a突变体的叶片与野生型相比更小、更窄,叶片轴面和极性异常[8]。拟南芥RPL27aC突变影响地上部发育,叶片形态、花序和花分生组织功能以及种子结实异常[11]。rpl18aB突变体花粉在花柱中生长的竞争力明显减弱,胚胎在早期显示出不规则的细胞分裂方向,并在球形期停滞[12]。拟南芥RPL10A不仅在萌发和早期发育中发挥作用,而且还是依赖脱落酸响应的正调节剂[13-14]。这些突变体的表型及其作用机制研究表明RPs在生长发育和胁迫响应中发挥调控作用。
不同RPs基因突变产生的表型各不相同,这可能是不同核糖体基因存在时空表达差异或者一些RPs同时具有核糖体以外的功能所导致。与动物RPs不同,植物中RPs存在庞大的同家族蛋白,且高度异质性,大大增加了功能研究的难度[3]。目前,只有少数拟南芥RPs所具有的核糖体以外的功能被报道,大部分RPs的调控功能还不清楚。为深入解析RPs的调控功能,有必要对RPs基因突变体的表型及其可能的作用机制进行解析。
核糖体磷酸蛋白P1(ribosomal phosphoprotein P1,RPP1)是酸性磷酸蛋白,该家族有3个同源基因,RPP1A、RPP1B和RPP1C[3]。前期研究表明,拟南芥根系RPP1A和RPP1C的表达量在缺铁胁迫下显著下降[7]。然而关于RPP1家族蛋白核糖体以外的功能还不清楚。随着高分辨率质谱技术的发展,蛋白质组学在植物各个领域广泛应用,可以全面快速地分析不同样品间的蛋白质水平的差异,揭示可能的生物学机制[15]。
本研究利用rpp1a突变体解析其对植株生长的影响,进一步利用蛋白质组学阐述RPP1A缺乏对幼苗蛋白质表达水平的影响,揭示其参与调控幼苗生长的作用机制。
1 材料与方法
1.1 材料
拟南芥(Arabidopsis thaliana)T-DNA插入纯合 突 变 体,rpp1a-1(SAIL_210_H01)和rpp1a-2(SALK_206736C),种子购自TAIR库(https://www.arabidopsis.org/)。rpp1a-1突变体的T-DNA插入位于启动子区域;rpp1a-2的插入位点在蛋白质编码区。突变体经纯合鉴定后用于试验。拟南芥生态型(Columia-0)作为野生型(WT),由本实验室保存。
首先用75%乙醇将拟南芥种子表面消毒3 min,再置于0.5%(V/V)次氯酸钠溶液(含0.5%的吐温20)中震荡洗涤10 min,最后用灭菌蒸馏水洗涤5遍。种子点播到Estelle和Somerville(ES)固体培养基上[16],密封后置于4℃低温避光春化2 d,在光照箱中继续培养14 d后取样。光照箱温度为22℃恒温,光照强度为60 μmol/(m2·s),光照16 h,黑暗8 h。
1.2 方法
1.2.1 植株的表型观测 在同一固体ES培养基上,划分区域均匀点播野生型WT和rpp1a-1和rpp1a-2突变体的种子,每种材料设置5个重复,培养14 d后测定鲜重、叶片总表面积和叶柄长度。随机选取>15株拟南芥植株作为一个生物学重复,用万分之一的天平称量鲜重。拍照记录叶片表型,用Image J软件对叶片总表面积和叶柄长度进行数据分析。试验至少重复3次。
1.2.2 蛋白质的提取和定量分析 选取光照培养14d的野生型WT和rpp1a-2突变体的幼苗样品,提取总蛋白,具体方法参照Lan等[17]方法。总蛋白粉末冰上溶解于SDT溶液[2%(W/V)SDS、0.1 mol/L二硫苏糖醇、0.1 mol/L Tris-HCl和1 mmol/L苯甲基磺酰氟,pH7.6],离心(10 000 r/min,5 min)取上清液备用。使用酶标仪(Cytation5 imaging reader,BioTek)按照色氨酸荧光法测定蛋白质浓度,激发光波长为295 nm,荧光波长为350 nm。
1.2.3 蛋白质酶解和肽段脱盐 蛋白质酶解采用基于超滤辅助样品制备(filter-aided sample preparation,FASP)方法[18]。蛋白质溶液(50 μg蛋白质)置于超滤管(10 K)中用尿素替换后进行还原烷基化,最后用100 μL的NH4HCO3溶液(50 mmol/L)重悬。按照1:50的质量比加入胰蛋白酶溶液(Promega),加入1 μL的100 mmol/L CaCl2溶液轻轻涡旋后,37℃反应过夜。次日,12 000 r/min离心20 min,再用50 μL的NH4HCO3溶液洗脱2次,最后加入10%的三氟乙酸(trifluoroacetic acid,TFA)至终浓度为0.4%终止酶解反应。
使用多肽脱盐柱对酶解产物进行脱盐[19]。脱盐柱活化洗涤后,酶解产物用缓冲液(64%乙腈和0.2%TFA)稀释至200 μL加入到脱盐柱中脱盐,1 000 r/min离心30 s,滤液再重新加到脱盐柱离心收集滤液,重复1次,合并收集的肽段滤液,浓缩干燥,-80℃保存备用。
1.2.4 nano-LC-ESI-MS/MS检测和非标记(labelfree)定量分析 使用纳升液相色谱-电喷雾-串联 质 谱(nano liquid chromatography-electrospray ionization-tandem mass spectrometry,nano LC-ESIMS/MS)系统对肽段进行质谱分析,具体方法参照Yan等[19]方法。肽段样品复溶于20 μL的0.1%甲酸中,nano液相色谱系统(DIONEX UltiMate 3000RSLC,Thermo Fisher Scientific)中 采 用C18分 析柱(Acclaim PepMapTM100,100 μm×2 cm,Thermo Fisher Scientific)进行分离。A相为0.1%甲酸的水溶液,B相为0.1%甲酸的乙腈溶液,参照Yan等[19]方法设置B相梯度。肽段经液相分离后进入质谱仪(Orbitrap Fusion Lumos,Thermo Scientific)进行检测。质谱仪采用正离子检测模式,母离子全扫描范围为350-1 700m/z,一级质谱的分辨率为60 000,二级质谱的光谱扫描的分辨率为15 000,每次质谱扫描中选取20个最丰富的母离子进行高能碰撞解离碎裂用于二级质谱分析。质谱分析采用3个生物学重复,每个生物学重复设置2个技术重复。
1.2.5 蛋白质鉴定和差异蛋白的筛选 采用Proteome Discoverer软 件(Thermo Fisher Scientific,2.3)对质谱数据进行查库和定量分析。参考蛋白质数据库为Araport11蛋白序列数据[20],同时检索原始数据库中随机化序列构成的诱饵数据库(decoy database)进行质量控制。参数设置如下:蛋白质水解酶为胰蛋白酶,且允许最多有两个位点的漏切,固定修饰为半胱氨酸的氨基甲酰甲基化(carbamidomethylation),可变修饰为甲硫氨酸的氧化修饰(oxidation),母离子质量偏差设为10 ppm,子离子的质量偏差设为0.02 Da。
高可信度蛋白质(high confidence protein)的筛选标准为:蛋白质组(master proteins)的蛋白质可信度>99%,肽段可信度>95%,且至少包含一个标记为“High”,蛋白质错误发现率(FDR)<0.01。获得的高可信度蛋白用于后续label-free定量分析,表达倍数(FC)≥1.5或≤0.667,且统计检验P<0.05认为是差异表达蛋白质(differentially expressed proteins,DEPs)。
1.2.6 生物信息学分析 DEPs的基因GO的注释和富集分析使用在线工具agriGO[21](http://systemsbiology.cau.edu.cn/agriGOv2/),阈 值 为FDR<0.05。采用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)代 谢 通路数据库对DEPs的代谢通路进行注释,富集使用Metascapes[22],阈值为P<0.05。蛋白质的互作网络检索利用数据库String(https://www.string-db.org/)获得,通过Cytoscape进行可视化。
2 结果
2.1 拟南芥RPP1A缺失突变体的幼苗表型分析
拟南芥野生型WT(Col-0)和rpp1a-1和rpp1a-2突变体共同种植在ES培养基固体平板上,进行表型比较(图1)。与WT相比,rpp1a-1和rpp1a-2突变体幼苗鲜重极显著增加了51%以上(图1-B)。相一致地,rpp1a-1和rpp1a-2突变体的叶片总表面积也极显著增加了48%和52%(图1-C和图1-D)。突变体叶柄长度的增加更为显著,都增加约62%(图1-E)。土培条件下,rpp1a-1和rpp1a-2突变体在生长后期(21 d)地上部生物量与WT相比也增加,但不显著。这表明RPP1A缺失导致拟南芥幼苗生物量增加。

图1 拟南芥WT和rpp1a-1和rpp1a-2突变体幼苗表型Fig. 1 Seedling phenotypes of Arabidopsis thaliana WT and rpp1a-1 and rpp1a-2 mutants
2.2 蛋白质鉴定和差异蛋白质的筛选
提取生长14 d的野生型和rpp1a-2突变体幼苗总蛋白,共鉴定获得高可信度蛋白质4 180个,其中WT和rpp1a-2分别鉴定获得4 037个和4 102个蛋白质(图2)。绝大部分蛋白质(3 959个,94.7%)是WT和rpp1a-2所共有。

图2 WT和rpp1a-2突变体幼苗总蛋白质的韦恩图Fig. 2 Venn diagram of the total proteins detected in the seedlings of WT and rpp1a-2 mutant
与WT相比,rpp1a-2突变体中有280个蛋白质的表达量具有显著差异,差异蛋白占总蛋白质数量的6.70%。如图3所示,差异蛋白中有98个蛋白质(35%)表达量显著上调(FC≥1.5,且P<0.05),182个蛋白质(65%)表达量显著下调(FC≤0.667,且P<0.05),下调蛋白所占比例更大。rpp1a-2突变体虽然在表型上生物量更大,但是很多蛋白质的表达量反而下降。RPP1A只在WT中检测到,而在rpp1a-2突变体中没有检测到该蛋白质,表明该突变体的确在蛋白质水平功能缺失。而RPP1A的同源基因RPP1B和RPP1C在rpp1a-2突变体中的蛋白质表达丰度分别增加了24%和15%,但无显著性差异。
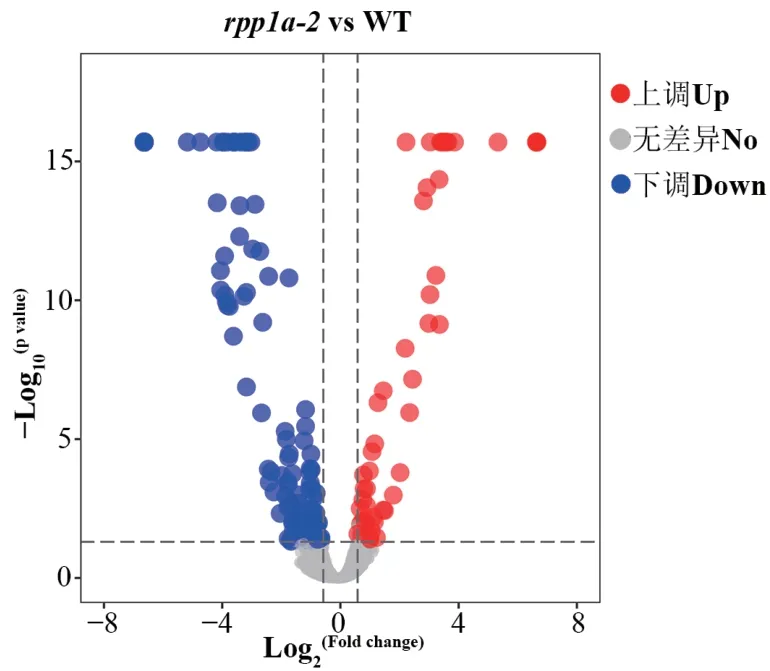
图3 WT和rpp1a-2突变体幼苗差异蛋白质的火山图Fig. 3 Volcano plot of differentially expressed proteins identified in the WT and rpp1a-2 mutant seedlings
2.3 差异蛋白的GO功能注释和富集分析
为进一步解析RPP1A缺失的影响,对WT和rpp1a-2突变体的DEPs进行GO功能注释和富集(图4)。差异蛋白质涉及23个生物学过程(biological process),主要富集在细胞过程(cellular process)、代谢过程(metabolic process)、刺激反应(response to stimulus)、胁迫响应(response to stress)、细胞成分组织或生物发生(cellular component organization or biogenesis)和氧化还原过程(oxidation-reduction process)等生物学过程。差异蛋白的分子功能(molecular function)主要为结合(binding)和催化活性(catalytic activity)。此外,在蛋白质结合(protein binding)、离子结合(ion binding)、poly(A)RNA结合(poly(A)RNA binding)和电子载体活性(electron carrier activity)等分子功能上也显著富集。差异蛋白主要位于细胞质部分(cytoplasmic part),同时在膜(membrane)、细胞器部分(organelle part)和叶绿体(chloroplast)等细胞组分上也显著富集。

图4 WT和rpp1a-2突变体幼苗差异蛋白的GO富集分析Fig. 4 GO enrichment analysis of differentially expressed proteins identified in the WT and rpp1a-2 mutant seedlings
2.4 差异蛋白的KEGG富集分析
进一步对差异表达蛋白进行KEGG富集分析,以解析其参与的代谢通路。结果显示,差异蛋白显著富集到糖体(ath03010)、光合作用(ath00195)、mRNA检测途径(ath03015)、RNA降解(ath03018)、苯丙素的生物合成(ath00940)的代谢通路(表1和图5)。其中,差异蛋白在核糖体途径富集最为显著。核糖体途径中有12个蛋白质的表达量发生显著变化,其中大部分(10个,83%)核糖体蛋白在rpp1a-2突变体中的表达量显著下调,只有2个核糖体蛋白(RPS9M和RPS25B)的表达量在突变体中显著上调(表1)。除了RPS9M是线粒体核糖蛋白,其他差异表达的RPs均是细胞质核糖体蛋白,且一半差异蛋白(6个)位于小亚基上。光合系统途经中富集到5个差异蛋白,其中2个上调,3个下调。铁氧还原蛋白1(ferredoxin 1,FD1)只在WT中表达,而在rpp1a-2突变体中几乎检测不到。mRNA监视通路中有2个蛋白质的丰度显著上调,4个蛋白质的丰度显著下调。苯丙素的生物合成中大部分差异蛋白在突变体中显著下调,包括过氧化物酶(peroxidase)和2个β-葡萄糖苷酶(β-glucosidase)。RNA降解途径中除了磷酸果糖激酶4(phosphofructokinase 4),其他4个差异蛋白的表达量在rpp1a-2突变体中均显著下调。
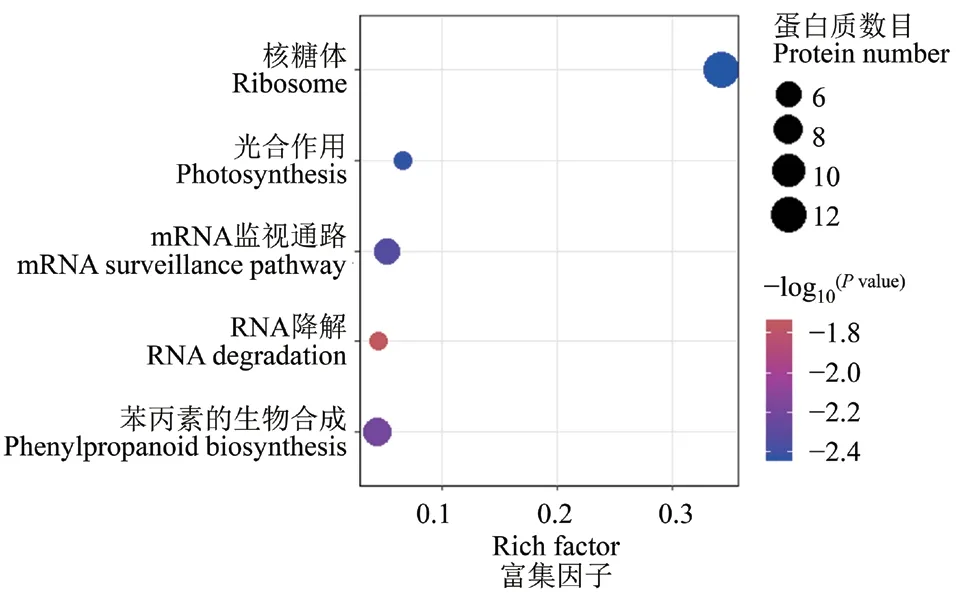
图5 WT和rpp1a-2突变体幼苗差异蛋白的KEGG富集分析Fig. 5 KEGG enrichment analysis of differentially expressed proteins identified in the WT and rpp1a-2 mutant seedlings

表1 显著富集的KEGG通路中的差异表达蛋白Table 1 Differentially expressed proteins in the significantly enriched KEGG pathways

续表 Continued
2.5 差异蛋白的互作网络分析
基于280个差异蛋白通过String在线软件构建蛋白质互作网络,隐藏没有相互作用的蛋白质点,得到100个相互作用的差异蛋白,共存在270种互作关系(P=0.005 24)(图6)。其中,最大的互作模块包括67个差异蛋白。在互作网络中,与核糖体蛋白RPL7Ae(AT4G12600)互作的蛋白质最多,达到25个。这些互作蛋白不仅包括在rpp1a-2突变体中表达量显著下调的核糖体蛋白(RPL31e、RPS15AD、RPS7e、RPS15等),还包括一些表达量显著上调的RNA结合相关的蛋白质RNA解旋酶家族蛋白(RNA helicase family protein,AT2G47250)和rRNA加 工因子PUMILIO PROTEIN 24(PUM24,AT3G16810)。同时,其他一些核糖体蛋白的的互作蛋白也比较多,例如,RPS16C(AT5G18380)有19个互作蛋白,RPS25B(AT2G21580)和RPS7C(AT5G16130)有17个互作蛋白,RPP1A(AT1G01100)、RPL31A(AT2G19740)、RPL34C(AT3G28900)和RPL13D(AT5G23900)有16个互作蛋白。除了核糖体蛋白,还有一些其他代谢途径中的蛋白质也在这个互作网络中。mRNA监视通路中MAGO(mago nashi family protein,MAGO)家族蛋白质、SR蛋白(arginine/serine-rich 45,SR45)、RNA解旋酶(RNA helicase,LBA1)和蛋白磷酸酶2A亚基A3(protein phosphatase 2A subunit A3,PP2AA3)存在14-19个互作蛋白。此外,胁迫响应的蛋白质热休克蛋白81.4(heat shock protein 81.4,HSP81.4)和冷休克结构域蛋白1(cold shock domain protein 1,CSDP1)、冷休克结构域蛋白(glycine-rich protein,GRP2B)也存在于互作网络。表明rpp1a-2突变体可能通过与其他核糖体蛋白、RNA结合相关的蛋白质、mRNA监视通路和胁迫响应的蛋白质的互相作用,进而调控植株的生长。
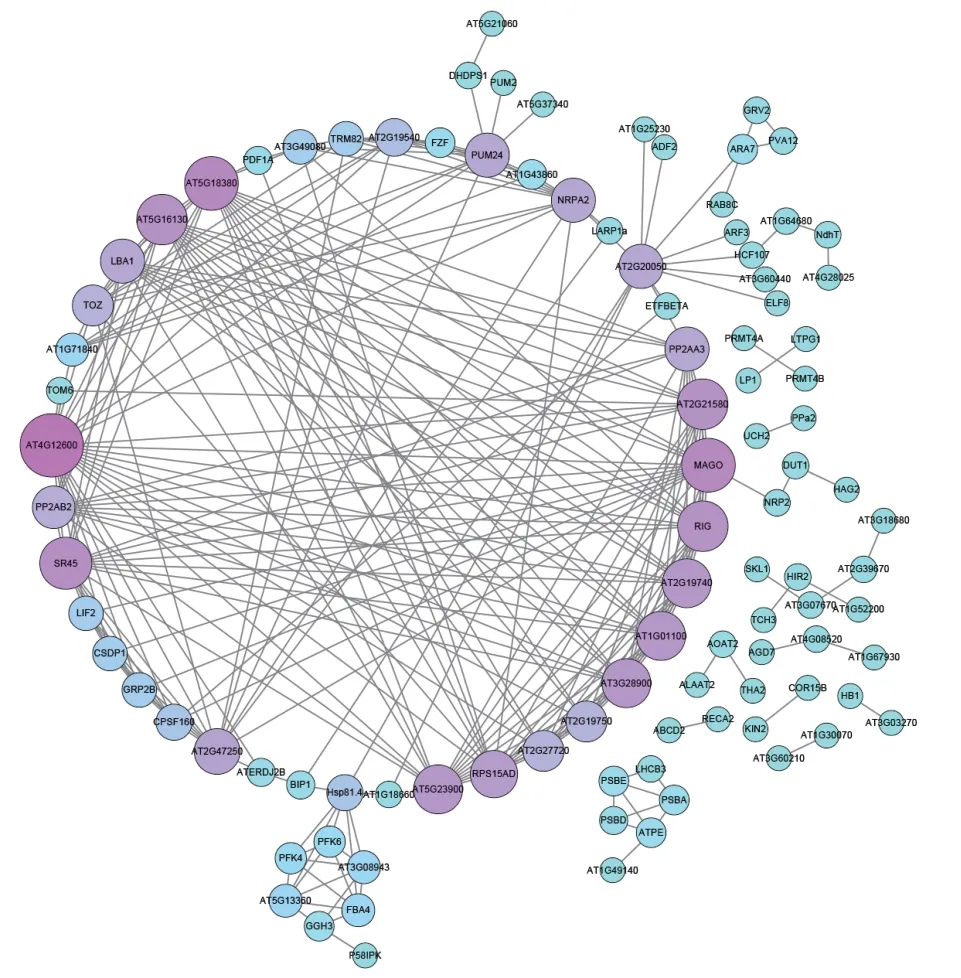
图6 差异蛋白的蛋白质互作网络Fig. 6 Protein-protein interaction network of differentially expressed proteins
3 讨论
核糖体作为细胞内的翻译机器,除了翻译功能外,往往还具有核糖体以外的功能,在植物生长发育和逆境响应中发挥重要作用[7-9,23]。研究表明,很多RPs基因突变会引起一些常见甚至罕见的个体生长发育缺陷表型[8,11,24-25]。本研究发现RPP1A缺失导致幼苗生物量显著增加,其中,叶片面积和叶柄长度增加尤为显著。为了进一步揭示其中的作用机制,采用基于label-free的蛋白质组学分析了WT和rpp1a-2突变体在蛋白质表达水平的差异。本研究一共检测到280个差异蛋白,分别有98个和182个蛋白质表达量显著上调或下调。差异蛋白主要参与细胞过程、代谢过程、刺激反应和胁迫响应等过程。通过大量拟南芥杂种样品的转录组分析也表明与生物量相关的基因在细胞过程、代谢过程、刺激应答、生物调节和发育过程等生物学过程富集[26]。这表明植物生物量由多种因素累积共同决定,不仅受与植物生长发育密切相关的基因控制,而且与植物细胞内环境稳态密切相关。值得注意的是,DEPs中约1/3(93个)富集到刺激反应,包括胁迫响应、非生物刺激反应、温度刺激反应、冷反应,其中26个蛋白质上调,67个蛋白质下调。Yang等[26]研究也表明具有高生物量杂种优势的植株在刺激应答中表现出整体的抑制。植物具有复杂的调控机制来平衡生长和抗逆性的竞争需求应对外部环境的变化,以确保生存和繁殖。rpp1a-2突变体通过抑制对外界环境的响应,进而有利于植物在正常条件下的生长。这些差异蛋白质不仅参与胁迫响应而且也在植物生长发育中发挥调控作用。HSP81.4不仅响应热胁迫,而且在植物胚胎发育中发挥作用[27]。CSDP1不仅响应冷胁迫,也参与调控种子的早期萌发[28]。拟南芥SPIRAL1蛋白(SPR1)是植物特异性蛋白,调节定向的细胞扩张,控制细胞骨架聚合物微管的组装和拆卸[29]。乙烯依赖性向地性缺乏和黄绿蛋白1(ethylene-dependent gravitropism-deficient and yellow-green 1,EGY1)是金属蛋白酶,参与调控拟南芥下胚轴的内胚层质体的大小和数量[30]。
差异蛋白最显著富集的代谢途径是核糖体代谢,表明RPP1A缺失首先会影响其他RPs的表达。其中,RPS9M(AT3G49080)和RPS25B(AT2G21580)的表达量在突变体中显著上调。RPS9M是一种线粒体核糖体蛋白,是中央细胞成熟和胚乳发育所必需的蛋白质[31]。RPS9M可以与线粒体中的锚重复蛋白(ankyrin-repeat protein)ANK6相互作用,进而控制雌配子体的发育。除了RPP1A外,还有9种RPs的表达量在突变体中显著下调,丰度只有WT的33%-63%。这些RPs(RPL31A、RPS30C、RPS7C、RPS15A、RPS16C、RPP2A)参与RNA结合[32],但是这些RPs在生长发育中的功能仍不清楚。
除了核糖体代谢过程外,突变体中光合作用和苯丙素的生物合成代谢过程等代谢途径也显著富集,这表明RPP1A可能通过核糖体外的途径影响幼苗生长。光合作用发生在植物叶片叶绿体中,将太阳能转化为化学能,同时将CO2和水转化为碳水化合物,是推动植物生长发育最基本的关键过程[33]。GO富集显示,有76个蛋白质富集到了叶绿体,其中33个蛋白质上调,43个蛋白质下调。很多定位于叶绿体的碳代谢关键酶的表达量在突变体中显著上调,例如糖酵解途径关键酶磷酸果糖激酶4(phosphofructokinase 4)、磷酸甘油酸变位酶(phosphoglycerate mutase)、光合作用中的CO2固定关键酶磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase)。这 表 明rpp1a-2突变体中的碳代谢显著增强。KEGG富集也表明rpp1a-2突变体导致与光合作用过程相关的一些关键蛋白质亚基的表达量发生了显著变化。光系统II(photosystem II,PSII)反应中心复合物中有3个关键亚基的表达量在rpp1a-2突变体中发生显著变化,其中PSII反应中心蛋白D1(PSBA)和D2(PSBD)的表达量显著上调。PSII反应中心蛋白D1和D2的合成受环境信号影响,对叶绿体发育中PSII的正常生物发生和维持光系统的功能至关重要[34-35]。因此,rpp1a-2突变体中的叶绿体中光合作用中的碳代谢和光反应的增加,有助于提高光合效率,进而促进叶片的生长。
与WT相比,rpp1a-2突变体中苯丙素的生物合成中的3个植物III类血红素过氧化物酶(PRX71、PRX23和PRX47)和2个β-葡萄糖苷酶(BGLU21和BGLU22)的表达量显著下调,但是过氧化物酶(PRX16和PRX72)的表达量则大大地增加。苯丙素合成代谢途径中主要终产物之一是木质素,已有的研究表明拟南芥中PRX47[36]、PRX71[37]和PRX72[38]参与催化木质素聚合。木质素是植物细胞壁的主要组成成分,可以强化细胞壁,促进水分运输,同时在抵御生物和非生物胁迫中发挥作用[39]。同时,苯丙素合成代谢过程中还会产生大量的次级代谢产物,在植物物种特定器官的形成和发育中发挥作用[40]。这表明RPP1A缺失可能通过影响苯丙素的生物合成进而影响植物生长。本研究还发现RPP1A功能缺乏显著影响了mRNA监视通路和RNA降解途径,这些调控蛋白参与植物生长发育的调控。例如,MAGO(mago nashi family protein)家族蛋白质参与植物生长。研究表明,Mago表达量降低的RNA干扰的拟南芥突变株(RNAi-AtMago)的整体发育受阻,叶片明显变小,茎短且偶有扁化的茎[41],而Mago过表达植株叶片增大。而本研究中rpp1a-2突变体中MAGO的表达量增加,这也可能导致叶片增大。互作分析也表明mRNA监视通路和RNA降解途径相关的蛋白质且与核糖体蛋白密切相互作用,因此,rpp1a-2突变体中可能通过与这些蛋白的相互作用进而影响植物生长。
4 结论
拟南芥核糖体蛋白RPP1A缺失导致幼苗生物量显著增加。拟南芥rpp1a-2突变体通过调控核糖体代谢、光合作用、mRNA监视途径、RNA降解和苯丙素的生物合成等代谢通路中进而影响植株叶片生长。