珍稀食用菌紫陀螺菌三峡区域资源调查与化学成分分析*
谭爱华,李方桥**,邓梦匀,胡飞飞
(1.湖北三峡职业技术学院,湖北 宜昌 443000;2.三峡大学生物与制药学院天然产物研究与利用湖北省重点实验室,湖北 宜昌 443002)
紫陀螺菌 [Gomphus purpuraceu(Iwade)Yokoyamas]隶属于担子菌亚门(Basidiomycotina) 非褶菌目(Aphyllophorales) 陀螺菌科(Gomphaceae) 陀螺菌属(Gomphus)[1]。作为一种珍稀食用菌,紫陀螺菌味道鲜美、营养丰富,且含有蛋白质、维生素、糖类以及微量元素等多种营养成分,同时具有易保鲜、易加工等特点,在食品和药品领域具有很大的开发价值[2]。但是目前国内对紫陀螺菌的研究报道甚少,据现有对紫陀螺菌子实体化学成分的研究报道[3],已从紫陀螺菌子实体中分离得到6种化合物,分别为 ergosta-4,6,8 (14),22-tetraen-3-one、4-hydroxy-4-methylpentan-2-one、5,8-epidioxyergosta-6,22-dien-3-ol、methyl 1H-indole-3-carboxylate、3β,5α,9α-trihydroxyergosta-7,22-diene-6-one、purpuracolide。基于上述背景,对紫陀螺菌的形态特征、生长环境及分布进行了初步调查。现将紫陀螺菌三峡区域的资源调查及其化学成分的提取、分离与鉴定情况报道如下。
1 材料与方法
1.1 供试菌株
紫陀螺菌子实体来源于中国三峡地区西陵峡河谷区,由珍稀食用菌紫陀螺菌菌种繁育技术研究课题组保存。
1.2 试验仪器
FA2204B(0.1 mg)电子分析天平,上海越平科学仪器有限公司;N-1100旋转蒸发仪,日本EYELA仪器公司;Bruker-ARX-400核磁共振谱仪,瑞士Bruker公司;Waters高效液相色谱仪1525EF,美国WATERS;Dionex高效液相色谱仪Ultimate 3000,美国Dionex;制备型色谱柱: YMC-Pack ODS-A C18,5 Y,100Å,100ÅC-Pa;薄层层析用硅胶GF254:200目~300目柱层层析硅胶,青岛海洋化工厂生产;Sephadex LH 20葡聚糖凝胶,Merk公司产品;甲醇、石油醚、乙酸乙酯、二氯甲烷均为分析纯。
1.3 试验方法
1.3.1 紫陀螺菌三峡区域的资源调查
对西陵峡河谷区紫陀螺菌资源现状进行了走访和实地调查,观察并记录紫陀螺菌的地理分布、生长环境及主要形态特征。此外,在紫陀螺菌生长地宜昌市兆吉坪村八组林地进行定点观测,选择了3个样地,观测其地形、海拔、植被、气候、土壤等环境因子与紫陀螺菌生长发育的关系。
1.3.2 化学成分的提取与分离
取干燥的紫陀螺菌子实体粉末160 g,用3倍体积甲醇浸提,共3次,每次12 h。提取液合并后减压浓缩得到总浸膏10 g,将浸膏在水中充分混悬后,分别用石油醚(料液比1∶2)、二氯甲烷(料液比1∶3)、乙酸乙酯(料液比1∶2) 等有机溶剂萃取;减压浓缩后得到石油醚萃取相2.304 3 g、二氯甲烷萃取相0.716 0 g、乙酸乙酯萃取相0.272 0 g、水相6.844 8 g。经HPLC分析,二氯甲烷和水相片段化学成分较为单一,适合快速分离鉴定。
二氯甲烷萃取浸膏经葡聚糖凝胶柱层析,二氯甲烷∶甲醇为洗脱剂梯度洗脱,得到23个洗脱片段(GD1~GD23),经TLC分析,合并洗脱片段GD10~GD15和GD16~GD23,分别标记为GD10(621 mg)和GD16(351.3 mg)。GD10经正相硅胶柱层析和薄层硅胶层析分离纯化,得到纯度较高的片段G10-1,为化合物1。GD16经正相硅胶柱层析分离纯化得到洗脱片段1~21,经TLC分析,合并洗脱片段3~5,标记为G16-3,经HPLC分离纯化(HPLC条件:甲醇10%,波长254 nm;流速2 mL·min-1;洗脱时间20 min),得到纯度较高的片段G16-3-2,为化合物2。
水相浸膏以甲醇溶液(0~100%)为洗脱剂,分段洗脱,经反相硅胶柱层析分离,纯化得到40个洗脱片段(GOP-Z-W-1~GOP-Z-W-40);后经HPLC分析(HPLC条件:10%~100%乙腈溶液梯度洗脱40 min,100%乙腈洗脱10 min,波长254 nm;流速1 mL·min-1),合并得到纯度较高的片段GOP-Z-W-1,为化合物3,片段GOP-Z-W-18经HPLC制备得到化合物4。
将紫陀螺菌菌株进行适宜条件发酵,发酵液用乙酸乙酯萃取,减压浓缩得到乙酸乙酯萃取相。乙酸乙酯萃取相经HPLC(以24%甲醇30 min变梯度到80%甲醇为洗脱条件,变梯度制备)分离,得到化合物5。
1.3.3 化合物的结构鉴定
通过核磁共振谱仪对化合物1(G10-1)、化合物2(G16-3-2)、化合物3(GOP-Z-W-1)、化合物4(GOP-Z-W-18)、化合物5进行结构鉴定,分析得到各化合物的结构。
2 结果与分析
2.1 分布范围和生长环境
紫陀螺菌主要分布在西陵峡南岸、海拔400 m~800 m的山脊及山腰中(碑垭、鲍家桩、兆吉坪一带)。子实体为单生、丛生或者群生于林中地,且大多呈带状分布,长达数米。易生长在直径20 cm以上的青冈栎、黄栌树或马尾松树蔸附近。
2.2 发生季节与气候特征
紫陀螺菌子实体的发生季节一般为每年的6月下旬~9月中旬(最迟可延至11月上旬),前后共发生三潮~四潮,高峰期为7月上中旬。子实体生长期间的日平均气温为20℃~28℃,空气相对湿度为75%~85%。其发生量还与降雨密切相关,若长期干旱或下雨,发生量较少;晴雨交替,发生量较大。紫陀螺菌子实体生长速度缓慢,成熟期15 d~20 d,若光线较强其生长速度更慢。由此可见,紫陀螺菌子实体易生长在光线阴暗且潮湿的林地。
2.3 定点观测结果
实地采样的紫陀螺菌子实体见图1。

图1 紫陀螺菌子实体Fig.1 Fruit body of Gomphus purpuraceus
紫陀螺菌生长地多为阔叶混交林(以青冈栎、黄栌树为主),林高7 m左右,林间郁闭度70%~80%。林地土壤为碳酸盐类黄棕壤,偏酸性,pH 6.0左右,可能与其他微生物的活动、共生植物根系的分布及土壤松散多石、透气性较好有关。
2.4 化合物的结构鉴定与分析
2.4.1 邻苯二甲酸-双(2’-乙基庚基) 酯
化合物1(G10-1) 为邻苯二甲酸-双(2’-乙基庚基)酯[phthalic acid-bis(2’-ethyl heptanyl)easter],黄色油状物,化学式为C26H42O4,其化学结构见图2。

图2 化合物1的化学结构Fig.2 Chemical structures of compound 1
化合物1的核磁共振图谱数据如下。
1)1H-NMR(400 MHz,CDCl3)的化学位移(δ):7.71 (2H,dd,J=3.2,5.6 Hz,H-3,6),7.53(2H,dd,J=3.2,5.6 Hz,H-4,5),4.30(4H,m,H-1′,1″),1.72 (2H,m,H-2′,2″),1.39 (20H,m,10×CH2),0.96(6H,t,J=7.6 Hz,H-b′,b″),0.90(6H,t,J=6.4 Hz,H-7′,7″)。
2)13C-NMR(100 MHz,CDCl3)的化学位移(δ):167.7(2 × C=0),132.5(C-1,2),130.9(C-3,6),128.8 (C-4,5),68.1 (C-1′,1″),38.7 (C-2′,2″),30.4 (C-3′,3″),29.7 (C-4′,4″),28.9 (C-5′,5″),23.7 (C-6′,6″),23.0 (C-a′,a″),14.1(C-7′,7″),11.0(C-b′,b″)。
根据G10-1的碳谱、氢谱数据,与参考文献[5]报道的谱图数据基本吻合,由此确定化合物1为邻苯二甲酸-双(2’-乙基庚基)酯。
2.4.2 邻苯二甲酸-二(2-乙基己基)酯
化合物2(G16-3-2) 为邻苯二甲酸-二(2-乙基己基)酯[Bis(2-ethlhexyl)phthalate],又称邻苯二甲酸二辛酯,无色透明液体,化学式为C24H38O4,其化学结构见图3。

图3 化合物2的化学结构Fig.3 Chemical structures of compound 2
化合物2的核磁共振图谱数据如下。
1)1H-NMR(400 MHz,CDCl3)的化学位移(δ):7.72 (2H,dd,J=3.4,5.7 Hz,H-2),7.52(2H,dd,J=3.4,5.7 Hz,H-3),4.26(4H,d,J=6.5 Hz,H-1′),1.77 (2H,m,H-2′),1.26 (16H,m,H-3′,4′,5′,7′),0.94 (6H,t,J=7.4 Hz,H-8′),0.88(6H,t,J=7.8Hz,H-6′)。
2)13C-NMR(100 MHz,CDCl3)的化学位移(δ):167.8(CO),132.4(C-1),130.9(C-3),128.8 (C-2),68.2 (C-1′),38.8 (C-2′),30.4(C-3′),29.0(C-4′),23.8(C-7′),23.0(C-5′),14.0(C-6′),11.0(C-8′)。
根据G-16-3-2的碳谱、氢谱数据,与参考文献[4]报道的谱图数据基本吻合,由此确定化合物2为邻苯二甲酸-二(2-乙基己基) 酯。
2.4.3 D-半乳糖醇
化合物3(GOP-Z-W-1) 为D-半乳糖醇(D-galactitol),无色结晶粉末,化学式为C6H14O6,分子量182.17,其化学结构见图4。

图4 化合物3的化学结构Fig.4 Chemical structures of compound 3
核磁共振波谱分析数据如下。
1)1H-NMR(400 MHz,DMSO-d6)的化学位移(δ):3.36(2H,m,2,5-CH),3.49(2H,m,3,4-CH),3.64(4H,m,l,6-CH2),4.18(2H,d,3,4-OH),4.29 (2H,t,2,5-OH),4.42(2H,d,1,6-OH)。
2)13C-NMR(100 MHz,DMSO-d6)的化学位移 (δ):64.3(C-1,6),70.0(C-2,5),71.8(C-3,4)。
根据GOP-Z-W-1的碳谱、氢谱数据,与参考文献[6]报道的谱图数据基本吻合,由此确定化合物3水相GOP-Z-W-1为D-半乳糖醇。
2.4.4 腺苷
化合物 4(GOP-Z-W-18) 为腺苷 (Adenosine),又称9-β-D-呋喃核糖基腺嘌呤,白色或类白色结晶性粉末,化学式为C10H13N5O4,其化学结构见图5。
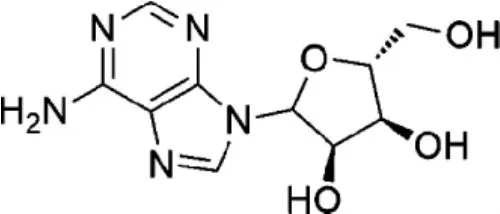
图5 化合物4的化学结构Fig.5 Chemical structures of compound 4
化合物4的核磁共振波谱分析数据如下。
1)1H-NMR(600 MHz,DMSO-d6)的化学位移(δ):8.35 (1H,s,H-8),8.13 (1H,s,H-2),5.88(1H,d,J=6.4 Hz,H-1′),4.62(1H,d,J=6.0 Hz,H-2′),4.14 (1H,dd,J=2.8 Hz,J=4.8 Hz,H-3′),3.96 (1H,dd,J=12.8 Hz,J=26.4 Hz),3.68 (1H,dd,J=13.6 Hz,J=28.4 Hz,H-5′a),3.56 (1H,dd,J=3.6 Hz,J=7.9 Hz,H-5′b)。
2)13C-NMR(150 MНz,DМSО-d6)的化学位移 (δ):156.7(С-6),152.9(С-2),149.6(C-4),140.4 (C-8),119.8 (C-5),88.4 (C-1′),86.4(C-4′),73.9(C-2′),71.1(C-3′),62.1(C-5′)。
根据GOP-Z-W-18的碳谱、氢谱数据,与参考文献[7]报道的谱图数据基本吻合,由此确定化合物4水相GOP-Z-W-18为腺苷。
2.4.5 吲哚-3-羧酸甲酯
化合物5为吲哚-3-羧酸甲酯(indole-3-carboxylate methyl ester),又名3-吲哚甲酸甲酯,白色结晶(甲醇),化学式为C10H9NO2,分子量175.184,其化学结构见图6。
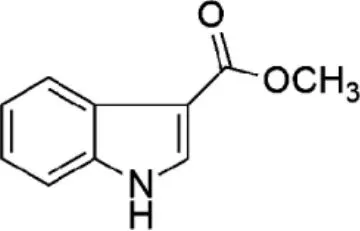
图6 化合物5的化学结构Fig.6 Chemical structures of compound 5
核磁共振波谱分析数据如下。
1)1H-NMR(400 MHz,DMSO-d6)的化学位移(δ):11.97(1H,brs,1-NH),8.07(1H,s,H-2),7.99(1H,d,J=6.9 Hz,H-7),7.48(1H,d,J=6.9 Hz,H-4),7.19 (2H,m,H-5,6)。
2)13C-NMR(125 MHz,DMSO-d6)的化学位移 (δ):165.2(C=O),136.8(C-2),132.9(C-8),126.1 (C-9),122.8 (C-4),121.1 (C-6),120.87(C-5),112.8(C-7),106.8(C-3),51.1(-OCH3)。
根据化合物5的碳谱、氢谱数据,与参考文献[8]报道的谱图数据基本吻合,由此确定化合物5为吲哚-3-羧酸甲酯。
3 结论与讨论
紫陀螺菌为单生或丛生,菌肉淡紫色,子实体表呈紫色,长椭圆形[9]。其生长环境潮湿,光线阴暗,常生长在青冈栎等附近[10]。三峡地区山高林茂,地形复杂,气候温和适宜,是紫陀螺菌良好的生长地[11]。紫陀螺菌的生长速度慢、周期长,需要适宜的环境才能大规模培养优质菌种。此次在三峡地区调查其生长环境及分布,为以后紫陀螺菌的人工培养及开发利用提供方向,对提高珍稀野生食用菌产量、品质及保护真菌资源具有重要意义。紫陀螺菌含有蛋白质、维生素、微量元素等多种营养物质[12],可充分利用其食用价值,提高三峡地区农民的经济收入。国内外对紫陀螺菌化学成分的研究较少,作者对紫陀螺菌的化学成分进行深入研究,得到化合物邻苯二甲酸-双(2’-乙基庚基) 酯、邻苯二甲酸-二(2-乙基己基) 酯、D-半乳糖醇、腺苷、吲哚-3-羧酸甲酯。紫陀螺菌含有的化学成分中含有丰富的药理活性[13],加大对其化学成分的研究,提高提取工艺的精简性,为开发药理性保健品及研制出新的抗癌抑菌药物提供了重要依据。

