非急性症状性颅内前循环大动脉闭塞血管内治疗的疗效观察
赵 芳, 周 畅, 李广文, 孙玉杰, 刘彤辉
症状性动脉粥样硬化性非急性颅内颈内动脉闭塞性疾病所致的脑卒中/短暂性脑缺血发作复发风险高,神经功能预后差、病死率高[1]。即使给予积极内科治疗,部分患者仍症状波动或症状恶化,且长期低灌注可致脑萎缩,表现为认知功能障碍。安全、有效的治疗很重要,而目前该疾病有效的治疗方法不明确[2]。本研究报道30例非急性症状性颅内颈内动脉大动脉粥样硬化性闭塞患者,均行血管内治疗,以探索血管再通治疗的疗效。
1 方 法
1.1 患者选择 选取青岛大学附属医院神经介入科2016年-2021年期间行脑动脉球囊成形术或支架置入术治疗的30例非急性症状性颅内前循环大动脉闭塞病例作为研究对象,男性13例(43.3%),女性17例(56.7%);中位年龄61岁,范围43~75岁。既往高血压病史25例,糖尿病病史14例,高脂血症病史7例,冠状动脉粥样硬化性心脏病病史6例,吸烟史5例。主要症状:左侧肢体无力12例,右侧肢体无力12例,右侧面瘫2例,视物模糊1例,言语不清9例,高级智能减退1例,头部不适3例。症状-手术中位时间36 d,范围3~360 d,影像-手术中位时间7 d,范围2~45 d。
1.1.1 纳入标准 (1)DSA检查示闭塞部位无血流通过或者CTA/MRA检查示闭塞并经DSA证实(闭塞部位位于颈内动脉C6、C7段,大脑中动脉M1、M2段);(2)存在颅内前循环大动脉供血区缺血相关症状(介入治疗前6 m内闭塞血管供血区域相关的TIA或卒中反复发作);(3)影像证实闭塞或症状发生至介入治疗时间>24 h;(4)给予双联抗血小板或抗凝和危险因素控制治疗,症状再次出现及影像仍进展;(5)头部CT、MRI示分水岭区脑梗死;或CT灌注成像、MRI灌注成像示颅内前循环大动脉供血区脑血流量减少、脑血容量正常或降低、达峰时间和平均通过时间增加;或美国介入和治疗神经放射学学会/介入放射学学会的动脉侧支循环分级标准(arterialcoiiateral circulation grade,ACG)≤3分;(6)术前mRS评分≤3分;(7)至少存在1个动脉粥样硬化危险因素(高血压、糖尿病、高脂血症、吸烟)。
1.1.2 排除标准 (1)急性颅内前循环大动脉闭塞;(2)非动脉粥样硬化性闭塞(如动脉夹层、纤维肌发育不良、遗传性结缔组织病、扩张性动脉病、脑淀粉样血管病、血管炎等);(3)CT或血管造影示责任血管明显钙化(定义为钙化成角>180°);(4)已知对阿司匹林、氯吡格雷、肝素、金属过敏病史或禁忌证;(5)不能纠正的出血素质;(6)因其他疾病,预期寿命<1年;(7)其他不宜手术情况。
1.1.3 知情同意 纳入病例术前均签署手术知情告知书。
1.2 术前准备 术前每天应用阿司匹林100 mg+氯吡格雷75 mg≥3 d,控制血压(目标:<180/100 mmHg)、血糖(目标:空腹血糖 3.9~6.1 mmol/L,糖化血红蛋白<7.0%)、血脂(目标:LDL-C<1.8 mmol/L即70 mg/dl或至少降低50%)及其他相关危险因素。
1.3 手术经过 行全身麻醉及静脉注射肝素钠,维持活化凝血时间在250~300 S内。于右侧股动脉穿刺置入6F股动脉鞘,将6F指引导管置于闭塞段近端。在路图指引下将Excelsior SL-10微导管(Stryker,USA)配合Synchro2微导丝(Stryker,USA)小心通过闭塞段。微导管超选造影证实在闭塞远端真腔,沿微导丝送入球囊由远及近进行扩张,再次造影测量残余狭窄,据情况决定是否需再次行球囊扩张术或行支架置入术。造影查看血流,TICI分级2b级及以上为再通成功。
1.4 术后管理 术后若有血栓形成,可行盐酸替罗非班[0.15 μg/(kg·min)]静脉泵入;术后2 d行头部CT检查,排除脑出血;术后应用双联抗血小板治疗至少3 m;高血压患者降压目标是<140/90 mmHg(1 mmHg=0.133 kPa),≥65岁的老年人降压目标是<150/90 mmHg,如果能耐受还可进一步降低至<140/90 mmHg;糖尿病、肾脏病和冠状动脉粥样硬化性心脏病的降压目标为<130/80 mmHg[3]。糖尿病血糖控制目标:空腹血糖 3.9~6.1 mmol/L,糖化血红蛋白<7.0%[4]。高脂血症LDL-C控制目标:LDL-C<1.8 mmol/L即70 mg/dl或至少降低50%并维持在该水平。
1.5 影像及临床随访 采用DSA或CTA随访支架内再狭窄情况,支架内再狭窄定义为经血管造影证实支架内或支架周围5 mm范围内狭窄>50%[5];采用ASL、CTP或MRP随访责任血管低灌注情况,与术前该血管供血区域及对侧同名血管供血区域对比。采用术前24 h、术后24 h随访的NIHSS评分,将神经功能缺损程度分为正常或近乎正常(NIHSS评分0~1分)、轻度卒中/小卒中(NIHSS评分1~4分)、中度卒中(NIHSS评分5~15分)、中-重度卒中(NIHSS评分15~21分)、重度卒中(NIHSS评分21~42分)[6];采用术前24 h、术后7 d及随后门诊或电话随访mRS评分,将神经功能残障情况分为良好(mRS评分0~2分)、中等(mRS评分3分)、较差(mRS评分4~5分),将术后神经功能残障变化情况分为改善(mRS评分降低≥1分)、维持(mRS评分降低/升高=0分)或恶化(mRS评分升高≥1分)[7]。
1.6 数据分析 采用SPSS 21.0软件处理数据,计量资料比较采用秩和检验,计数资料以例数(百分比)表示,比较采用卡方检验,P<0.05差异有统计学意义。
2 结 果
2.1 基线资料 30例患者接受血管内再通治疗,其中男性13例(43.3%),女性17例(56.7%),中位年龄61岁(43~75岁)。30例患者均具有至少1项大动脉粥样硬化危险因素,其中高血压25例(83.3%),糖尿病14例(46.7%),高脂血症7例(23.3%),吸烟史5例(16.7%),动脉粥样硬化性心脏病6例(20.0%)。所有患者均有卒中或TIA病史。症状包括左侧肢体无力12例,右侧肢体无力12例,右侧面部瘫痪2例,视物模糊1例,言语不清9例,高级智能减退1例,头部不适3例(见表1、表2)。

表1 30例患者基线资料

表2 30例患者危险因素个数
2.2 主要手术结果 30例行血管内再通手术患者中28例成功开通闭塞血管,1例术中发生脑血管破裂出血,另1例术中发生夹层而未成功开通闭塞血管。成功开通的28例患者中单纯球囊扩张手术患者9例,行球囊扩张加支架置入手术者19例,其中行分期手术者4例。使用支架的类型包括Neuroform(9例,47.4%)、Apollo(4例,21.1%)、ENTERPRISE(3例,15.8%)、Solitair(2例,10.5%)、Wingspan(1例,5.3%)。28例成功开通患者术中出现并发症4例,其中术中并发症3例,包括脑血管破裂出血2例及脑血管夹层1例;术后并发症1例,即脑高灌注综合征1例。28例手术成功患者术后1 w症状改善,2例手术未成功患者术后1 w症状较术前无变化(见表3)。
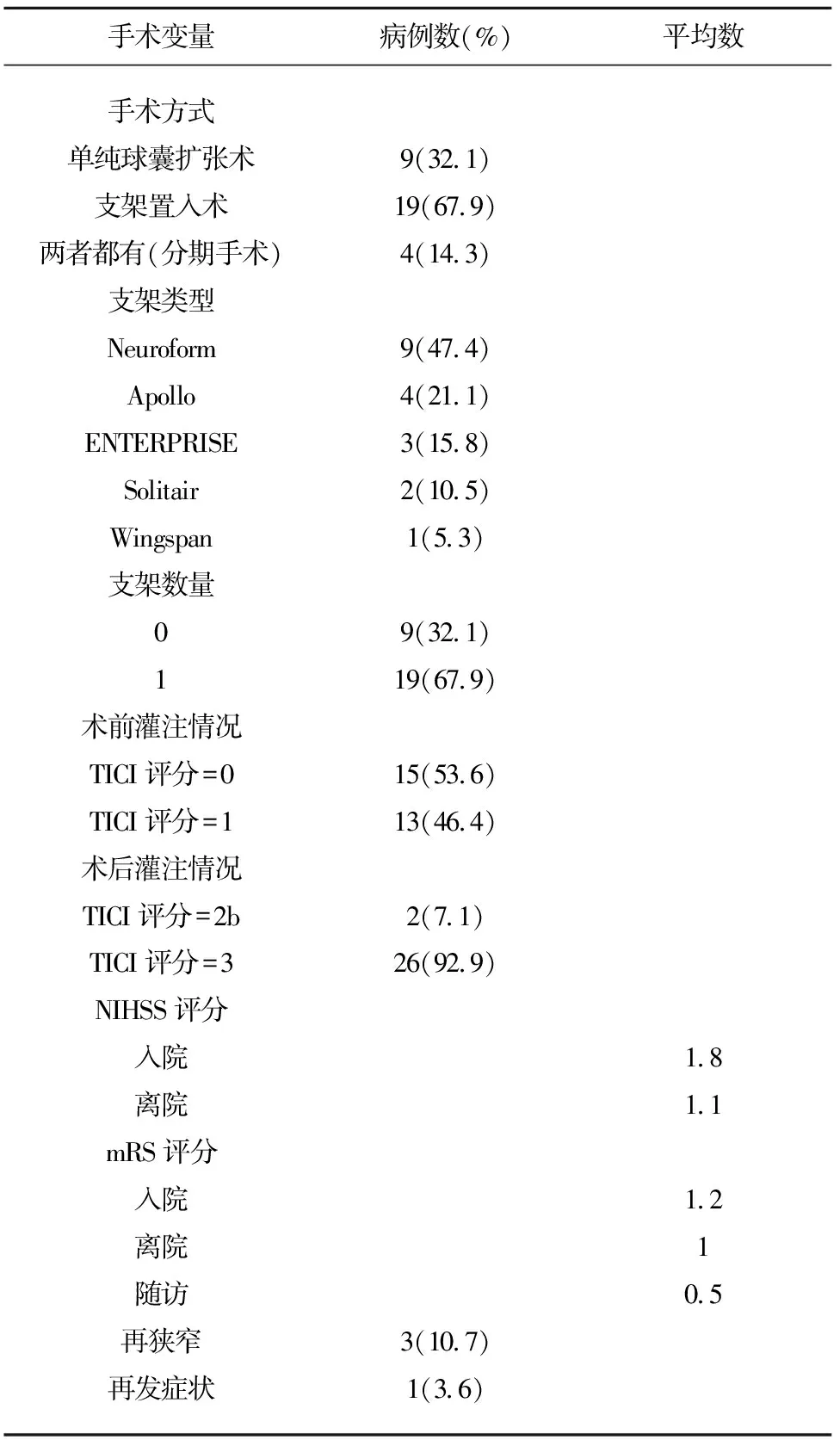
表3 28例手术患者手术相关资料
2.3 造影及临床随访结果 18例患者行CTA/MRA/DSA进行影像随访,随访平均时间427 d,随访中位时间371 d,其中再狭窄3例,1例再狭窄达50%,术后再发2次责任血管供血区TIA,余2例再狭窄达80%和60%,术后无再发症状,为无症状狭窄;其余15例未见支架内再狭窄或闭塞。30例患者门诊或通过电话进行临床随访,平均随访时间698 d,中位随访时间709 d。28例血管内治疗成功患者临床随访1例再发TIA,余27例患者未再发TIA或脑卒中,术后随访mRS评分均≤2分,神经功能残障情况为良好,随访mRS评分较术前改善,差异有统计学意义;2例血管内治疗未成功患者临床随访均再发TIA或脑梗死(见表4)。

表4 28例手术病例随访评分资料
3 讨 论
在危险因素、遗传和环境等因素作用下内膜下纤维及平滑肌组织过度增生,并且脂质物质沉积形成斑块侵犯管腔,斑块溃疡、血小板颗粒及血栓黏附在斑块裂口、斑块内出血导致血管管腔逐渐变小直至闭塞是粥样硬化性颅内颈内动脉闭塞的基础病理变化。当颈内动脉次全或完全闭塞时,由于血容量减少导致血流减少,因此流速减低,灌注和压力降低导致微栓子清除能力下降,特别在动脉交界区,因此分水岭及皮质下梗死由于低灌注合并微栓子栓塞引起[8]。
非急性颅内大动脉闭塞病例侧支代偿程度与其缺血性卒中复发和死亡有关,侧支代偿丰富病例,缺血性卒中复发率低,预后好,而侧支代偿贫乏患者,即使进行双联抗血小板并控制危险因素治疗,缺血性卒中复发率高,死亡率高[9]。对于脑卒中患者给予强化药物治疗与血管内治疗比较,前者更安全有效,而对于给予双联抗血小板并控制危险因素治疗的存在非急性颅内大动脉闭塞的缺血性卒中患者,若仍反复出现缺血性卒中症状,血管内介入开通闭塞的血管联合术后药物治疗可作为一种治疗方法[10]。因此本研究纳入经强化药物治疗仍反复发作TIA或脑卒中,并经影像学证实存在因侧支代偿不良所致的脑灌注不足。病例均存在至少一项大动脉粥样硬化的危险因素,具危险因素定义为:高血压/糖尿病/高脂血症为既往病史,长期口服或未服药物,控制好或差;或者新近确证的高血压/糖尿病/高脂血症[11]。除前述危险因素外,既往或现存的冠状动脉粥样硬化性心脏病被认为多与脑血管粥样硬化并存[12]。
非急性颅内前循环大动脉粥样硬化性闭塞的血管内治疗技术成功率、并发症发生率与病变部位、血管直径、闭塞长度、角度、局部钙化程度及术者经验等因素有关。前循环大动脉颅内段较颅外段有更多的分支,管径更小,走行更迂曲,因此病变位于前循环大动脉越远端,手术难度越大,并发症发生率越高。就颅内前循环大动脉而言,目前认为适合手术部位为:颈内动脉6-7段(C6-7段),大脑中动脉1-2段(M1-2段)。与大脑中动脉远端闭塞相比,颈内动脉远端和大脑中动脉近端闭塞血管内再灌注治疗与良好的临床预后更相关[13]。目前认为适合手术的闭塞处血管直径和闭塞长度为:直径>2 mm,闭塞长度<15 mm。CTA及DSA可明确病变部位、闭塞处血管直径和闭塞长度。严重成角及钙化严重血管,再通成功率会下降,血管超声可明确血管病变性质、有无溃疡及血流情况,手术成功率还与术者经验有关[14,15]。本研究中30例均为严格按照纳排标准筛选病例,28例术后TICI分级≥2b级,获得技术成功,2例因术中分别并发动脉夹层和血管破裂出血而再通失败。技术成功率93.3%,并发症发生率20.0%,无死亡病例,对存在术中或术后并发症的病例随访显示:影像随访中,并发症并未遗留影像学病灶,临床随访中,并发症也未遗留临床症状。本研究纳入闭塞部位位于C6-7段或M1-2段,闭塞处血管直径>2 mm或闭塞长度<15 mm的病例;排除成角、钙化严重病例。术中先由微导丝通过闭塞部位,经造影剂显影远端血管形态、走向,再在路图引导下行血管再通,使手术者更有预见性行血管内再通治疗,提高手术成功率,降低并发症发生率[16]。
非急性颅内前循环大动脉粥样硬化性闭塞的血管内治疗的术中、术后并发症如:动脉夹层、动脉破裂出血、高灌注综合征、血栓形成、远端血管栓塞、迷走反射等[17]。本研究中有并发症6例,其中术中并发症3例,包括动脉破裂出血3例和动脉夹层2例;术后并发症1例,即脑高灌注综合征1例。1例动脉破裂出血及1例动脉夹层致手术失败,并发症均未遗留严重后遗症状。据研究术中最多见并发症为动脉夹层,本研究中动脉夹层2例,对于术中出现的动脉夹层给予放置支架或终止手术处理。动脉破裂出血作为出血性并发症在介入手术中多见,与介入治疗血管内狭窄不同,治疗血管闭塞不能明确闭塞部位解剖及路径,因此导丝易穿出血管导致血管破裂出血,对于血管破裂出血,术中置入支架或终止手术处理。高灌注综合征与侧支代偿不良有关,表现为术后影像学检查示脑出血,并表现相应症状,对于高灌注综合征,分期支架置入术且术后严格控制血压可降低术后高灌注发生率。血栓栓塞多发生在导丝通过闭塞段时操作中断或球囊扩张时,病变部位血栓脱落,阻塞远端穿支动脉,对于该并发症有研究发现置入远、近端保护装置与不放置保护装置血栓栓塞风险相当,对于此种并发症多术中溶栓。穿支闭塞易发生在球囊扩张闭塞处,使载体动脉斑块压扁堵塞穿支开口,导致术后穿支供血区缺血症状。术后出现血压、心率低为迷走反射所致,属良性手术并发症,经补液、升压治疗,血压心率多于术后24 h恢复正常[18]。颅内前循环大动脉解剖结构的多分支、小管径和形状迂曲决定其行血管内治疗难度大,并发症多。术前严格按照纳排标准筛选病例,术中遇到微导丝难以通过的复杂部位,适时结束手术,并严格进行围手术期和术后危险因素控制,以减少严重并发症的发生。
4 结 论
对于经纳入和排除标准严格筛选的非急性症状性颅内前循环大动脉闭塞病例,行血管内治疗可促进神经功能恢复,并可降低责任血管供血区相关的TIA或脑卒中再发率,具有安全性和有效性。因此,对于强化药物治疗无效的符合纳入标准的病例,血管内治疗联合药物治疗可作为一个选择。

