羊α干扰素在家蚕中的表达及抗小反刍兽疫病毒活性测定
李丹 杜梦潭 修明霞 刘兴健 张志芳 李轶女
(1. 中国农业科学院生物技术研究所,北京 100081;2. 乳山市果茶蚕工作站,烟台 264500)
干扰素(interferons,IFNs)是病毒或其他诱生剂刺激机体后产生的高活性糖蛋白,具有广谱的抗病毒、抗肿瘤及免疫调节活性。1957年,英国病毒生物学家Isaacs在流感病毒实验中发现,经病毒感染的细胞会产生某种因子,可以干扰病毒在其它细胞中的复制,因此将其命名为干扰素[1]。近年来,干扰素在病毒学、肿瘤学、细胞学等多个领域成为研究热点,已经被应用于治疗畜禽的病毒性疾病及肿瘤性疾病,并取得良好的效果[2]。此外,由于其治疗周期短、能有效预防继发感染、减少抗生素使用等优点,越来越受到人们的重视。
根据其结合的特异性受体差异,干扰素可被分为I型、Ⅱ型和Ⅲ型。I型干扰素有IFN-α、IFN-β等,IFN-α根据氨基酸序列不同,又将分为IFN-α-2a、IFN-α-1b、IFN-α-2b等,I型干扰素具有很强的抗病毒和抗肿瘤活性,对病毒感染引起的免疫反应发挥重要的调节作用。目前,I型干扰素的研究被广泛关注,已经成为病毒学、肿瘤学等多个学科的研究热点。Ⅱ型干扰素为IFN-γ,其主要功能是诱导主要组织相容性复合体(MHC)类抗原的表达和进行免疫调节,但其抗病毒作用弱于I型干扰素[3]。I型干扰素与Ⅱ型干扰素在理化特性及生物学活性上具有明显的差异,如I型干扰素能够耐受pH 2.0的酸性条件,而Ⅱ型干扰素则会失活[4]。Ⅲ型干扰素为IFN-λ,于2013年首次被发现[5-6],具有广谱的抗病毒及免疫调节活性[7]。
IFN-α属于I型干扰素,具有高度的同源性和明显的种族特异性,人的干扰素由约165个氨基酸残基组成,分子量约为19 kD[8-9],主要由B淋巴细胞及部分巨噬细胞产生[10]。IFN-α可以通过增强NK细胞活性、促进B细胞增生来提高体液免疫活性,实现一定的抗病毒作用。此外,IFN-α可上调Th细胞上白细胞介素受体、主要组织相容性复合体 I、Ⅱ类分子的表达,增强CD8+细胞毒性T细胞应答,通过多种病毒相互作用途径调节免疫活性[11]。由于IFN-α具有良好抗病毒及免疫调节作用,近年来被广泛应用于临床[12-14],如抗病毒、抗肿瘤、免疫调节等[15]。
小反刍兽疫病毒(peste des petits ruminants virus,PPRV),属于副黏病毒科、麻疹病毒属,是一种单股负链RNA病毒,主要感染山羊、绵羊等小反刍动物[16],给全球畜牧业的发展带来严重的损失[17]。本研究将羊α干扰素基因序列进行优化合成,利用杆状病毒表达系统在家蚕中进行表达,根据细胞病变抑制法在BHK-VSV*GFP系统中检测其抗病毒活性,并对其抑制小反刍兽疫病毒增殖活性进行测定。
1 材料与方法
1.1 材料
大肠杆菌(Escherichia coli)感受态细胞Trans 5α购自北京全式金生物技术有限公司;高保真DNA聚合酶购自南京诺唯赞生物科技有限公司;BamH I、EcoR I限制性内切酶、T4DNA连接酶、DNA Marker购自Thermo Scientific公司;实验用家蚕(JY1)来自中国农业科学院蚕业研究所;脂质体购自Invitrogen公司;DMEM培养基、胎牛血清(FBS)购自Gibco公司;病毒基因组提取试剂盒、质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒购自北京天根生化科技有限公司;杆状病毒转移载体pVL1393、失活拯救型穿梭质粒reBmBac、家蚕卵巢细胞系(BmN)、重组表达绿色荧光蛋白的水疱型口炎病毒(VSV- GFP)、幼地鼠肾细胞(BHK)皆由本实验室保存;小反刍兽疫病毒疫苗(Clone9株)购自天康生物技术有限公司;其他试剂均为国产或进口分析纯。
1.2 方法
1.2.1 目的基因的优化合成 从GenBank数据库中查找目前已公布的羊α干扰素所有亚型的氨基酸序列,利用MEGA软件[18]进行序列比对,筛选最优氨基酸序列,并通过SignalP、TMHMM软件对其进行信号肽预测及跨膜区分析,选择分泌效率高的信号肽序列。根据家蚕密码子偏好性对相应基因序列进行优化合成,在其上游添加Kozak序列提高翻译效率,下游添加终止密码子终止翻译。利用DNAMAN进行酶切位点分析后,将该序列5′端添加BamH I酶切位点,3′端添加EcoR I酶切位点便于克隆操作,优化后的序列交由南京金斯瑞生物科技有限公司合成。合成后的基因序列连接在pUC57载体上,命名为pUC57-OviIFN-α。
1.2.2 pVL1393-OviIFN-α转移载体的构建 将合成后的质粒pUC57-OviIFN-α及杆状病毒转移载体pVL1393利用 BamH I、EcoR I于 37℃酶切 30 min,pUC57- OviIFN-α酶切产物经琼脂糖凝胶电泳将大小不同的片段分离,用胶回收试剂盒回收OviIFN-α基因片段。pVL1393酶切产物经85℃灭活10 min后,与OviIFN-α片段以1∶6的比例混合,在T4DNA连接酶的作用下,于25℃连接10 min,转化大肠杆菌Trans 5α感受态细胞,在含有氨苄抗性(60 μg/mL)的LB固体培养基中筛选阳性菌落。挑取单菌落于4.5 mL含有相同浓度氨苄的LB液体培养基中培养约12 h,利用质粒提取试剂盒提取质粒,并用BamH I、EcoR I对重组质粒进行酶切鉴定,鉴定正确的质粒送至北京睿博兴科生物技术有限公司测序,并将其命名为pVL1393-OviIFN-α。
1.2.3 重组杆状病毒的构建及在家蚕中的表达 将转移载体pVL1393-OviIFN-α与失活拯救型穿梭质粒reBmBac利用脂质体介导的转染法共转染家蚕BmN细胞,于27℃培养箱培养约5.5 d,待大量细胞病变后收取细胞培养液,即重组病毒,置于4℃保存,经毒株纯化实验后,保存为毒种。将重组病毒液按照105PFU /头注射5龄起蚕,同时设置亲本病毒感染的家蚕作为对照,待达到家蚕预期的表达高峰时收取表达产物。利用试剂盒提取蚕血淋巴中的基因组DNA,设计引物对病毒基因组DNA中OviIFN-α部分片段进行PCR鉴定。上游引物 5′-CTGCGACTTGCCACACAACCAC-3′;下游引物5′-TTACGGTGAAGCCAAATCGCCG-3′,预期扩增出片段大小为520 bp。
1.2.4 重组羊干扰素α的抗病毒活性检测 将表达样品用PBS稀释10倍后进行超声破碎,12 000 r/min离心10 min,取上清液用0.22 μm的滤膜过滤,在BHK细胞中利用微量细胞病变抑制法检测干扰素对VSV病毒复制的抑制作用,具体操作步骤参考文献[19]中的方法。根据VSV*GFP在495 nm处有吸收峰的特点,在显微镜中对各组荧光情况进行观察并统计,利用Reed-Muench法计算干扰素的抗病毒活性。
1.2.5 PPRV病毒滴度测定 将BHK细胞以104cell/孔铺于96孔板中,置于37℃、5% CO2培养箱培养24 h,将PPRV疫苗株从10-1进行10倍倍比稀释至10-10,每孔100 μL加到上述96孔板中,同时设置空白细胞对照组,每天通过光学显微镜观察细胞状态,利用Reed-Muench法计算PPRV病毒的TCID50。
1.2.6 干扰素抑制PPRV增殖活性检测 将表达样品以适当倍数稀释后以上述1.2.4中的方法在BHK细胞中孵育24 h,弃掉上清液,加入100 TCID50的PPRV 疫苗株病毒,于37℃、5% CO2培养箱中培养约36 h,观察细胞状态,待病毒对照组全部发病时开始记录,通过Reed-Muench法计算羊α干扰素半数抑制PPRV所需的单位数。
2 结果
2.1 OviIFN-α基因的优化合成与重组表达载体的构建
将查找的羊α干扰素氨基酸序列进行序列比对发现,序列号为CAA41790.1及CAA41791.1的氨基酸序列与其它亚型一致性较高。对其进行信号肽预测及跨膜区分析显示,其1-23位为信号肽,无跨膜区。我们选择登录号为CAA41790.1的信号肽,其余序列选择登录号为CAA41791.1的氨基酸序列。羊α干扰素由195个氨基酸组成,根据家蚕密码子偏好性对相应基因序列进行优化,去除原始序列中高GC含量区,使得GC含量达到49.92%。CAI值为0.94,表明该基因序列的密码子使用情况较为理想,优化后的基因序列包含588个碱基。将合成的OviIFN-α经过BamH I、EcoR I双酶切后连接在转移载体pVL1393上,经转化、挑斑筛选出阳性菌落,提质粒进行酶切鉴定,鉴定结果如图1所示,在580 bp及大于9 600 bp附近分别出现清晰条带,与预期结果一致。将其送至北京睿博兴科生物技术有限公司测序,测序结果与目的序列相符,表明成功构建pVL1393-OviIFN-α转移载体。

图1 重组质粒的酶切鉴定Fig. 1 Enzyme digestion identification of recombinant plasmid
2.2 家蚕中重组杆状病毒的PCR鉴定
为了确定目的基因是否成功重组到杆状病毒基因组中,并能在家蚕中复制,将羊α干扰素处理组及对照组家蚕的表达产物提取病毒基因组DNA,并设计引物进行PCR扩增,结果如图2所示,以OviIFN-α样品基因组DNA为模板时,PCR扩增出与预期大小一致的清晰条带,而对照中则没有条带出现,表明目的基因成功重组到杆状病毒基因组中。

图2 重组病毒感染家蚕后蚕血淋巴中目的基因的PCR鉴定Fig.2 PCR identification of the target gene in the hemolymph of the silkworm infected with the recombinant virus
2.3 羊α干扰素抗病毒活性检测
采用微量细胞病变抑制法对羊α干扰素抑制VSV病毒活性进行检测,当100 TCID50单位的VSV病毒感染细胞后,在荧光显微镜下可以观察到绿色荧光(图3-C),加入少量干扰素时可部分抑制病毒感染,显微镜中会出现少量荧光(图3-B),而当干扰素浓度较高时能完全抑制病毒复制,则不会有荧光出现(图3-A),空白细胞对照组同样不会出现荧光(图3-D)。我们从病毒对照组8个复孔全部发病时开始记录,其结果如表1所示,当蚕血样品稀释1.0×104倍时能够完全抑制VSV*GFP病毒感染,无荧光蛋白产生;稀释4.0×104倍时不能完全抑制病毒感染,部分产生荧光蛋白,稀释3.2×105倍时已不能抑制病毒感染,复孔中都有大量荧光蛋白产生,经统计后其荧光产生情况如表1所示,利用Reed-Muench法对其抗病毒效价进行计算。通过多次实验得出重组羊α干扰素的表达量为6.5×105U/mL左右。

表1 重组羊α干扰素在BHK细胞中抑制VSV*GFP病毒活性检测Table 1 Recombinant goat interferon alpha inhibits VSV*GFP virus activity in BHK cells
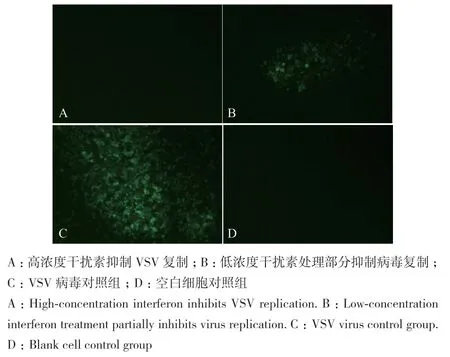
图3 不同浓度干扰素处理组后BHK细胞感染VSV增殖情况Fig. 3 Proliferation of BHK cells infected with VSV after treatment with different concentrations of interferon
2.4 PPRV病毒滴度测定
PPRV感染BHK细胞36 h时,出现明显的细胞病变效应(cytopathic effect,CPE),细胞收缩,形态发生改变,并出现聚集现象,形成合胞体。观察各孔细胞病变情况并记录,结果如表2所示,利用Reed-Muench法计算其TCID50,为每1 mL 106TCID50。
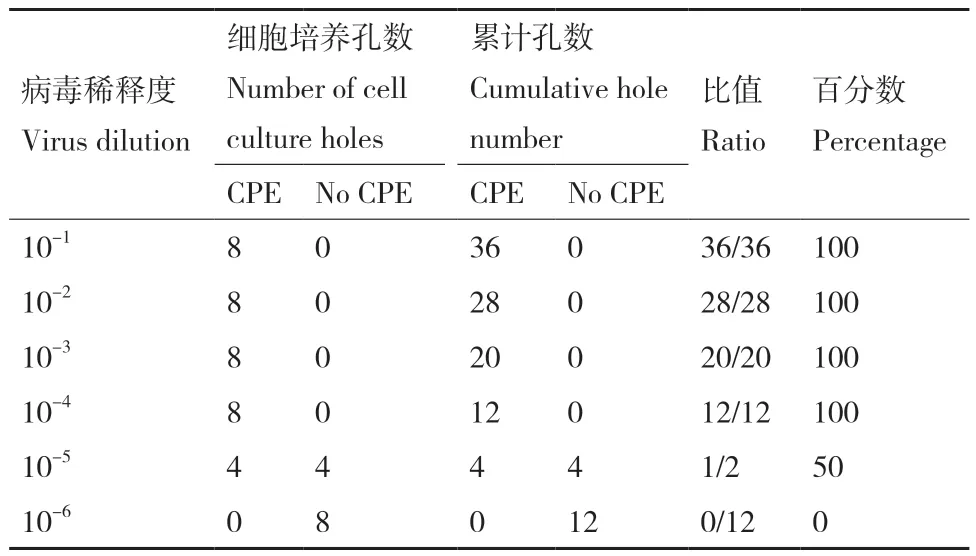
表2 PPRV的TCID50测定结果Table 2 TCID50 measurement results of PPRV
2.5 羊α干扰素抑制PPRV增值效果测定
将不同浓度的羊α干扰素用于抑制PPRV病毒在BHK细胞中的复制,抑制情况分为以下4种:PPRV感染BHK细胞病毒后,出现明显的合胞体(图4-A);当加入干扰素能完全抑制PPRV增殖,细胞不发生病变(图4-B);当干扰素能部分抑制PPRV复制时,细胞出现少量合胞体;空白细胞对照组则不会发生病变(图4-C)。以病毒组复孔半数发生病变为起点开始观察,以病毒组复孔全部发生病变为统计终点,记录合胞体出现情况,利用Reed-Muench法对羊α干扰素抑制PPRV病毒效价进行计算。结果显示,干扰素对PPRV复制的半抑制浓度IC50为 136.93 U。

图4 羊α干扰素抑制BHK细胞感染PPRV增殖效果图Fig. 4 Effects of OviIFNα on inhibiting the proliferation of BHK cells infected with PPRV
3 讨论
家蚕杆状病毒表达系统是目前广泛应用于表达外源蛋白的真核表达系统,本研究利用本实验室构建的家蚕杆状病毒表达系统[20]表达羊α干扰素。该系统将家蚕杆状病毒BmNPV进行基因修饰,并缺失其复制所必须的ORF1629基因,构建相应的失活拯救型穿梭载体pVL1393,使得共转染时只有外源基因插入的杆状病毒才能进行复制,该策略使重组效率理论上提高到100%,为羊α干扰素的高效表达奠定了基础。另外,相对于原核表达系统来说,家蚕杆状病毒表达系统作为真核表达系统,具有乙酰化、糖基化等翻译后修饰功能,产物结构与天然蛋白相似,有利于生产具有更高比活的羊α干扰素。本研究利用家蚕杆状病毒表达系统表达的羊α干扰素,在BHK-VSV*GFP系统中检测到其表达量可达6.5×105U/mL。由于本实验室在之前的猪、鸡、犬等干扰素的活性检测实验中发现,家蚕幼虫或蚕蛹的蛋白,正常杆状病毒及其表达产物在细胞病变抑制法中都无抗病毒活性[20-21],因此在检测干扰素抗病毒活性时,没有设置正常蚕血组作为对照。此外,由于羊α干扰素具有很强的种属特异性,该抑制实验应当在相应羊来源细胞系进行,但由于成熟的羊来源的细胞系较为稀少,故先选择鼠源细胞(BHK)进行抑制实验,因此,该干扰素在羊来源细胞中对病毒复制的抑制效果仍需进一步确认。
信号肽在外源蛋白的分泌时发挥重要作用,它能引导新生肽段穿越真核生物的内质网膜,避免产物大量聚集在细胞中,影响细胞活性。因此,在家蚕杆状病毒表达系统中表达羊α干扰素时需要保留信号肽序列。但不同的信号肽序列有不同的分泌和切割能力,通过查找GenBank中羊α干扰素不同亚型的信号肽序列,根据信号肽剪切位点得分及S值变化趋势,筛选出分泌效率高的信号肽序列登录号为(CAA41790.1)用于本次表达实验。
I型干扰素是机体固有免疫应答中一类重要的细胞因子,具有广谱的抗病毒及抗肿瘤等作用[22]。干扰素α属于I型干扰素中重要的一种,它既能抑制病毒复制,又能调节宿主免疫功能,其对各种类型细胞的功能都有广泛的影响。研究表明,病毒感染早期给予外源性IFN-α,可以激活干扰素诱导的抗病毒状态,并使NK细胞表达穿孔素和颗粒酶A,从而增加宿主抗病毒的能力[23]。因此,本实验选择α干扰素进行抗病毒活性研究,表达具有高效、广谱抗病毒活性的羊α干扰素。
多年来,小反刍兽疫疫情不断在国内及周边国家出现,对全球的羊养殖业造成了极大的威胁,减毒活疫苗是目前市场上常用的方法,但其具有安全性低,不能区分自然感染动物与免疫动物等缺点,为小反刍兽疫疫情的防控带来了很大的困难,而干扰素具有毒副作用小、抗原性弱,可反复使用等优点,对病毒性感染引起的疫情防控具有积极地作用。近年来,干扰素已经被广泛用于多种动物的抗病毒作用研究,并取得了一定的进展,目前市场上商品化的猪、犬、鸡等重组干扰素产品已应用于实践。本实验将羊α干扰素用于抑制小反刍兽疫病毒增殖研究,结果显示仅需136.93 U就可以对PPRV 病毒的复制产生明显的抑制作用,该结果有望为小反刍兽疫疫情防控提供新的方法。
4 结论
本研究利用家蚕杆状病毒表达系统表达了羊α干扰素,经BHK-VSV*GFP系统检测到该干扰素具有较强的抗病毒活性,为大量生产廉价且高效的羊α干扰素提供了一种新的方法。另外,该干扰素在对PPRV病毒的抑制实验中显示出较强的抗病毒作用,为干扰素用于PPRV疫情的防控提供了理论基础。

