单分子荧光检测技术的发展及其在植物生物学研究中的应用
张原 张雪萍 张月倩 李晓娟
(北京林业大学生物科学与技术学院 林木育种国家工程实验室 北京林业大学林木分子设计育种高精尖创新中心,北京 100083)
在生命活动过程中,细胞内各种分子进行着复杂和高度动态的化学反应和相互作用,以维持细胞内环境的稳态与平衡。因此,在单分子水平上对生物分子的生理特性和动力学特征进行分析,有助于深入研究分子之间和分子内的精准调控机制[1-2]。目前,广泛应用于生物学研究的单分子检测技术主要分为两大类:一是非基于力学的方法,包括荧光检测和电子显微成像;二是基于力学的方法,包括光学镊子,原子力显微镜等[3-4]。单分子荧光检测技术(single-molecule fluorescence detection)通过对被荧光标记的单个分子的进行成像追踪和检测,在纳米级的空间尺度和纳秒级的时间尺度上对分子的动态行为进行分析。与传统的生化与分子生物学或者遗传学检测方法相比,单分子荧光检测不仅可以检测到集群平均方法无法检测的分子信息,还可以检测瞬时活动或者偶发性的事件。随着科技的不断发展,单分子检测技术已经取得了很大的进展,成为极具价值的生物学研究方法。
单分子荧光检测技术可以在不改变样本生理状态的条件下对目的分子进行观察和分析,因此可以用于研究活细胞内的生命过程。该类技术还具有以下优势:首先,具有对单个分子进行实时连续追踪的能力,通过持续监测单个分子的运动状态,能够获得分子在活体内的运动轨迹和动力学信息。其次,多种不同的成像/检测技术可以相互结合,提升时间和空间分辨率[5]。本文着重对基于荧光检测的单分子成像技术和光谱分析方法的原理以及近期的技术发展进行了总结,介绍了单分子检测技术在植物学中的应用,并且展望了其促进植物学研究的前景。
1 单分子成像技术
在单分子检测技术的发展中,基于荧光标签的光学成像技术为在单分子尺度上成像并追踪特定靶标奠定了基础。由于其可进行高灵敏性和高特异性的活体分子成像,目前已经被广泛的应用于细胞生物学的研究。
1.1 全内反射荧光显微术
全内反射荧光显微术(total internal reflection fluorescence microscopy,TIRFM)是近年来单分子研究的常用技术之一。当入射光从一个高折射率介质(盖玻片)进入低折射率介质(溶液)时,在入射角大于临界角的条件下,入射光将在玻片-溶液界面发生全内反射。在全内反射条件下产生的倏逝波可以激发界面附近250 nm薄层范围内的荧光分子[6]。相较于传统荧光显微镜,TIRFM仅激发样品中靠近界面的一薄层区域,使来自于失焦平面的背景荧光减小,图像分辨率和信噪比(signal-noise ratio,SNR)均获得了明显的提升。同时,样品上的总照明量减少,减小了对样品的光损伤。因此,TIRFM多被用于研究活细胞表面和近膜区域的单分子行为[7]。
在20世纪80年代早期,TIRFM首次被应用于细胞生物学研究,Axelrod[8]应用该技术实现了对大鼠原代肌管细胞质膜和近膜胞质区域的成像。1995年,Funatsu等[9]使用TIRFM直接观察了水溶液中被荧光标记的单个肌球蛋白分子,并检测到单个ATP的转换反应。随着新兴照明设备和超灵敏探测器的出现,TIRFM技术也得到了充分的发展,并被广泛应用于动物细胞质膜蛋白研究[10-11]。但是,由于植物细胞在细胞膜外侧环绕着细胞壁,其对入射激发光全内反射位置的影响,使得TIRFM在植物细胞中的研究受到了限制。可变角度全内反射荧光显微术(variable angle-TIRFM,VA-TIRFM)的开发,有效的解决了这一难题。VA-TIRFM通过调节激发光的入射角度,使其穿过细胞壁在细胞膜/胞质界面发生全内反射,从而激发完整植物细胞质膜及近膜区域的荧光分子[12]。
随着技术的不断发展,依赖于多角度扫描和自动校准的TIRFM技术被用于提升z轴分辨率。该方法通过大范围小增量地调整入射角度并自动校准,能够更精准的确定入射角度,减少激发光的散射,使TIRFM可以对复杂表面的样品进行研究,同时获得较高的z轴分辨率,有利于对荧光信号进行定量分析[13]。另外,一种超临界照明显微光度定位(supercritical illumination microscopy photometric z-localization with enhanced resolution,SIMPLER)的方法也被用来对单个分子发射光的强度进行测量,解码基于单分子定位显微术(single-molecule localization microscopy,SMLM) 的 TIRFM成 像(TIRFM-SMLM)中分子的z轴位置。VA-TIRFM应用多角度连续测量以确定分子z轴信息,而SIMPLER可以直接利用TIRFM-SMLM产生的2D数据编码分子的z轴信息,同时兼容SMLM所需的快速单分子闪烁。这项技术在约250 nm的成像深度下,以10-20 nm的z轴定位精度获得高时空分辨率下的单分子3D信息[14]。经典TIRFM进行活体实时成像时,其检测视野受限于高数值孔径的检测物镜。最近,基于波导的TIRFM成像系统被应用于活细胞实时成像,该系统可以提供更大的检测视野和更均匀的照明,为快速移动分子的大视野检测奠定了基础[15-16]。
1.2 超分辨显微成像
近年来,随着生物化学和生物物理技术的不断改进,光学成像的分辨率打破了光学衍射的极限。光学衍射极限即发光分子经过显微镜光学系统后,其分子间的分辨率极限为:
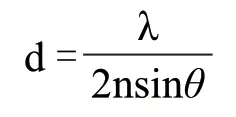
该函数即为显微镜的点扩散函数(point spread function,PSF),其中,λ是光的波长,n是折射率,θ是聚焦光锥的半角。可见光波长最短的为蓝紫光,波长约400 nm,因此普通光学显微镜分辨率极限为200 nm。超分辨率显微技术(super-resolution microscopy,SRM),例如,光激活定位显微技术(photoactivated localization microscopy,PALM)、结构光照明显微技术(structure illumination microscopy,SIM)、受激发射光猝灭技术(stimulated emission depletion microscopy,STED)和随机光重建显微技术(stochastic optical reconstruction microscopy,STORM)等,突破了光学衍射极限,为活细胞中开展高时空分辨率的研究提供了有力的支撑[17]。
这些显微技术中,PALM和STORM通过对随机“开-关”的荧光分子进行单分子定位,并将多个精确定位的图像叠加,来大幅度提高图像分辨率[18]。其使用光激活/转换荧光染料,一次只能激活/转换视野下的几个荧光分子,随后在高强度激光下将已激活分子全部淬灭,多次重复后即可获得细胞内全部荧光分子的精确位置,实现对荧光标记分子稀疏化,在不改变荧光点PSF的情况下,识别光斑的中心定位,提升荧光分子的空间分辨率[19-20]。最近,在单分子定位的基础上发展起来的DNA点积累定位(DNA points accumulation for imaging in nanoscale topography,DNA-PAINT)技术,以荧光标记核苷酸,通过DNA杂交技术实现了对多个目标位点的超分辨可视化研究[21]。此外,基于干涉定位成像的ROSE(repetitive optical selective exposure)单分子干涉定位显微镜,推动显微镜的分辨率提升到3 nm以内的分子尺度,并解析了间隔5 nm的分子结构[22]。但不论是PALM还是STORM,其成像过程均需要反复激活-淬灭荧光分子,极易产生光漂白和光毒性,对活细胞的生理状态产生影响。
STED和SIM是通过设计照明模式,通过有效减小PSF的大小来实现超分辨率成像。STED利用一束与激发光共轴,且波长与荧光分子发射波长匹配的环形损耗光,使得处于激发光斑外围的激发态分子以受激辐射的方式释放能量回到基态,因此能够大幅度减小激发光光斑大小,实现超分辨率成像[23]。SIM技术利用摩尔条纹把原本不能通过荧光采集系统的高频信息平移到可观察的频率范围内来实现超分辨。与其他几个超分辨技术相比,SIM所需的原始图像较少且成像速度快,而且对激发光功率的要求也不高,所以对样品的光漂白和光损伤程度较小,在活体成像方面具有较大的优势[24]。2018年,具有高时空分辨率的掠入射-结构光照明显微成像技术(grazing incidence structured illumination microscopy,GI-SIM)和海森结构光照明显微成像技术(Hessian structured illumination microscopy,Hi-SIM)的开发,很大程度减弱了活细胞成像的光损伤,实现了对生物分子的快速、长时程成像[25-26]。
尽管超分辨率显微技术具有优异的空间分辨率优势,但仍具有通量低、成像时间长和成像窗口小等局限性。因此,多技术的联用成为新的发展趋势。在强化每一种技术优势的基础上,弱化各自的缺点,从而提供更多的生物系统结构信息。SRM技术与其他光学显微镜的联合使用是最易实现的应用之一,例如SIM与TIRFM的结合,在高分辨的基础上进一步提升了近膜区域单分子检测的分辨率,同时大幅度减轻了SIM检测的光漂白[27]。此外,SRM的分辨率(<200 nm的空间分辨率)与电子显微镜(electron microscope,EM)的分辨率水平更为匹配,因此SRM-EM联用可以进行更精细的联合分析,获得细胞超微结构细节[28-30]。
1.3 单颗粒示踪技术
单颗粒示踪技术(single particle tracking,SPT)与单分子荧光成像结合,极大地促进了对细胞内分子的物理性质、膜动力学、亚细胞分布和细胞内运输等各种动态过程的深入研究[31-32]。SPT的应用始于20世纪80年代,Geerts等[33]使用金纳米颗粒标记生物分子,随后利用显微镜成像并追踪每一个被标记分子的运动轨迹。通过追踪附着于单个粒子上的成像标签,并且以连续时间序列的方式记录其运动以生成轨迹,揭示了分子的运动特征[34]。由于群体分子在生命活动中常表现出异质性行为,因此,需要检测轨迹足够长,才可以获得单分子动态行为规律[35]。当运动轨迹较短时,基于单个轨迹对其运动状态进行分析将导致严重的误差[36],所以足够的时间长度及较高的时间分辨率是SPT精确分析的基础。此外,要实现对单个分子进行长时间追踪,需要荧光成像具有较高信噪比。因此,用于SPT分析的荧光标签需要有明亮、稳定的光谱性质以及适当的标记密度,以便对单个蛋白在合适的时间范围内进行有效的追踪。同时,也要求荧光标签的尺寸和分子量较小,以减小或避免标签对生物分子功能和扩散性质的影响[34,37]。
近年来,标记和成像技术的发展促进了SPT的应用。例如,超时间分辨显微镜(super temporalresolved microscopy,STReM)极大提高了SPT分析的时间分辨率。STReM采用旋转双螺旋相掩模(rotating double helix phase mask,DHPM)以可控角度旋转,将得到的双螺旋PSF方向进行拟合,编码为样品的时间信息,获得了高于传统显微镜20倍的时间分辨率[38]。此外,PALM、STORM等SRM技术与SPT的结合,打破了分子标记密度和衍射极限的局限性[39-40]。值得注意的是,使用传统的成像技术(荧光显微镜,TIRFM等)分析分子运动时,获得的xy-二维(2D)图像假定成像区域是完全平坦的,从而只对物镜焦平面上的分子的侧向位移进行2D-SPT分析,所以会对分子扩散系数的分析产生影响造成误差[41]。为解决这一问题,基于多焦平面显微镜[42]和PSF工程[43]的高分辨率3D成像技术,扩展了单分子检测的z轴范围,从而可以在xyz-3D空间尺度对分子的动态特征进行3D-SPT分析,促进了对厚细胞和组织中生物分子的研究[44-45](图1)。
2 光谱学检测方法
光谱学检测是通过检测荧光信号光谱的变化,来实现对活细胞内的分子动态进行分析的方法和技术。在过去的研究中,诸如荧光漂白后恢复 技 术(fluorescence recovery after photobleaching,FRAP)、荧光相关光谱技术(fluorescence correlation spectroscopy,FCS)、荧光共振能量转移技术(fluorescence resonance energy transfer,FRET)等光谱学检测技术极大促进了细胞生物学的研究。近年来,与超高分辨率显微技术的结合,进一步提高了其空间分辨率。
2.1 荧光漂白后恢复技术
荧光漂白后恢复技术(fluorescence recovery after photobleaching,FRAP)是20世纪70年代发展起来的一项技术。FRAP可以用于研究活细胞内分子间的相互作用,揭示分子在活细胞内的迁移方向、速度以及扩散系数等动力学特征,进而揭示生物分子的功能与作用机制。该技术的工作原理是将激光聚焦于样品中的感兴趣区域(region of interest,ROI),测定ROI的初始荧光后,以高功率激发光进行漂白,随后监测漂白区域内的荧光强度随时间推移的变化情况,从而获得分子的运动信息[35]。FRAP在细胞组分的互作[47]、细胞骨架动态[48]、囊泡转运[49]、染色体结构[50]等方面的研究中广泛应用。
FRAP技术不断发展以适应不同的研究策略,例如反向荧光漂白恢复技术(inverse fluorescence recovery after photobleaching,iFRAP)[51]、 荧 光 漂白中损失技术(fluorescence loss in photobleaching,FLIP)[52-53]、光激活后的荧光损失技术(fluorescence loss after photoactivation,FLAC)[54]、线性荧光漂白恢复技术(Line FRAP)[55]等基于FRAP的延伸应用越来越广泛。iFRAP利用了光激活荧光蛋白的光谱性质[56],首先激活ROI中的荧光分子,随后对已激活的荧光分子的动态行为进行实时成像观察。由于该方法只能检测并追踪ROI内的已光活化分子,因此有效的规避了ROI周围或细胞内部荧光分子运动的影响,比传统FRAP更能够精确的测定生物分子动力学[50]。FLIP通过对某一固定ROI进行连续的光漂白,并监测整个样品的荧光波动信号,揭示了分子在核与胞质中的动态穿梭过程。此外,若将样品中单个细胞进行连续漂白,即可获得样品中细胞间的分子交换情况,同时也有利于获得样品中固定分子的分布信息[52]。Line FRAP可以大幅度缩小漂白区域,从而更快的对局部区域中分子扩散系数和分子移动进行测量[55]。FRAP与SRM结合的smFRAP技术通过将光漂白区域面积缩小至衍射极限之内,在单分子水平上以高分辨率实时检测分子的动态变化,获得活体样品中分子的扩散系数及迁移速率等信息[57-58]。
2.2 荧光相关光谱技术
荧光相关光谱技术(fluorescence correlation spectroscopy,FCS)通过检测样品中激发焦点处的荧光波动,分析荧光分子数量的变化以及分子扩散情况。FCS首次提出是用于对溶液中荧光标记物(溴化乙锭)与DNA分子的结合进行检测[59]。随着激光共聚焦显微镜的诞生,FCS实现了对活细胞内分子动力学的监测[60]。FCS的荧光采集范围较小,可达10-15L,可用于对微小区域进行检测。然而,在FCS检测过程中高激发光经常导致光漂白,高浓度的荧光分子也可能导致检测出现较大误差。可光激活荧光蛋白与FCS的联合,有效的克服了这些问题[61-62]。
对活体样本的研究过程中,FCS快速发展,出现了荧光互相关光谱技术(fluorescence cross-correlation spectroscopy,FCCS)[63]、扫描 单 分 子 FCS(scanning single-molecule fluorescence correlation spectroscopy,scanning smFCS)[64]、扫描受激发射损耗 -荧光相关光谱(scanning STED-FCS)、基于对相关函数的FCS[65]等延伸技术,扩展了FCS的检测能力。FCCS利用双通道检测不同颜色荧光团标记的两种分子,通过对两种荧光分子进行相关性分析实现对分子相互作用的定量分析[66-67]。然而,FCCS在活体生物中的应用也会受到自发荧光导致的非相关荧光串扰的影响。1980年,Thompson等[68]提出了全内反射荧光相关光谱技术(TIRFM-FCS)。与基于Confocal的FCS相比,TIRFM-FCS对样品表面约250 nm薄层区域内分子的动态行为进行定量分析,避免了远离焦平面的荧光团的激发,规避了样品内部自发荧光的干扰,从而提高了检测信噪比。随后,物镜型TIRFM-FCS被提出用于提升传统TIRFM-FCS的信号采集效率[69]。最近,SRM技术的出现使FCS获得了前所未有的空间分辨率,例如扫描受激发射损耗-荧光相关光谱(scanning STED-FCS)在较小的检测体积内,可以实现约60 nm的空间分辨率,并利用线或环扫描在几微米的扫描轨迹上快速记录FCS数据,实现亚毫秒级的时间分辨率[70-72]。
2.3 荧光共振能量转移技术
荧光共振能量转移技术(fluorescence resonance energy transfer,FRET)利用基于分子间相互作用的能量转移。依赖于荧光供体发射光与荧光受体激发光的光谱重叠,当处于激发状态的供体靠近受体时,供体的能量可以转移到受体,并导致受体被激发。FRET能量转移效率与供体-受体二者之间的距离高度相关[73-74],因此FRET可被用于测定相互作用分子间的距离。
单分子FRET(single-molecule FRET,smFRET)是FRET的一种技术延伸。smFRET通过检测单个供体和受体FRET对之间荧光波动,计算单个FRET对的能量转移效率以及荧光强度波动,以高灵敏性检测低丰度生物分子,当以荧光染料作为供体和受体时,smFRET可以以高敏感度检测分子的相互作用强度[75]。通过能量转移效率从供体和受体的荧光强度计算来推断分子之间的距离,从而smFRET可以用于研究单个生物分子在体内/体外的功能[73,76]、动态变化[77-78]以及构象改变[79],使得亚纳米尺度的分子相互作用研究成为可能。FRET信号检测灵敏度的提高以及分子标记密度的优化对于smFRET的应用至关重要,为了有效的检测smFRET的信号,TIRFM被应用于smFRET成像以使背景噪音最小化提高检测效率[80]。同时,可光激活有机染料(如CAGE 552和ZMWs)作为供体引入检测样品,可以克服分子标记密度的限制,使其更好的应用于生理条件下的活体检测[81-82]。此外,smFRET检测中荧光分子的淬灭会导致时间分辨率下降。最近研究人员将FRET与DNA-PAINT[83]联合应用,开发了FRET-PAINT技术,在DNA-PAINT技术抗光漂白特性的基础上,大幅度地提高了分子的成像速度,实现了高时空分辨率的smFRET检测[84]。
3 单分子检测技术在植物学中的应用
近几十年来,单分子技术的应用提高了监测细胞中分子异质性和偶发性行为的能力,改变了我们对复杂生命过程的理解。在早期的研究中,植物细胞因具有细胞壁或较强的自发荧光,导致SMD技术应用于植物研究的难度较大。随着成像与分析技术的不断发展成熟[85-86],SMD技术也逐渐在植物单分子研究中的到了应用。Li等[87]应用VA-TIRFM在单分子水平上追踪拟南芥水通道蛋白(plasma membrane intrinsic proteins,PIPs) 的 动 态, 发 现PIP2;1在细胞膜上存在不同的寡聚化状态,揭示了其在质膜上的分布和侧向扩散具有高度异质性,并通过亚细胞循环响应盐胁迫的动态性质。在此基础上,采用VA-TIRFM对PIP2;1在气孔保卫细胞内的动态进行观察发现,在细菌鞭毛蛋白(bacterial flagellin-derived peptide flg22)处理条件下,PIP2;1的动态行为不仅具有细胞类型特异性,还受到细胞骨架的调控,揭示了植物膜蛋白响应病原体胁迫的动态调控机制[88]。另外,单分子追踪PALM(sptPALM)进一步在20-80 nm的空间分辨率条件下,追踪和分析了PIP2;1在膜上的单分子动态异质性[89-90]。近期,VA-TIRFM与SIM结合检测膜筏相关蛋白(flotillin 1,Flot1)的动态特征与内吞发现,在病原体胁迫下,Flot1在膜上的运动状态与寡聚化状态改变,这一过程介导了Flot1的内吞,从而影响植物的防御响应[91]。
除了用于研究植物膜蛋白对胁迫信号的响应外,SMD技术还被用于植物激素信号的转导过程的研究。在油菜素内酯(brassinosteroids,BR)刺激后,应用FCS定量分析发现BR受体蛋白(brassinosteroidinsensitive 1,BRI1)的扩散系数显著升高,表明BRI1被BR激活,扩散加快,从而实现BR信号转导[92]。2019年,Song等[93]利用多色 TIRFM 对 BR信号通路下游元件BIN2(brassinosteroid-insensitive 2)与转录因子BES1(BRI1-EMS suppressor 1)的相互作用进行实时动态监测和单分子分析。研究发现活性氧(reactive oxygen species,ROS)可以激活BIN2,导致BIN2激酶组成性结合BES1,随后在ATP存在的条件下活化的BIN2磷酸化BES1,抑制BR信号向下游的传递,在单分子水平上揭示了植物在响应胁迫过程中利用ROS调控BR信号级联过程的动态机制。Clark等[94]利用Scanning FCS定量分析干细胞调控因子SHR(short-root protein)从维管细胞向内皮层细胞中的定向胞间移动,以及其在内皮层细胞中与转录因子SCR(scarecrow)相互作用的动态过程,揭示SHR-SCR调控拟南芥根系发育的分子机制。随后,利用基于荧光寿命显微成像的FRET技术(Förster resonance energy transfer measured by fluorescence lifetime microscopy,FRET-FLIM),通过检测供体荧光分子荧光寿命的衰减,分析细胞类型分化调控因子SHR、SCR和JKD(JACKDAW)间的相互作用情况。在单分子水平上,揭示了SHR、SCR和JKD可以形成不同的复杂转录因子复合体,实现相邻细胞间细胞分化的动态调控机制[95-96]。
4 总结与展望
单分子检测技术是一种强大的方法,可以揭示基于系统平均的检测方法所不能体现的异质性信息。本文综述了常用的SMD技术(图2)以及近期在植物学研究中的应用。但与动物细胞相比,其在植物细胞中的应用存在一定的局限性。新技术不断被开发与利用可以更好地克服植物细胞壁和自发荧光的限制,同时提高信噪比并获得良好的图像质量,如VA-TIRFM以及SRM等检测方法已经应用于追踪植物膜或近膜蛋白的动态特性。此外,为打破活的植物细胞中追踪单个分子的空间限制,具有高空间分辨率的光片层荧光显微镜(light sheet fluoresnence mircoscopy,LSFM)也被应用于检测植物细胞中的单分子[97],与TIRFM相比LSFM具有更大的成像深度并允许照明平面在样品中的任意位置。然而,近年来新发展的更多技术,例如基于光激活荧光团的smFRET技术与TIRFM相结合,突破了TIRFM成像对荧光浓度的限制,实现了生理浓度下的单分子检测[82];以及最近利用贝叶斯照明的LSFM可以获得更佳的信噪比,都为实时检测活植物细胞中的单分子提供了全新见解[98]。伴随SRM技术的革新,LSFM-SIM在植物中的应用也具有广阔的前景[99]。同时,GI-SIM和Hi-SIM的开发与利用,实现了低激光强度对低信号荧光的快速、高分辨成像,在植物生物学研究中也具有较强的应用前景。但这些技术在植物中的应用以及根据植物的具体特性进行优化还需要深入研究。随着SMD技术的不断发展,相信未来能够更好地推动植物生物学经典科学问题得到新的阐释。
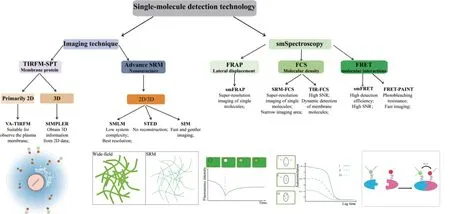
图2 不同单分子检测技术的分类及优势Fig.2 Classification and advantages of different single-molecule detection techniques

