基于单细胞超高通量筛选的α-1,2-岩藻糖基转移酶定向进化
张雪 谭玉萌 蒋海霞 杨广宇
(上海交通大学生命科学技术学院 微生物代谢国家重点实验室,上海 200240)
岩藻糖基修饰的糖复合物广泛参与细胞粘附,炎症反应,免疫应答和受精等多种生理活动[1]。多种岩藻糖基化寡糖参与癌症中的信号传导、肿瘤的发生和转移等过程[2-3],具有开发成为癌症治疗性疫苗的潜力,如Globo H-KLH疫苗已应用于转移性乳腺癌的二期临床[4-5],Lewis Y抗原的结合疫苗已被证明对癌细胞具有细胞毒性,可以诱导免疫反应[6]。2′-岩藻糖基乳糖是母乳中的一类特殊益生元,占人乳寡糖成分的30%左右[7],具有促进婴儿的大脑发育、免疫调节、炎症抑制及抗病原微生物感染等作用[8-12]。2′-岩藻糖基乳糖已被美国食品药品管理局(FDA)批准为安全通用食品(GRAS),并被欧洲食品安全局(EFSA)批准为新型食品(NF)[13],可以作为婴儿配方奶粉中添加的食品成分、膳食补充剂和医药成分。2016年开始,雅培和雀巢分别将含有2′-岩藻糖基乳糖成分的人乳寡糖成分引入销售的婴儿配方奶粉中。
α-1,2-岩藻糖基转移酶是催化合成2′-岩藻糖基乳糖的关键生物催化剂[14]。2006 年,Drouillard等[15]首次在大肠杆菌中表达了来源于幽门螺杆菌Helicobacter pylori NCTC11639 的 α-1,2-岩藻糖基转移酶FutC;2015年Chin等[16]利用FutC在大肠杆菌中对2′-岩藻糖基乳糖进行了从头合成;2017年南开大学的 Huang 等[17]对 11 种不同来源的 α-1,2-岩藻糖基转移酶基因进行了比较,结果表明FutC对2′-岩藻糖基乳糖的合成产量是最高的。然而,野生型的FutC的催化活力仍较低,限制了其在工业生产中的应用。
定向进化是一项蛋白质工程技术,通过突变及高通量筛选的循环,能够有效提升酶的功能[18-19]。然而,由于糖基转移酶催化的糖苷键形成并不直接产生荧光或吸光度的明显变化,难以进行高通量筛选,因此对于此类酶的进化是一个具有挑战性的难题。2006年Aharoni 等[20]提出一种针对糖基转移酶的FACS胞内荧光捕获策略,通过位于细胞膜上的乳糖透过酶(lactose permease,LacY)对酶催化荧光底物和产物之间的细胞膜通透性差异,实现了糖基转移酶的高效筛选(图1为应用于FutC的FACS胞内荧光捕获策略)。本实验室在此基础上引入了双荧光底物系统,有效避免了由于筛选底物导致的假阳性突变[21]。我们在前期工作中利用这一方法,获得了催化活性显著提升的糖基转移酶突变体[21-22]。在本研究中,拓展了上述筛选方法在α-1,2-岩藻糖基转移酶中的应用,利用能与α-1,2-岩藻糖基转移酶FutC反应的荧光受体底物,建立了针对FutC的FACS超高通量筛选方法,并利用定向进化成功得到了活性提高的突变体。
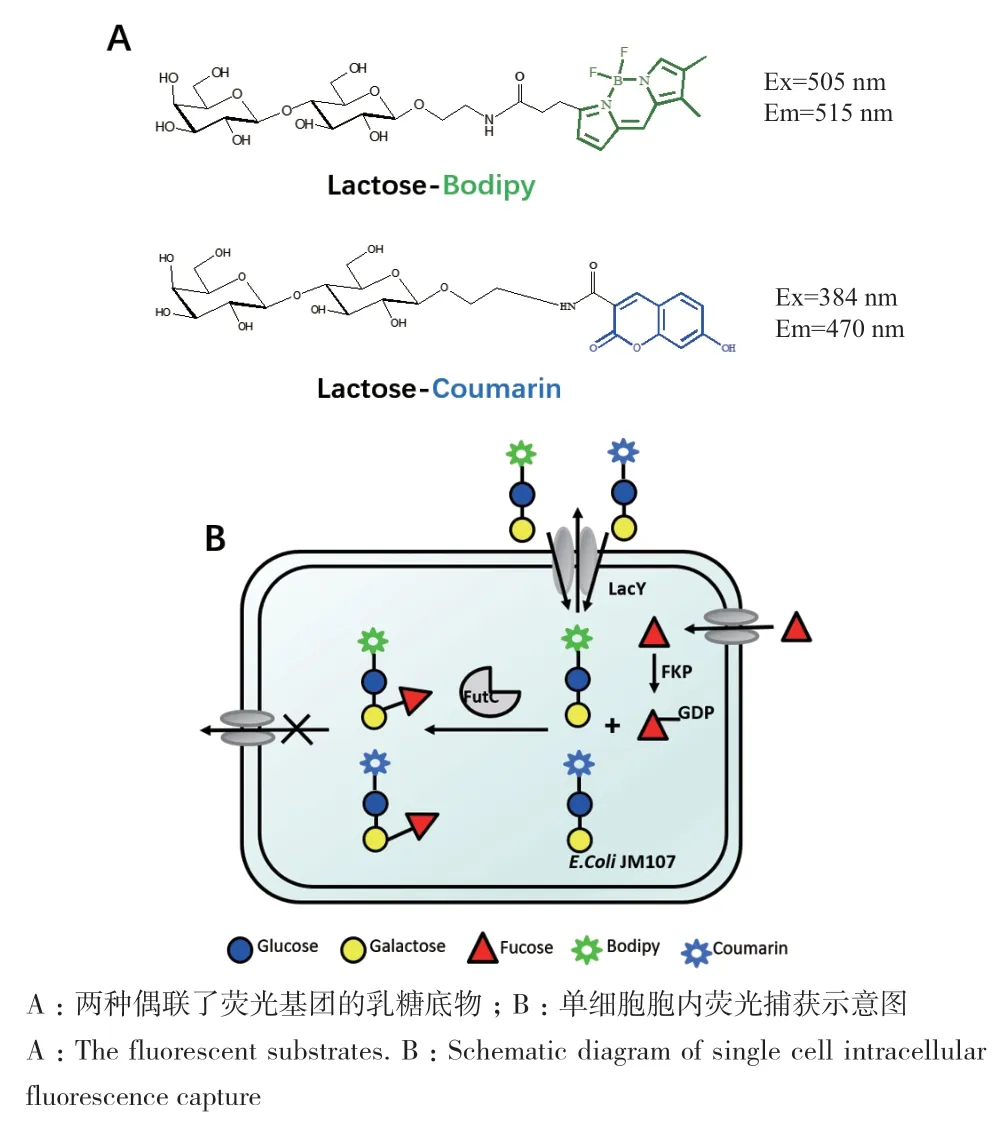
图1 荧光底物结构和FACS筛选策略示意图Fig. 1 Fluorescent substrate structure and the schematic diagram of FACS screening strategy
1 材料与方法
1.1 材料
1.1.1 菌种与质粒 E. coli JM107 Nan-LacZ-用于岩藻糖基转移酶的超高通量筛选,该菌株敲除了nanA和lacZ两个基因;E. coli 10G用于突变文库的构建,由本实验室保存。E. coli BL21(DE3)用于蛋白的表达纯化,购于北京全式金生物有限公司。质粒pUC18和pUCKC18-FKP由本实验室保存,pUC18-FutC由韩国首尔国立大学ByungGee Kim课题组赠送,质粒pET24a购自武汉淼灵生物科技有限公司。
1.1.2 主要试剂及培养基 PrimeSTAR Max Premix DNA聚合酶购于日本TaKaRa公司;DreamTaq DNA聚合酶,碱性磷酸酶及限制性内切酶购于赛默飞公司;T4 DNA连接酶购于NEB公司;Phanta Max Mix DNA 聚合酶购于南京诺唯赞生物科技股份有限公司。乳糖及岩藻糖购于Sigma公司;GDP-岩藻糖及荧光乳糖由本实验室保存;1×PBS粉末购于生工生物工程(上海)股份有限公司;乙腈等液相用品购自上海安谱实验科技股份有限公司。
LB培养基:10 g/L NaCl,10 g/L胰蛋白胨,5 g/L酵母浸粉。M9培养基:1×M9盐溶液,2 mmol/L MgSO4,4 mmol/L葡萄糖,0.1 mmol/L CaCl2。SOC培养基:0.5 g/L NaCl,20 g/L胰蛋白胨,5 g/L酵母浸粉,2.5 mmol/L KCl,10 mmol/L MgCl2,20 mmol/L 葡萄糖。2YT培养基:4 g/L NaCl,16 g/L胰蛋白胨,10 g/L酵母浸粉。
1.2 方法
1.2.1 FACS筛选方法的建立 构建筛选专用的大肠杆菌菌株,将重组质粒pUCKC18-FKP电击转化E.coli JM107 Nan-LacZ-感受态细胞,涂布氯霉素抗性LB平板。次日从平板上挑取单克隆送测序,测序正确的菌株为JM107 Nan-LacZ--pUCKC18-FKP。将JM107 Nan-LacZ--pUCKC18-FKP制备为电转化感受态,分别将质粒pUC18和pUC18-FutC电转化至JM107 Nan-LacZ--pUCKC18-FKP中,为筛选的阴性对照菌株和阳性菌株。
为了测试FutC对于两种荧光底物是否有催化活性,将FutC纯酶加入如下反应体系进行反应:反应体系为20 μL,其中含有终浓度为5 mmol/L的GDP-岩 藻 糖,0.5 mmol/L的lactose-bodipy/lactosecoumarin,25 mmol/L(pH 5.6)的 HEPES,100 μg/mL的FutC纯酶。37℃反应3 h后,按照乙酸乙酯∶甲醇∶水=7∶2∶1的比例配制展层剂,TLC检测荧光产物的生成。
将阴性对照菌株与阳性菌株在氨苄青霉素/氯霉素双抗性平板上划线活化,挑取单克隆于含有100 μg/mL氨苄青霉素和25 μg/mL氯霉素的5 mL LB液体培养基的试管中,37℃ 220 r/min生长过夜,次日按照4%的比例转接至5 mL的M9液体培养基试管中,37℃ 220 r/min培养至OD600(UV2 550测定)为0.8-1.0,加入终浓度为0.8 mmol/L的IPTG,20℃220 r/min诱导18 h,取2.4 mL菌液,4 000 r/min离心3 min,弃上清,将菌体加入如下反应体系:反应体系为50 μL,其中含有终浓度为5 mmol/L的岩藻糖,0.5 mmol/L的lactose-bodipy/lactose-coumarin,25 mmol/L的5×M9缓冲液。37℃ 220 r/min反应1 h,将未反应的荧光底物清洗至胞外。清洗流程如下:将反应体系4 000 r/min离心3 min,弃上清,加入1 mL LB培养基轻轻重悬EP管底部的菌体,4 000 r/min离心3 min,重复上步操作,将LB培养基重悬的细菌置于37℃ 220 r/min摇床清洗10 min,4 000 r/min离心3 min,弃上清,用1 mL预冷的PBS重悬菌体,重复该操作一次,最后将收集的菌体重悬于50 μL预冷的PBS溶液中,放置于冰上保存。全程操作在无菌超净台中进行。在紫外灯下和流式细胞仪上分别对阳性细胞和阴性细胞进行分析。
FutC的模式分选:将1×PBS粉末溶解于1 L超纯水中,用0.22 μm滤膜进行抽滤,121℃高压灭菌20 min,制备为分选用鞘液。根据流式细胞仪分析阴性和阳性的散点图确定双阳性最强、且不落入阴性细菌的P2门,将阳性细菌和阴性细菌分别按照1∶1、1∶10、1∶100、1∶1 000的数目比例混合,各自分选5 000个细菌,将其收集于400 μL 37℃预热的SOC培养基中,于37℃ 220 r/min摇床复苏2.5 h,涂布于抗性平板,次日从分选平板上随机挑取30个细菌进行菌落PCR验证并测序。
1.2.2 FutC随机突变库的构建 以带有野生型futC基因的pUC18-FutC质粒作为模板,通过易错PCR构建FutC随机突变库。引物设计见表1。
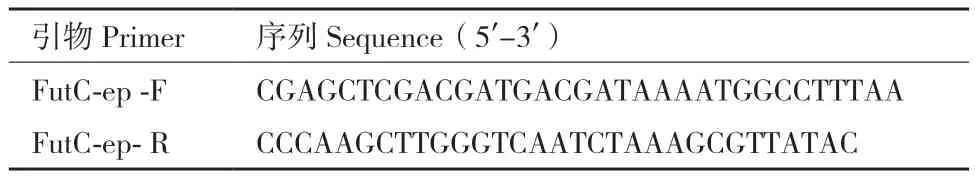
表1 随机突变库构建引物设计Table 1 Primers for random mutation library construction
PCR 体系如下:20 ng的 pUC18-FutC,0、0.4、0.6、1 μL MnCl2(10 mmol/L),2 μL Primers(20 μmol/L),10 μL dNTP(2.5 mmol/L),2 μL dCTP(10 mmol/L),2 μL dTTP(10 mmol/L),1 μL DreamTaq DNA polymerase,10 μL 10×DreamTaq buffer,用 ddH2O 补足至100 μL。PCR扩增条件为:预变性 95℃ 3 min;变性 95℃ 30 s;退火58℃ 30 s;延伸 72℃ 90 s;30个循环,之后延伸72℃ 10 min。PCR反应结束后,进行PCR产物纯化。将PCR产物和载体pUC18分别用Sac I和Hind III在37℃双酶切2 h。其中载体双酶切后用FastAP在37℃去磷酸化2 h。将PCR产物和载体pUC18分别纯化后按照如下体系16℃连接过夜:200 ng pUC18线性载体,1 200 ng插入片段FutC,2 μL 10 ×T4 DNA ligase buffer,1 μL T4 DNA ligase,ddH2O 补足至 20 μL。
将连接产物进行纯化,取1 μL连接产物电击转化E.coli 10G感受态细胞,37℃ 220 r/min复苏45 min后,用LB培养基将10 μL复苏菌液稀释1 000倍,取200 μL涂布LB抗性平板,37℃倒置培养过夜。剩余复苏菌液接于5 mL 含有100 μg/mL氨苄青霉素的LB液体培养基中,37℃ 220 r/min生长12 h,提取质粒为突变文库并保存。第2天通过平板计数计算库容量。随机从平板上挑取20个转化子,送测序,计算突变率。将最终获得的4个不同突变率的突变库按照1∶1∶1∶1的摩尔比混合,计算得到最终库容量和突变率。
1.2.3 突变文库的FACS筛选 取1 μL构建的随机突变文库质粒,电转化JM107-pUCKC18-FKP感受态细胞,复苏菌液接于5 mL 含有100 μg/mL氨苄青霉素和25 μg/mL氯霉素的LB液体培养基中,37℃220 r/min生长12 h,按照4%的比例转接至5 mL M9液体培养基中,37℃ 220 r/min培养至OD600为0.8-1.0,加入终浓度为0.8 mmol/L 的IPTG,20℃220 r/min诱导18 h。取2.4 mL菌体与荧光底物反应,反应体系及清洗流程同1.2.1。FACS筛选条件如下:1×PBS作为鞘液,使用85 μm的喷嘴,分选速度为4 000-5 000 evt/s;第一轮和第二轮分选突变体收集于400 μL SOC培养基,复苏2.5 h后于4 mL LB液体培养基中培养过夜,提取质粒,电转化进入下一轮分选;第三轮分选得到的5 000个细菌复苏后涂布抗性平板,随机挑取平板上100个突变体进入复筛。将突变体在4 mL LB液体培养基的试管中诱导表达,离心收集菌体,用200 μL 25 mmol/L(pH 5.6)的HEPES重悬,通过反复冻融后离心取上清为粗酶液,粗酶液与5 mmol/L GDP-岩藻糖和0.5 mmol/L lactose-bodipy反应20 min后,用TLC初步鉴定反应产物。对粗酶活力提高的突变体进行测序。
1.2.4 FutC野生型和突变体的表达纯化及活力测定 以pET24a-FutC作为模板,用全质粒PCR构建获得的突变体,PCR产物转化入E.coli BL21(DE3),挑取测序验证正确的转化子接入5 mL LB液体培养基,37℃ 220 r/min 过夜培养12 h,以1%的接种量将菌液转接到100 μg/mL卡那霉素的250 mL 2YT培养基的摇瓶中,37℃ 220 r/min 培养至 OD600为0.8时,加入终浓度为 0.8 mmol/L的IPTG,20℃诱导22 h,5 000 r/min收集菌体,使用高压均质仪破碎后,进行蛋白纯化,流程如下:
将破碎后的菌体4℃ 12 000 r/min离心20 min,取上清4℃ 12 000 r/min离心40 min,取上清为粗酶液。取出50 mL镍柱,将柱子中的硫酸镍溶液流干,用20 mL蒸馏水清洗2遍,20 mL Binding Buffer清洗两遍;将粗酶液过柱2遍;10 mL Binding Buffer清洗杂蛋白;10 mL Wash Buffer清洗杂蛋白;5 mL Elution Buffer(含80 mmol/L咪唑)过柱子1遍;5 mL Elution Buffer(含250 mmol/L咪唑)过柱子1遍,收集流出液即为纯化的蛋白。利用SDS-PAGE检验蛋白纯度。
活性测定:将纯化获得的野生型及突变体FutC纯酶进行反应,反应体系为20 μL,其中含有终浓度为5 mmol/L的GDP-岩藻糖,0.5 mmol/L的lactosebodipy,25 mmol/L(pH 5.6)的 HEPES,0.04 mg/mL的FutC纯酶。37℃ 反应20 min,煮沸6 min终止反应,在反应体系中加入100 μL超纯水,12 000 r/min高速离心40 min,取80 μL上清进行HPLC分析。HPLC检测条件:色谱柱为TSK-gel Amide-80(4.6 mm×250 mm,5 μm)型正相亲水色谱柱;荧光检测器(FLD):Ex= 488 nm,Em= 525 nm;流动相A:超纯水,流动相C:纯乙腈;等度洗脱条件:0-15 min 80%C;流速1 mL/min;进样量10 μL。比活力公式:R=(A+15.84)/5 665.12。R:比活力 U/mg;A:产物HPLC峰面积。
2 结果
2.1 FutC的胞内荧光富集
通过在乳糖分子上偶联两个结构和荧光颜色不同的荧光基团,针对FutC设计了lactose-bodipy和lactose-coumarin两种荧光底物(图1-A)。为了验证FutC确实可以催化这两种荧光底物的转化,将其分别与FutC纯酶反应,TLC结果如图2-A所示,FutC可以催化这两种荧光底物,生成带有荧光基团的岩藻糖基化乳糖。
E.coli JM107 Nan-LacZ-被用于作为筛选的宿主菌株(图1-B),该菌株的细胞膜上带有乳糖透过酶LacY,可以催化荧光乳糖转运到胞内,此外该菌株还敲除了β半乳糖苷酶基因LacZ,避免了乳糖在胞内的降解。另外引入了表达GDP岩藻糖合酶的质粒pUCKC18-FKP,为FutC提供糖核苷酸供体底物。使用了N端融合了3个天冬氨酸标签(D3)的futC基因,以增加FutC蛋白的可溶性表达。
对于表达了FutC和不表达FutC(pUC18空载体对照)的大肠杆菌细胞进行胞内荧光捕获实验,在紫外灯上进行分析的结果(图2-B)和流式细胞仪上对两种细胞的分析结果显示(图3),表达FutC的细胞相比于没有表达FutC的细胞具有明显增强的荧光信号,说明我们成功实现了两种荧光产物在胞内的荧光富集。
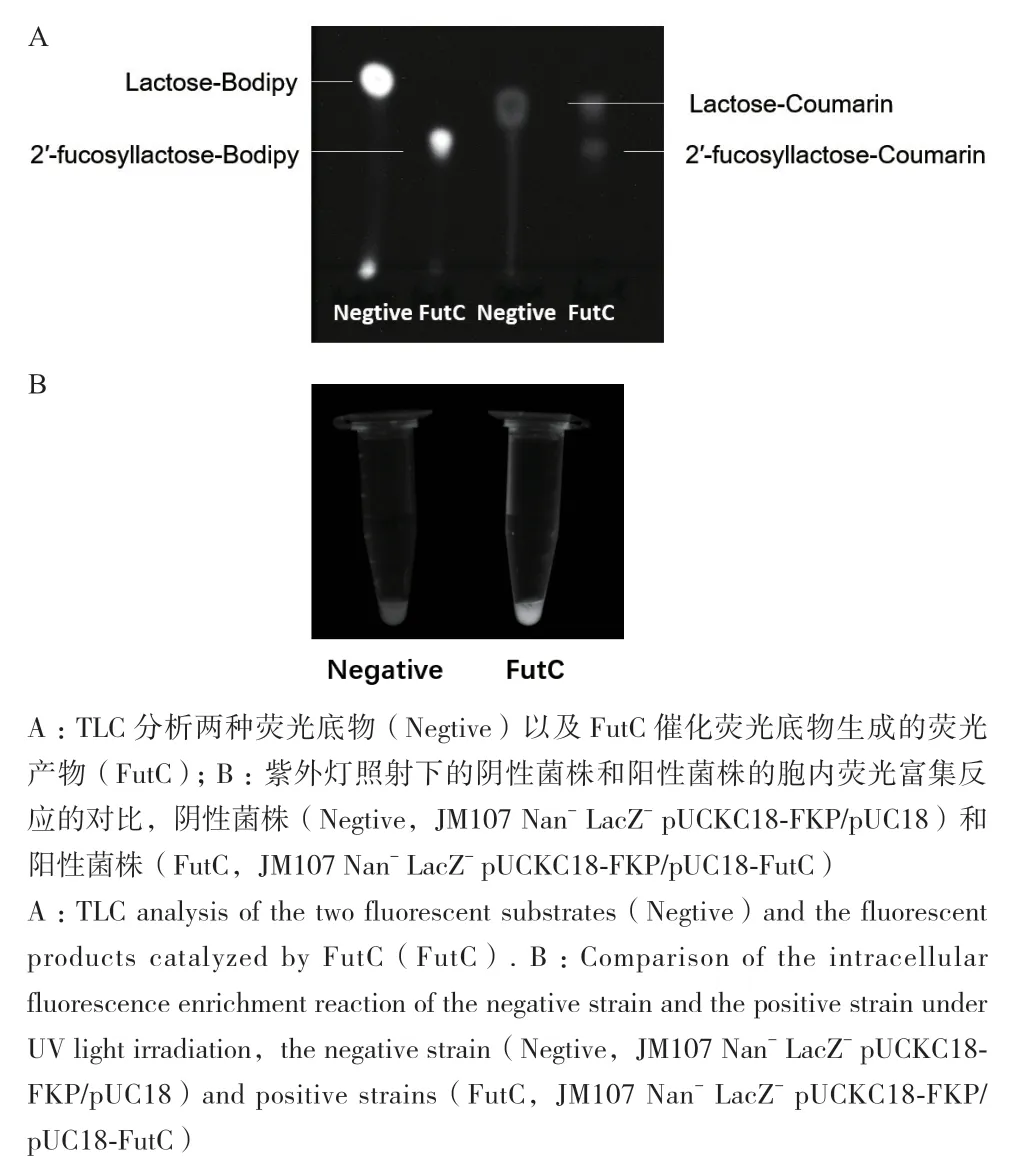
图2 TLC分析FutC的荧光产物和紫外灯照射分析阴性菌株和阳性菌株的胞内荧光富集反应Fig. 2 TLC analysis of fluorescent products and intracellular fluorescence enrichment reaction analysis of negative and positive strains under UV light irradiation
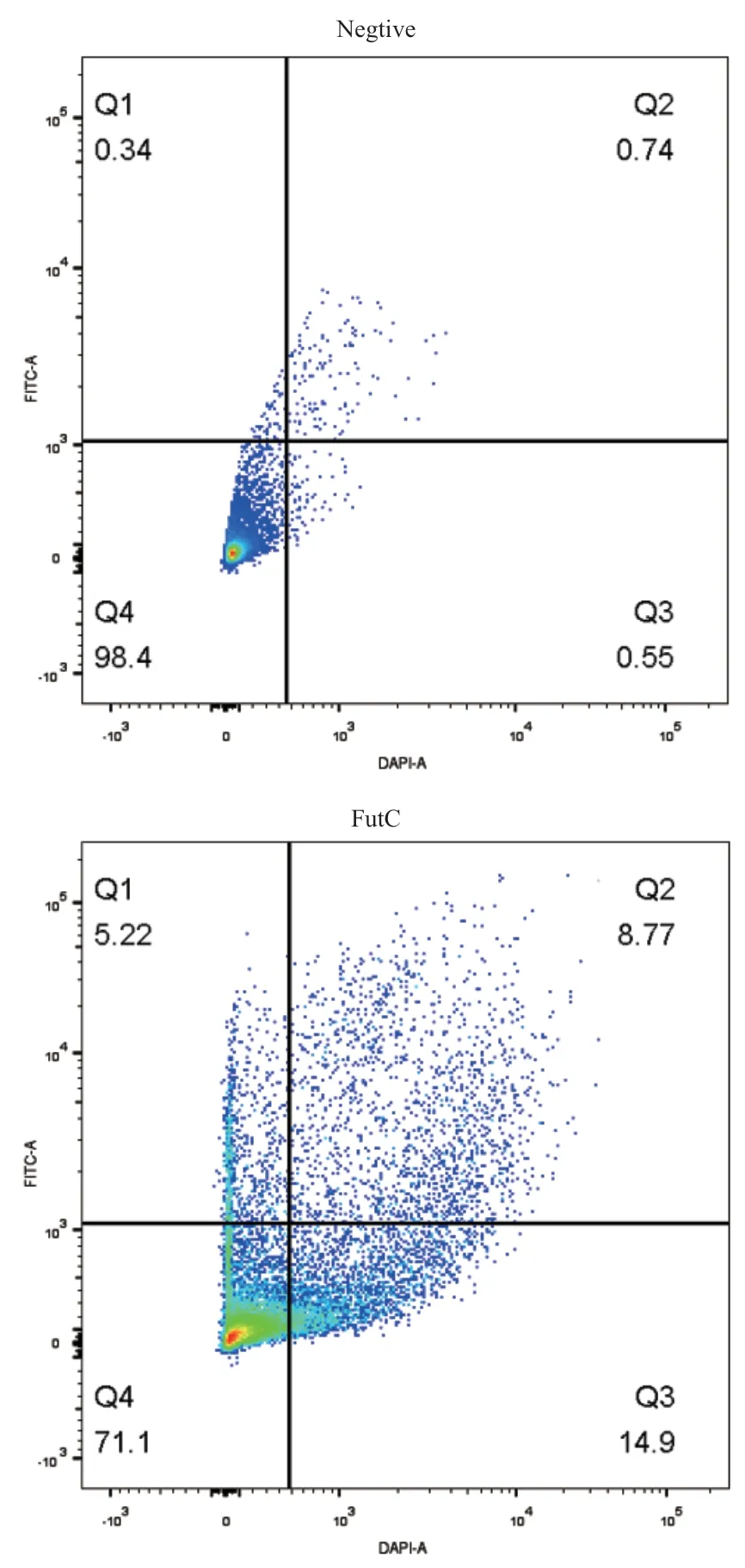
图3 阴性菌株和阳性菌株的FACS分析Fig. 3 FACS analysis of negative and positive strains
2.2 FutC的单细胞超高通量筛选方法
FutC胞内荧光富集的现象说明大肠杆菌细胞内累积荧光产物的量与其表达α-1,2-岩藻糖基转移酶的活力形成偶联,因此可以通过流式细胞仪检测荧光信号高低,从而区分具有不同催化活力的酶,这是进行FACS筛选的基础。在定向进化的过程中,具体的筛选流程可以分为5个步骤:步骤1,利用易错PCR等方法建立FutC的突变库;步骤2,将突变库的质粒转化进入含有GDP-fucose合成酶(FKP)的E.coli细胞,培养并诱导FutC蛋白表达;步骤3,收集培养的细菌和荧光底物反应液进行孵育反应;步骤4,将未反应的荧光底物从胞内清洗出来,只保留岩藻糖基化荧光产物在胞内;步骤5,上机进行FACS分选。
对单细胞超高通量筛选方法的关键技术参数进行了优化。在分选收集培养基和复苏时间方面,营养成分丰富的SOC培养基的复苏效果好于LB培养基(图4-A),2.5 h为最佳复苏时间(图4-B),这样的优化使分选后细菌的复苏率从10%提高至30%以上。此外,还发现对于PBS分选鞘液进行0.22 μm滤膜过滤可以显著提升分选准确率,而且以商业化CST双色小球作为分选质量的质控对于提升分选准确率非常重要,当CST小球的分选准确率达到99%以上时,分选效果最佳。经过这样的优化,细菌在双阳性目标门P2内对于阳性细菌的分选准确率可以从45.3%提升至73.4%,代表假阳性的Q3区域从占28.9%降低至7.8%(图4-C,D)。
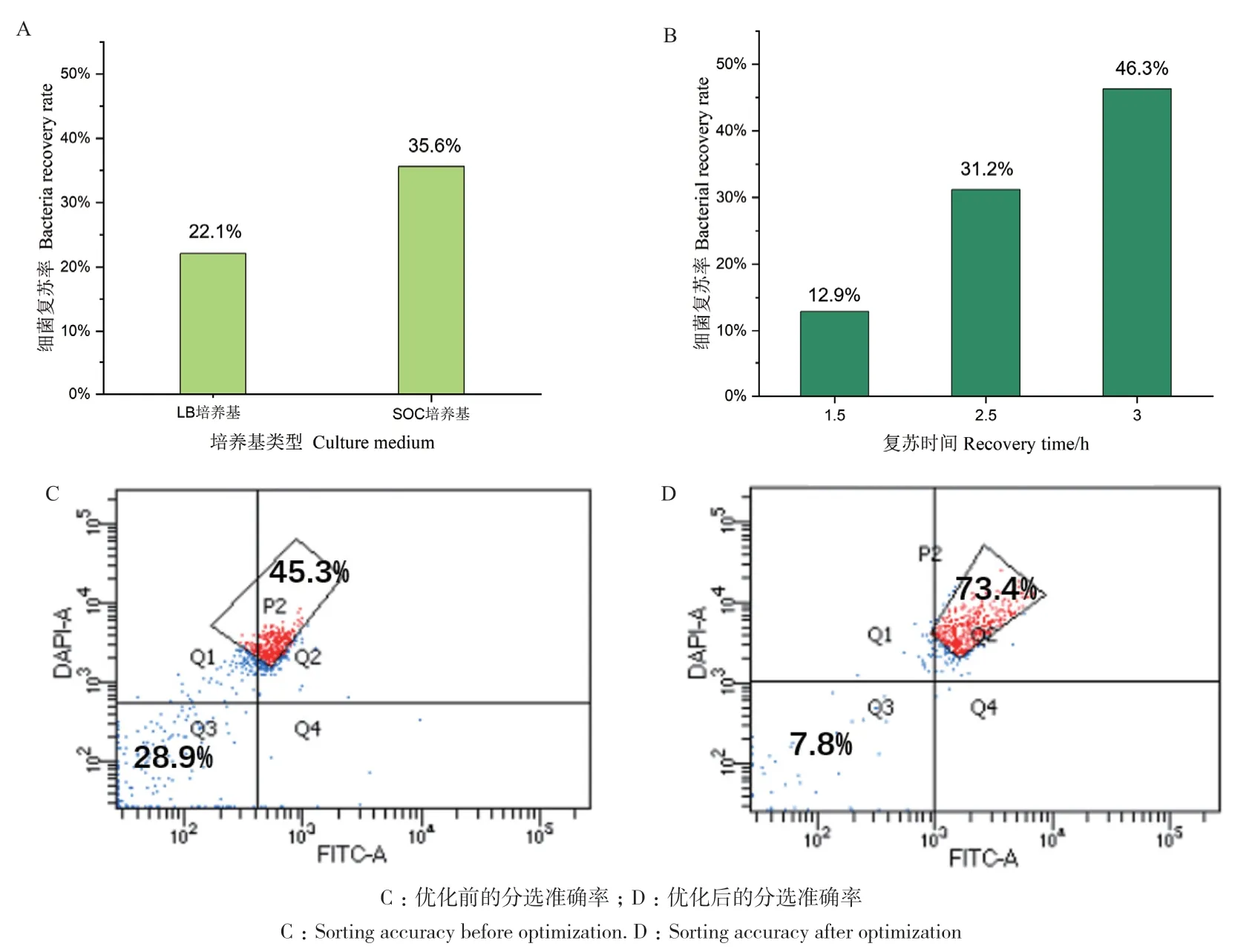
图4 细菌复苏率和分选准确率的优化Fig. 4 Optimization of bacterial recovery rate and sorting accuracy
模式分选是验证FACS是否能有效地将具有FutC活性的细胞从无活性的细胞中分选出来的直接方法。通过对比分选前后带有FutC细胞的比例变化,来评估筛选体系对阳性群体的富集效率,可以有效的验证筛选方法的有效性。首先对无活力的阴性细菌样品和具有FutC催化活力的阳性细菌样品进行反应、冲洗与重悬。之后将阳性与阴性样品分别按照1∶1、1∶10、1∶100、1∶1 000的比例混合,作为进行模式分选的样品。通过FACS记录的散点图,在双荧光强度最强的1%的细胞群体中分选出5 000个细菌进行复苏培养并鉴定futC基因是否存在。结果表明,我们建立的筛选方法仅通过一轮筛选即可以将阳性细菌从大量阴性细菌中富集出来。在分选前阳性细胞的比例为50%,10%,1%和0.1%时,富集倍数分别为2、10、90及733倍,有力的证明了此筛选方法的有效性(表2)。
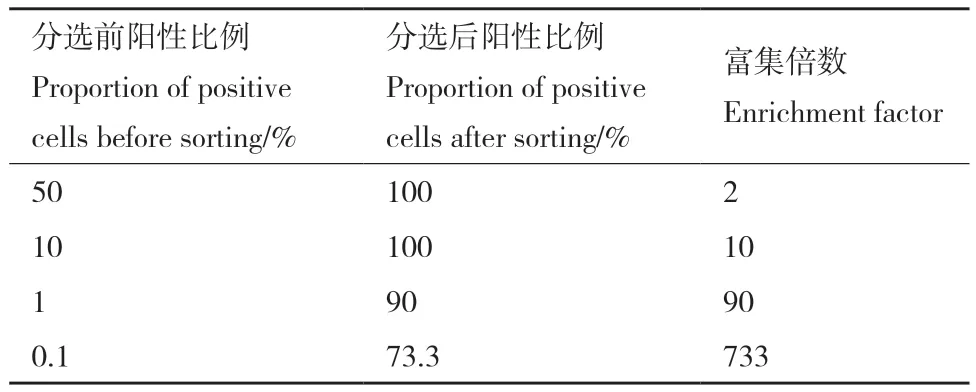
表2 FutC的模式分选Table 2 Model screening of FutC
2.3 FutC的定向进化
在初步建立并优化了FutC超高通量筛选方法之后,我们对FutC进行了定向进化实验。首先,我们通过易错PCR建立了FutC的随机突变库(图5),平均突变为2.5个突变/基因,库容量为5.4×105。对突变库进行了3轮FACS筛选,均筛选双阳性最强的1%-1.5%的群体,随后在筛选得到的富集文库中随机挑取100个突变体进行复筛。
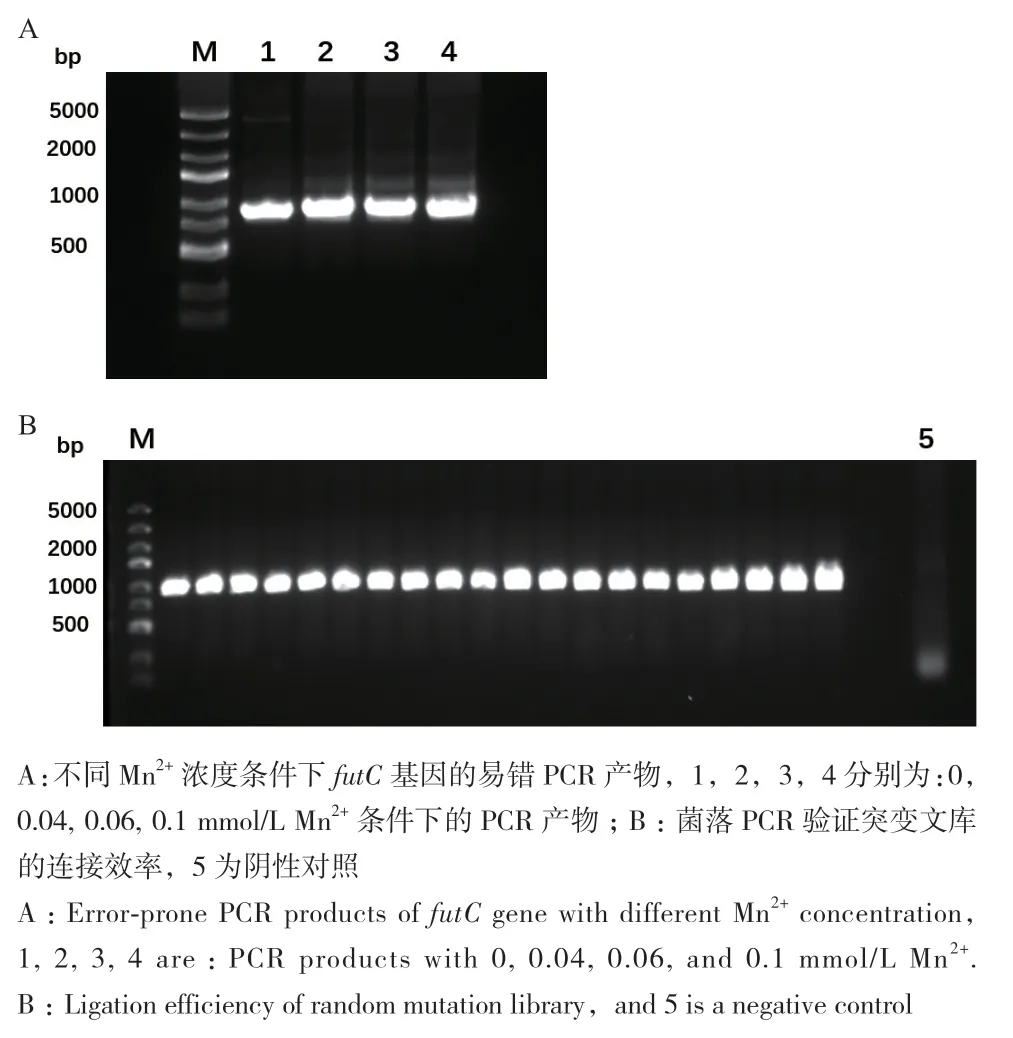
图5 FutC随机突变文库构建Fig. 5 Construction of the FutC random mutation library
筛选前后的突变库的FACS分析结果如图6,筛选前文库绝大部分为聚集在Q4区域的失活或低活力突变体,在经过两轮筛选之后,经过富集的文库在双阳性区域Q2增加了6.5倍,说明筛选后的菌体对两种荧光底物的活力均明显提高。文库筛选结果证明FutC的超高通量筛选方法可以从绝大部分为失活突变体的文库中富集出具有较高催化活力的突变群体。富集后文库的复筛最终得到了粗酶液相比于野生型活力有一定提升的3个突变体(图7),测序得到对应突变分别为K282E、K102E、R105C。
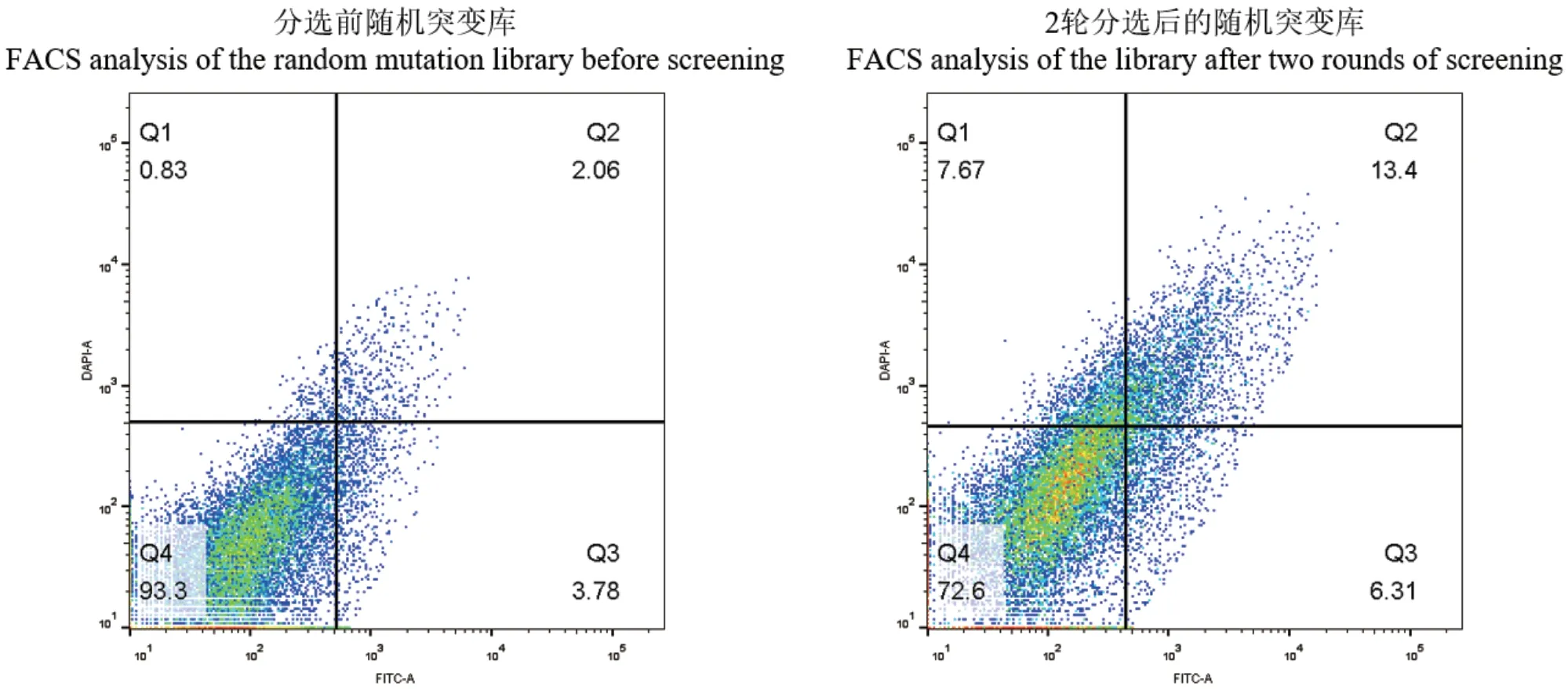
图6 流式细胞仪分析分选前的随机突变文库和分选2轮后的随机突变文库Fig. 6 FACS analysis of the FutC random mutation libraries before screening and after two rounds of screening

图7 TLC分析复筛得到的单克隆的粗酶液活力Fig. 7 TLC analysis of monoclonal crude enzyme activity after re-screening
2.4 FutC突变体的表达纯化与活力测定
为了进一步验证突变体的酶活,我们对野生型和筛选得到的突变体进行了蛋白表达纯化和酶活测定。首先利用高效液相色谱建立了FutC的酶活测定方法。结果如图8-A,B所示,荧光底物lactosebodipy和荧光产物2′-fucosyllactose-bodipy的保留时间分别为6.71 min和10.25 min。在0.025-0.2 mmol/L检测范围内,2′-fucosyllactose-bodipy的质量浓度和色谱峰面积呈现良好的线性关系,说明HPLC测活方法极为精确。随后对野生型和筛选获得的3个突变体进行蛋白表达纯化,SDS-PAGE如图8-C,蛋白纯度在95%以上。比活力测定结果如表3,FutC(K102E)、FutC(R105C)、FutC(K282E) 对 于 荧光底物lactose-bodipy的比活力相比野生型分别提高了2.7倍,3倍和2.6倍。酶活测定结果表明我们通过超高通量筛选方法成功地从大容量的随机突变库中筛选获得活力提高的FutC突变体,证明了该方法的有效性。
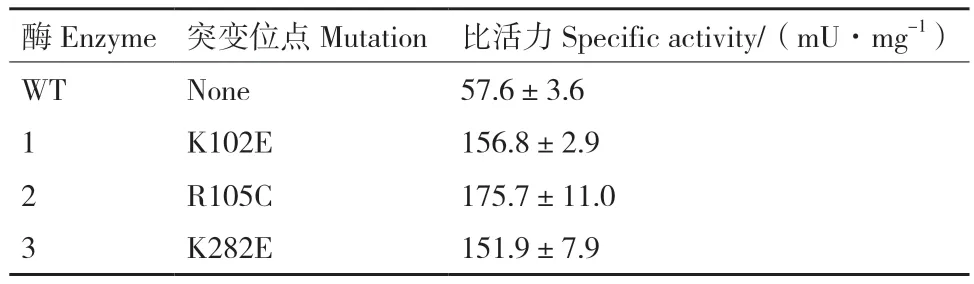
表3 FutC野生型和突变体对荧光乳糖lactose-bodipy的比活力Table 3 Specific activities of WT FutC and selected mutants using lactose-bodipy as acceptor
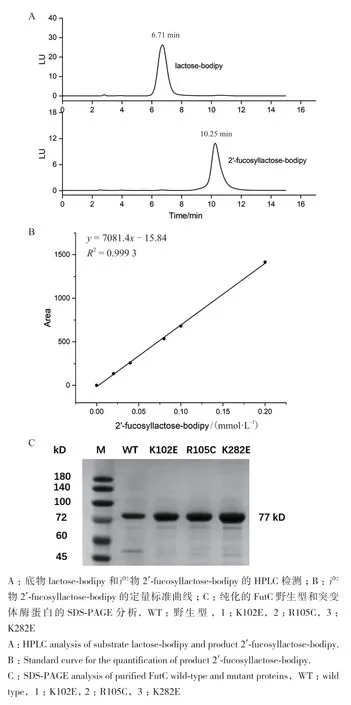
图8 HPLC酶活测定方法的建立及FutC野生型和突变体的蛋白纯化Fig. 8 Establishment of HPLC enzyme activity determination method and protein purification of FutC WT and mutant
3 讨论
定向进化将随机突变和高通量筛选技术结合,以此获得具有理想特性的酶。超高通量筛选方法可以覆盖随机突变或组合饱和突变文库,具备良好的检测灵敏度和应用灵活性,为定向进化提供了高效的筛选工具。其中荧光激活细胞分选技术通过巧妙的设计将荧光信号与酶的催化反应相偶联,已发展成为糖基转移酶定向进化的有效手段。
作为岩藻糖基寡糖生物合成途径中的关键酶,α-1,2-岩藻糖基转移酶被广泛应用于2′-岩藻糖基乳糖的生物合成。近年来,对于α-1,2-岩藻糖基转移酶的研究已成为一个热点方向。2008年Stein等[23]对幽门螺杆菌来源的α-1,2-岩藻糖基转移酶FutC进行了详细的酶学性质表征,鉴定了FutC的最适pH,温度及底物谱。2014年Engels等[24]鉴定了一种来源于E.coli O126的新型α-1,2-岩藻糖基转移酶WbgL。2020年Li等[25]通过改变反应系统中的不同酶量确定了α-1,2-岩藻糖基转移酶是2′-岩藻糖基乳糖合成途径中的限速酶,并对不同来源的α-1,2-岩藻糖基转移酶的活力及热稳定性进行了比较分析,通过同源建模推测出高度保守的基序HxRRxD负责GDP-L-岩藻糖的结合。目前对于α-1,2-岩藻糖基转移酶的大部分研究依然停留在酶学性质的表征和结构的模拟预测阶段,同时由于缺乏有效的筛选手段,尚未有研究报道其定向进化。
本研究针对α-1,2-岩藻糖基转移酶定向进化过程中缺少高通量筛选方法的问题,建立并优化了基于α-1,2-岩藻糖基转移酶FutC的超高通量筛选方法并证明了其应用价值,为后续定向进化提供了有利工具。FACS的胞内荧光捕获策略利用了乳糖透过酶LacY的精确底物特异性,它可以识别底物但无法催化某类糖基化产物。在过去的研究中,导致LacY底物特异性差异修饰的关键糖基化位点已经在乳糖的半乳糖基的C-3羟基(β-1,3-半乳糖基转移酶和α-2,3-唾液酸转移酶)以及乳糖的葡萄糖基的C-3羟基(α-1,3-岩藻糖基转移酶)上得到了验证。本研究将该策略应用于α-1,2-岩藻糖基转移酶用以建立其超高通量筛选方法,其糖基化修饰位点为乳糖的半乳糖基的C-2羟基,该策略的成功实施进一步拓展了FACS筛选方法在糖基转移酶中的应用范围。其次对该方法的优化解决了之前普遍存在细菌复苏率和准确率过低的问题,极大提高了FACS筛选系统的效率。随后定向进化成功获得阳性突变体直接证明了该方法的有效性。但在筛选中,由于我们构建随机突变文库的DNA聚合酶存在碱基偏好性等问题,文库质量相对较低。构建小而精的高质量突变文库结合超高通量筛选方法,有望筛选获得催化活力更高的突变体,为生物合成提供优质的酶源。此外,对于α-1,2-岩藻糖基转移酶及其底物复合物晶体结构的解析极具研究价值,通过晶体结构的解析,我们将得到更多与酶催化机制有关的信息,确切的结构信息将为分子改造提供更进一步的支持。
4 结论
本研究建立了针对α-1,2-岩藻糖基转移酶FutC的超高通量筛选方法,并成功筛选出催化活性提高的FutC突变体。该方法的建立为α-1,2-岩藻糖基转移酶的定向进化提供了强大的进化工具,为后续筛选获得更高活力的突变体打下了良好基础。

