光电关联显微镜技术及其在植物学研究中的应用
武欣媛 王广超 林金星 荆艳萍
(1. 北京林业大学 林木育种国家工程实验室,北京 100083;2. 北京林业大学生物科学与技术学院 林木花卉遗传育种教育部重点实验室,北京 100083)
传统的光学显微镜观察视野较广,可进行特异性标记,能够实现活细胞成像[1-2],但分辨率有一定的局限性;电子显微镜分辨率高,可观察细胞内部结构,但不具有特异性,不能实现活体检测[3]。光电关联显微镜(correlative light and electron microscopy,CLEM)技术结合了这两种成像方法的优势,利用光学显微镜和电子显微镜对同一细胞或同一组织区域进行不同程度成像的联合分析,直接在原位获取全面而清晰的细胞结构信息,目前已成为研究纳米级结构和分子分布的有力工具[4-5]。本文就该技术的研究进展和前人工作进行概述,着重介绍其在植物学研究中的应用,旨为更好地运用CLEM提供借鉴和依据。
1 CLEM简介
CLEM将两种或两种以上不同的显微技术应用到样品的同一区域,产生互补的形态、结构和化学信息,从而实现单一技术无法实现的成像效果[6-7]。根据CLEM关联电镜的不同,又可以分为光镜关联扫描电镜(scanning electron microscopy,SEM),光镜关联扫描透射电镜(scanning transmission electron microscopy,STEM)和光镜关联透射电镜(transmission electron microscopy,TEM),后者的分辨率更高,可以提供高分辨率的超微结构细节,但是样品制备较为复杂[8]。早期,大多光电关联使用TEM进行,近来,SEM被越来越普遍地应用于CLEM。体积扫描电子显微镜(volume SEM)或连续切片扫描电镜(serial slice SEM)的方法,通过连续观察样品表面,使三维细胞结构可视化,近来常常被应用于CLEM[9]。
冷冻光电关联显微镜技术(cryo-correlative light and electron microscopy,Cryo-CLEM)和超分辨率光镜-电镜关联技术(super-resolution correlative lightelectron microscopy)近年来发展迅速。冷冻光电关联显微镜技术,将冷冻技术与CLEM结合,采用快速冷冻制样或者高压冷冻制样,吸附于载网的细胞等样品经快速冷冻固定后进行冷冻荧光成像;或者组织样品经高压冷冻后冷冻切片,固定于载网上进行冷冻荧光成像,随后均进行冷冻电镜成像[10]。这一过程中,200 μm 厚度的样品在20 ms 的极短时间内能够迅速玻璃化,将细胞内的生理活动固定在一瞬间,保证样品更接近生理状态,从而可以真实地观察到特定结构的瞬时变化[11]。此外,低温下荧光分子发光特性的提高,也使得成像的精度大大提高[7]。相比常规的CLEM,Cryo-CLEM具有成像质量高,样本制作难度低,样本制作时间短等优势,已成为研究生物大分子强有力的武器[12]。
超分辨率荧光显微技术包括随机光学重建显微 镜(stochastic optical reconstruction microscopy,STORM)技术[13],光激活定位显微镜(photoactivation localization microscopy,PALM)技术[14]和受激发射损耗显微镜(stimulated emission depletion,STED)技术[15]等,超分辨率荧光显微技术打破了光学系统极限分辨率的限制,将分辨率提高至纳米级[16]。将该技术应用于CLEM,通过超分辨单分子技术观察目标分子,利用电镜对目标位置进行高分辨率成像,最终将定位信息和结构信息进行整合,揭示目标分子在细胞中的分布和所处微环境结构,在研究生物分子转运和膜动态变化等过程中具有十分重要的作用[17]。
2 CLEM探针的种类
常规CLEM,首先使用光学显微镜对样品进行定位,然后在电子显微镜中成像。但是,通常电镜制样会使有机荧光团淬灭。此外,还可能引入伪像,使光镜和电镜图像之间的配准复杂化。最近几年报道了多种适用于CLEM的探针,可在保持电镜电子对比度的同时保留荧光信号,而且会降低在不同显微镜之间转换时引入伪像的几率。根据探针标记的不同,将CLEM探针分为如表1 所示的3种类型[18]。
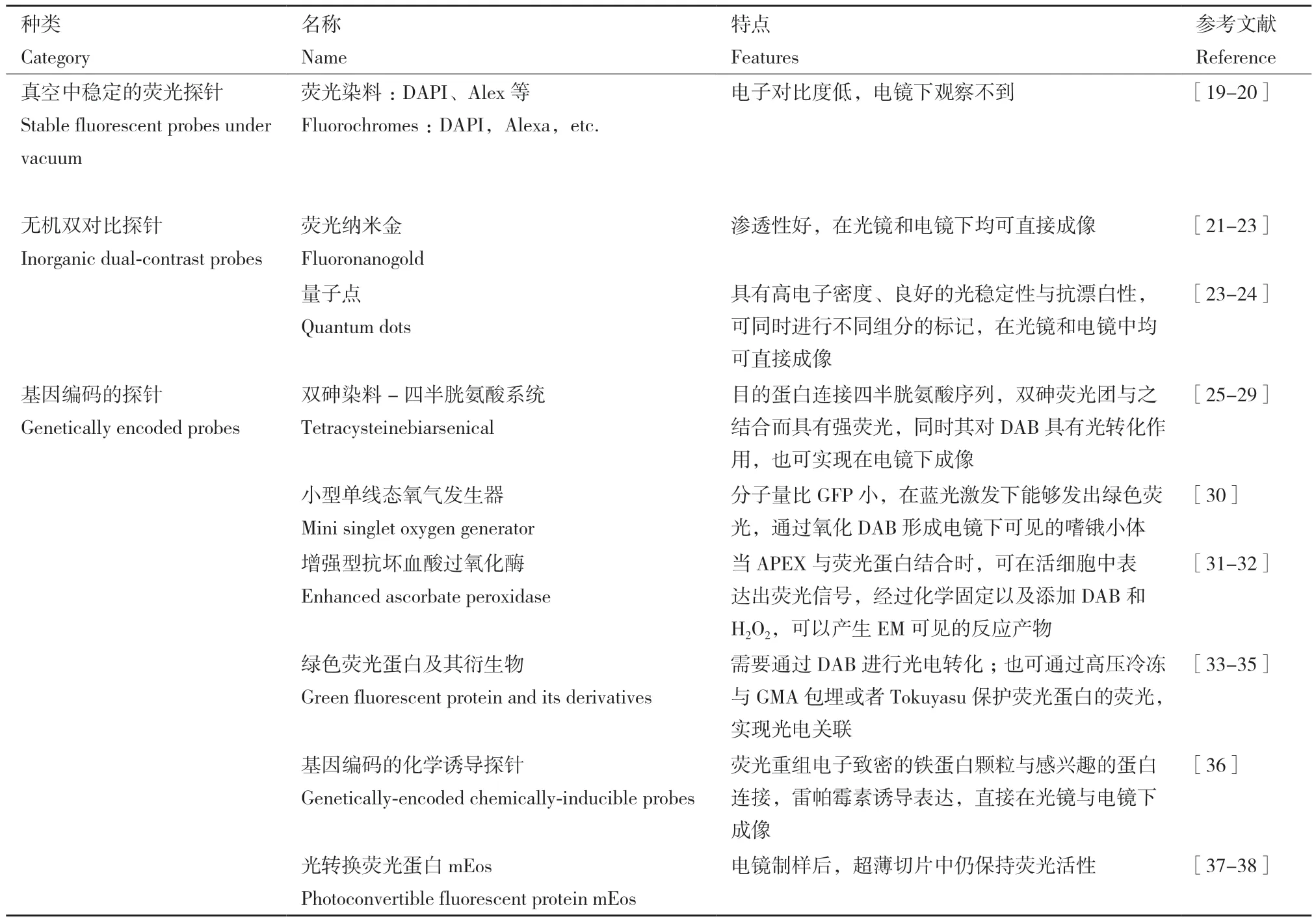
表1 光电关联探针Table 1 CLEM probes
2.1 真空稳定的荧光探针
这类探针在电子显微镜的真空环境中稳定且具有活性。其中常用的荧光探针,如DNA特异性荧光探针 :4′, 6-二脒基 -2-苯基吲哚(4′, 6-diamidino-2-phenylindole,DAPI)和Alexa Fluor系列染料等已证明适用于CLEM[19-20]。这类荧光探针通过与靶结构直接结合或者与抗体结合来进行定位,既可以在活细胞中用作示踪剂,也能对固定细胞进行标记,还可以在超薄树脂切片或蔗糖包埋冷冻切片(Tokuyasu)上进行亚细胞定位。由于它们没有固有的电子对比度,在电镜中观察不到,只能通过荧光信号的位置与电子图像的叠加,实现光电图像关联[18]。
2.2 无机双对比探针
当所观察的细胞器体积小且数量多时,在荧光图像和电镜切片中追踪相同的结构会比较困难。无机双对比探针可以在光镜和电镜中直接成像,提高了电子显微镜中的定位精度。这类探针包含荧光纳米金和量子点[18]。
2.2.1 荧光纳米金(fluoronanogold,FNG) 荧光纳米金是一种双功能探针,在光镜和电镜中均能够被观察到。由抗体Fab片段(赋予分子选择性,实现精确定位)和一个小的金簇(为电镜检测提供了电子致密结构)和荧光染料(用于荧光显微镜检测)组成[21-22]。FNG足够小,比较容易渗透进入细胞内,因此不破坏细胞膜结构便可以用于标记细胞内的分子[18,23]。
2.2.2 量子点(quantum dots,QDs) 量子点是一种纳米材料,具有良好的光稳定性,不易发生光漂白,能够反复成像。量子点的大小以及电子密度特性适合用于电镜成像,所以,可作为CLEM的探针。此外,量子点的体积与其光吸收和发射特点相关,可以通过改变量子点的大小获得不同波长范围的光谱,这为同时标记多种蛋白质提供了可能[4,24]。利用这些特性,可以先在低分辨率光镜下观察特定蛋白的分布,然后通过电镜,在高分辨率下更准确地定位相同标签的蛋白[23]。
2.3 基因编码的荧光探针
2.3.1 双砷染料-四半胱氨酸系统(tetracysteinebiarsenical) 双砷染料-四半胱氨酸探针系统是通过含有双砷的荧光团与四半胱氨酸序列相互作用而标记目标蛋白。双砷荧光团是二氨基联苯胺(3,3′-diaminobenzidine,DAB)依赖的探针,当它与含有四半胱氨酸的寡肽标签结合时,形成具有强荧光的双砷-四半胱氨酸复合物,可于光镜下进行观察。四半胱氨酸序列为-CCXXCC-,其中X指除半胱氨酸外的任何氨基酸[25],当XX为脯氨酸和甘氨酸,即序列为CCPGCC时,其与双砷化合物结合具有更强的特异性[26]。
四半胱氨酸基序可以利用遗传编码获得,通过表达带有四半胱氨酸标记的目的蛋白来显示各种细胞组分。目前已经开发了多种双砷染料,其中主要有FlAsH和ReAsH双砷染料,它们是细胞通透性的,当它们与目的蛋白上连接的四半胱氨酸基序结合时,分别显示绿色和红色荧光。因此,在培养基中加入生物砷探针后,该系统可以跟踪标记蛋白在活细胞中的运动[27-28]。此外,这些标签产生的活性氧可作用于DAB,形成高电子密度的聚合物,因此信号可以很容易地在电镜下被检测到[29]。
2.3.2 小型单线态氧气发生器(mini singlet oxygen generator,MiniSOG) MiniSOG通过改造植物拟南芥向光色素-2(phototropin-2)而获得,其大小约为15 kD,分子量仅为GFP的一半,MiniSOG可以在细胞中表达。通过表达MiniSOG和目标蛋白的融合蛋白,对活细胞中目标蛋白进行可视化[30]。Mini SOG在蓝光照射下高效生成单线态氧,可以氧化DAB形成电镜下可见的嗜锇小体,从而被电镜检测到,是一种方便、强大的CLEM探针。
2.3.3 增强型抗坏血酸过氧化物酶(enhanced ascorbate peroxidase,APEX) APEX是一种可用于电镜(electron microscopy,EM)水平上的蛋白质标记。它编码过氧化物酶,在H2O2存在下,催化DAB氧化聚合,形成光学显微镜可以检测的产物,可以在电子显微镜制备之前筛选样本。目前,APEX已被成功用于定位蛋白,但其检测灵敏度有局限,一些低水平表达的蛋白检测不到。通过对其改进而得到APEX2,灵敏度显著提高。当APEX与GFP或其他荧光蛋白结合时,可在活细胞中表达出荧光信号,经过化学固定和添加DAB和H2O2,可以产生EM可见的反应产物,可应用于活细胞延时成像和CLEM[31-32]。
2.3.4 绿 色 荧 光 蛋 白(green fluorescent protein,GFP)及其衍生物 GFP常常用于DAB介导的光电关联。将目标蛋白与GFP蛋白融合表达,漂白感兴趣区域的GFP荧光能够产生单线态氧,所产生的单线态氧作用于DAB形成聚合物[29],因此,利用这一性质,实现在光镜和电镜目标区域的关联定位[33]。由于GFP产生单线态氧的效率比较低,因此,该方法运用过程中存在一定困难。GFP衍生物如黄色荧光蛋白(yellow fluorescent protein,YFP)也可应用于 CLEM 成像[34]。
采用GFP融合蛋白免疫胶体金标记的方法,可以提供便于光电关联的高对比度电镜图像,但相比DAB介导的方法,该方法需要进行膜的透化处理,容易导致膜结构的破坏。结合甲基丙烯酸酯(glycol methacrylate,GMA)低温包埋的方法,以及Tokuyasu制样方法,均可以很好地保护GFP荧光,可以实现细胞超微结构的光电联用观察。GMA包埋的方法中,当切片为250 nm时,GFP信噪比明显提高,该方法还可与高压冷冻固定兼容,避免了化学固定可能带来的假象。Tokuyasu方法中,80 nm 的切片便可以检测到足够的荧光信号,使目的区域形态结构可视化,从而实现了光镜电镜图像的关联[35]。
2.3.5 FerriTag FerriTag是一种基因编码的化学诱导探针,近来被开发应用于光电关联。FerriTag将荧光重组电子致密的铁蛋白颗粒与感兴趣的蛋白连接,通过雷帕霉素诱导系统表达,实现了在光镜下的荧光成像,以及电镜下的直接观察。该方法成功应用于标记细胞内各种结构,包括线粒体,质膜,网格蛋白包被小泡和液泡等相关的蛋白质。FerriTag具有较高的信噪比,标记分辨率可以达到10 nm,将其作为标记探针,在纳米尺度上实现了蛋白在亚细胞结构的定位[36]。
2.3.6 光转换荧光蛋白mEos mEos是一种可以抗锇酸固定和Epon包埋的光转换荧光蛋白,该荧光蛋白在电镜制样后仍然保持荧光并具有光开关活性。目前,有许多种经过改造的mEos衍生物如:mEos2、mEos3.1/3.2及mEos4等,均有助于活体和轻度固定样品的成像[37]。Fu等[38]通过优化超薄切片中单分子定位算法和成像方法,利用mEosEM首次实现了Epon后固定电镜样品的同层超分辨光镜-电镜关联成像。由于该探针没有显著的天然电子对比度,因此,光电关联通过光镜和电镜图像的叠加而实现[18]。
3 光电关联样品制备与图像关联
根据实验具体需要,可以选择前包埋光电联用或者后包埋光电联用成像。前包埋光电联用成像方法首先使用共聚焦等光学显微镜观察活细胞或者固定后细胞的荧光图像,获得较大范围的光学成像数据,然后将成像后的样品进行脱水、包埋、切片、染色等处理,使用电子显微镜成像获得细胞的局部结构特征[39-40]。上述过程中,光学显微镜检测的是包埋前的整个细胞,而电镜检测的则为包埋后细胞的一个切面,所以这种方法虽然能够获得较强的荧光信号,但是容易导致整体细胞的光镜图像与超薄切片的电镜图像关联不准[23,41-42]。
后包埋光电联用成像是将样品处理后,获得切片,然后通过光镜成像定位蛋白的分布,再利用电镜切片检测超微结构。这种方式可以使用连续切片分别进行光镜和电镜成像,也可以使用同一切片先后进行光镜和电镜成像。从样品中获取连续切片,可以根据需要获得不同厚度的切片进行不同类型的成像。比如半薄切片厚度较大,具有较好的成像反差及标记效率,可以先通过半薄切片在光镜中观察确定成像目标,再使用电镜对对应的超薄切片的目标区域进行高分辨率成像,这样可以兼顾光镜标记效率和关联的准确度,但是标记的蛋白也并非严格一致[43-44]。使用同一切片进行光电关联成像可以保证成像蛋白的一致性,甚至能够实现超薄切片荧光标记结构与超微结构纳米水平的关联,但是由于光镜标记的需要,一般无法使用高浓度的戊二醛及锇酸固定,电镜成像的分辨率较差,Johnson等[45]对其进行改进,通过高压冷冻、冷冻替代后树脂包埋的方法,保留了mGFP、mVenus 以及 mRuby2等荧光蛋白的荧光和光控特性,实现了超薄切片荧光标记结构与电镜超微结构纳米水平的关联,然而,该方法无法保证电镜成像中的图像衬度。近来,Fu等[38]借助于新型抗锇酸固定和Epon包埋的探针mEosEM,实现了对同一切片的超分辨光镜-电镜关联成像,这种方式有利于保持细胞超微结构与电镜图像质量,更容易确定光镜和电镜图像之间的关系。
利用CLEM得到的光学图像需要合适的方法和电镜的图像进行关联,从而实现低倍数的蛋白定位信息导航和高分辨结构信息观察的整合。目前图像关联主要有以下3种方式:第一,利用细胞特征结构进行关联。细胞中部分结构形态学特征明显,例如:脂滴,在光镜和电镜中都可见,所以可将该结构作为基准,实现光电图像对照关联[42];第二,利用标记物进行关联。探针标记的改进,使得标记物在光镜和电镜中都可以观察到,这极大地促进了图像的关联效率,而且定位的信息也更加直观而准确[18];第三,商业软件关联。由于CLEM技术的应用逐渐广泛,用于光镜和电镜图像重叠定位的软件也应运而生,可以直接应用软件实现图像自动校准[46]。
4 CLEM在植物学研究中的应用
近年来,CLEM在动物和植物研究领域均有广泛应用,主要用于检测亚细胞结构、生物大分子精确定位和动态运输、以及分析病原体侵染等过程。植物细胞相对动物细胞结构更为复杂,首先,植物细胞具有细胞壁,固定液穿透速度更慢,标记过程也变得更为复杂;其次,植物细胞存在大液泡,缓冲液使用不当,会引起液泡收缩,在固定过程中导致质壁分离。因此,与动物细胞中的相关研究相比,在植物领域应用CLEM还相对较少[6,36]。以下,对目前在植物中应用CLEM研究取得的成果进行总结,希望可以为后续研究提供借鉴。
4.1 亚细胞结构与特定结构的观察
细胞及亚细胞形态结构与功能息息相关,了解这些结构的形态及组成,对探究该结构的功能有非常重要的作用。随着光学显微镜的改进,配合使用高分辨率的电子显微镜,越来越精细的结构被发现。采用CLEM,可将定位信息与结构信息相对应,获得单一技术无法观察到的信息。在动物研究领域应用CLEM,取得了一系列进展,例如:揭示了自噬体的超微结构[42],发现了线粒体中特殊结构的嵴[47],重建了黏着斑的三维结构[48]以及发现了包括内质网定位蛋白在内的一系列蛋白质与超微结构的关系等[49]。
在植物组织中,部分结构由于位置特殊或者结构复杂,利用单一的显微手段不易观察完整结构信息,因此运用CLEM观察特定的结构在植物研究领域有较多的应用。例如,韧皮部细胞较小,它们在植物器官中的位置特别,识别韧皮部的细胞类型在技术上具有挑战性。Bell等[50]对荧光标记及固定技术进行了改进,利用共聚焦显微镜,对目标区域进行检测和定位,通过透射电镜,观察到部分筛孔和沉积的胼胝质环的高分辨结构,最后利用三维结构照明显微镜(3D structured illumination microscopy,3D-SIM),观察到完整的筛孔结构及周围的纤维素环,3种成像方式相互结合,共同揭示了筛孔结构和胼胝质沉积的关系。Schroeder等[51]运用荧光纳米金标记,结合光学显微镜和扫描电镜,对风信子分裂过程中的一对染色体上突出的钉状结构进行研究,将染色体与带有荧光基团的45S rDNA探针杂交,使用荧光显微镜定位成像,筛选目标细胞,然后用扫描电镜进行高分辨成像,证明染色体上的钉状结构是核仁组织区。此外,针叶树水和矿物质运输主要通过管胞壁上的具缘纹孔,具缘纹孔的纹孔膜中央有一个圆盘状富含果胶的增厚区域,即纹孔塞。West等[52]用酶处理木材以提高木材渗透性,使用光学显微镜观察发现被染色的果胶物质褪色,认为纹孔塞已被破坏。然而,利用扫描电子显微镜观察相同区域发现,许多未染色的具缘纹孔在扫描电镜下可见完整但经修饰的纹孔塞,因此,结合两种显微技术能够提供更完整的信息,可以防止错误的结论。Hertle等[53]利用共聚焦显微镜和电子显微镜观察了嫁接植物结合处及基于愈伤组织嫁接后融合的细胞壁,阐明了植物水平基因组转移事件的细胞学机制,揭示了植物细胞间的转运途径,通过该途径,细胞间实现了基因、结构(包括整个质体)的交换。通过荧光显微镜和场发射扫描电子显微镜关联,Neumann等[54]对豌豆(Pisum Sativum)的着丝粒结构进行了高分辨率研究。他们使用荧光纳米金作为标记探针,发现着丝粒结构域的组织和DNA组成比之前认为的要复杂得多,拓展了人们对于全着丝粒染色体的了解。
近年来,针对CLEM植物超微结构成像进行了技术改进。光学显微镜的分辨率有了很大的提高,但对于更高分辨率的结构分析,电子显微镜仍然是很好的选择,传统的植物组织制备技术通常需要较长固定时间和使用有毒的固定剂,存在细胞结构变形等缺点。Pfeiffer[55]等采用高压冷冻、冷冻替代、低温包埋等一系列改进的制备方法,其中番红O作为低温脱水过程中的固定剂,同时也可以作为染料使细胞成分着色,使用激光扫描共聚焦显微镜和透射电镜对豌豆和大麦叶片进行观察,发现细胞精细结构和细胞组分的抗原性都得到了很好的保护,为植物样品的制备提供了借鉴。此外,Rizzo等[56]研究了一种低压背散射电子成像技术,结合光镜和扫描电子显微镜对大豆叶片组织和玉米籽粒的切片进行成像,发现可以在130-70 000倍的连续放大倍数下进行观察,可记录组织和亚细胞的超微结构细节,可观察到7 mm×10 mm切片大小范围内的超微结构,明显大于传统透射电子显微镜0.2 mm×0.3 mm的切片大小,而且易于进行免疫定位。
4.2 蛋白质在亚细胞结构的精细定位分析
在细胞的生命周期中,蛋白质处于不断运动,修饰,合成和降解的过程。细胞生命活动在时间和空间上高度有序,蛋白质在特定时间会出现在特定空间,其正确定位是行使功能的必要条件。研究蛋白质的精确亚细胞定位是解析其生物学功能的重要依据之一。在动物中已经进行了大量研究,Liu等[57]利用超高分辨荧光显微镜和冷冻电镜的超分辨能力,观察到线粒体蛋白与线粒体外膜在三维纳米分辨率下具有良好的相关性。Watanabe等[58]将STED或PALM与电镜相结合,发现3种蛋白质在细胞器上的精确定位。Zhen等[59]发现参与介导吞噬体形成的两种重要蛋白质。
植物细胞中,运用CLEM技术,同样解析了部分蛋白的精细定位。植物胞间连丝是一种纳米级的细胞间通讯通道,利用荧光显微镜可以观察感兴趣的蛋白质是否定位于胞间连丝或与胞间连丝结构域相关。然而,由于胞间连丝是纳米级尺寸的结构,荧光信号只能作为散布在细胞外围的小斑点被检测到,不能实现精确定位。Modla等[60]将表达GFP标记的胞间连丝定位蛋白,用激光扫描共聚焦显微镜观察,随后,对标记的目标切片进行透射电镜分析,使用合适的图像软件将采集的光电图像对准,通过使用这种方法,光镜下的荧光散斑与电镜下的单个或聚集的胞间连丝蛋白之间实现了明确的关联。此外,El-Kasmi等[61]用激光共聚焦显微镜和透射电镜对拟南芥sec22突变体的花粉进行研究,运用免疫胶体金标记蛋白发现,SEC22蛋白对早期分泌过程中内质网和高尔基体之间的膜融合起重要作用。
4.3 囊泡运输
细胞中各种生理生化反应的有序进行离不开广泛分布的生物膜系统。细胞中营养吸收、信号转导、突触小泡循环和免疫反应等生命活动,通常借助于膜的更新与重构,利用囊泡运输进行物质传递。CLEM方法广泛应用于研究酵母和动物细胞的膜运输和细胞器动态[62]。其中,利用光镜结合电子断层扫描技术,Kukulski等[63]揭示了胞吞蛋白募集以及解离过程中,膜形状的变化,Avinoam等[40]发现网格蛋白在内吞过程中,首先募集到平坦的膜上,随后再根据膜的形状发生重塑,Franke等[64]发现了内体在不同细胞器间的囊泡运输过程。
反面高尔基体网络(trans-golgi network,TGN)是由高尔基体衍生而来的多功能细胞器,是细胞膜运输的枢纽,对分泌和内吞两条途径都有贡献。植物中的TGN还具有早期内体的功能。因此,植物细胞中不仅有与高尔基体相关的TGN,还有散布在细胞质中的游离TGN。Wang等[65]使用荧光显微镜和透射电镜分析了拟南芥根尖细胞中的TGN分布范围及其超微结构,首先利用荧光显微镜定位了GFP标记的TGN相关蛋白,然后使用透射电镜观察了在切片中有荧光标记的TGN囊泡,确定其超微结构,发现TGN亚群确实存在异质性,为今后研究植物TGN结构与功能的关系提供了基础。
4.4 植物免疫研究
植物在长期的进化过程中,形成了抵抗病原菌和昆虫的能力,刺激或强化植物的免疫系统,可以提高植物对病虫害的抗性。此外,植物与其生长环境中的微生物关系密切,形成了植物-微生物共生体系,植物影响着周围和体内的微生物群落,微生物也通过生命活动影响植物的生长发育。光镜和电镜的使用促进了植物免疫研究的进程。其中,电子显微镜特有的高分辨率,在植物病害检测,超微结构及形态观察中发挥了重要作用[66]。
植物在与昆虫长期相互作用过程中,进化出了抵抗昆虫的能力。麦二叉蚜在小麦叶片上的取食部位会形成坏死点,周围会出现褪绿光晕。这种相互作用的植物组织学特征虽然在很早之前就开始研究,但分辨率及观察技术受到限制,机制尚不清楚。Ledford等[67]利用光学显微镜和扫描电镜,观察了小麦叶片横截面上的纹状体鞘和组织损伤。在光镜下,发现填充蚜虫损伤的外层维管束鞘细胞管腔的单一物质为黄褐色,通过扫描电镜进一步发现,它可能是聚合体。这种物质的后续化学鉴定可能会揭示蚜虫与敏感小麦组织之间相互作用的本质,为植物和昆虫相互作用中涉及的三维关系提供更加清晰的证据。
植物还参与微生物互作。Lucas等[68]利用CLEM研究了根瘤菌对豆科植物的定植过程,通过光学显微镜,可以看到植物中有细菌定植和未定植两类细胞,细菌未定植的细胞中,几乎没有荧光信号或仅有几个荧光“斑点”,这类细胞中通常含有大液泡。聚焦离子束扫描电镜结果证明了荧光信号与细菌的有无或大液泡的存在与否直接相关,这为研究植物和细菌相互作用关系提供了方案,同时为大体积样品的研究提供了借鉴。细胞器间的联系对于先天免疫反应至关重要,参与了病原体防御过程。叶绿体作为防御素分子的主要产生场所,在防御过程中如何与其他细胞器进行沟通和协调,人们还知之甚少。Caplan等[69]发现植物在进行先天免疫或应答外源防御信号过程中,叶绿体会产生动态的延伸小管,即基质小管,在细胞核周围有大量的基质小管存在。运用共聚焦和透射电镜图像叠加确定了叶绿体到细胞核连接的位置和类型,揭示了基质小管有助于将防御信号放大和/或传输到细胞核和其他亚细胞结构。近来,Liu等[70]利用荧光显微镜、二次离子质谱、X射线光电子能谱以及扫描电子显微镜,首次对于短柄草及其与典型的促植物生长细菌Pseudomonas SW25间的相互作用进行了关联成像,为揭示植物-微生物复杂相互作用提供了策略,有助于预测和调控根际相互作用。
5 展望
CLEM结合了不同类型的光镜和电镜,实现了各自成像优势的叠加,能够同时获得光镜下定位信息和电镜下高分辨结构信息。该技术具有一系列优势:首先,超分辨率荧光显微技术的出现,突破了传统光学显微镜的分辨极限,同时,电子成像技术种类也越来越丰富,观察结果更清晰和深入;其次,冷冻技术的出现,样品处理更接近真实状态,也有益于保护荧光基团,使原位细胞结构成像成为可能;最后,探针种类的改进使光镜和电镜之间的关联成像更容易,这些技术的进步都极大地促进了CLEM的应用。但是,要做到准确的光电关联需要平衡可见视场与分辨率、荧光基团的保护与电子衬度、成像速度与体积、样品大小与真实状态的保存,成像时间以及图像分辨率等之间的关系。CLEM的发展迅速,但依然面临很大挑战。一方面要尽量减少由辐射损伤和光电转换造成的伪影;另一方面,仍需要进一步改进探针和包埋树脂,以尽可能在电镜制样中保存荧光基团的发光特性,实现光镜电镜直接成像。伴随着冷冻光电关联显微技术的发展,冷冻条件下具有更高定位精度的荧光探针的选择与优化仍具有很大的空间。此外,CLEM制样相对耗时且较难,急需优化样品准备与光电转换的流程,提高可重复性。
对于植物而言,其组织样本比较厚,细胞体积较大,其厚的细胞壁阻碍了固定液的进入。高压冷冻技术可以用于冷冻固定比较厚的样品,考虑到植物样品富含水份的大液泡常常由于得不到彻底冷冻而形成冰晶,可以通过使用葡聚糖冷冻保护剂,实现对于植物样品的较好固定。随后进行冷冻切片并在冷冻荧光显微系统中成像、冷冻电镜下观察,或者冷冻替代后制备常温样品,进行常温下光电成像实现光电关联。光电关联显微镜技术利用荧光成像实现目标生物大分子的特异性标记和定位识别,利用电子显微镜实现定位区域的精细解析,有助于在更多尺度和更加动态的水平探究植物生物学问题。借助CLEM,目前已经实现了精确分析植物亚细胞结构与特定结构、准确确定蛋白质亚细胞定位,明确TGN囊泡的异质性,并且为植物与病原微生物和昆虫的互作提供了直接清晰的证据。科技的发展日新月异,近来冷冻超分辨光电关联技术、超低温超高分辨率荧光显微镜关联聚焦离子束扫描电子显微镜技术等在动物细胞研究中取得了长足的进展,相信随着未来CLEM的改进,这些技术有望应用于植物细胞,极大地促进植物生物学的发展。

