代谢组学在肿瘤药物靶点筛选中的应用进展
吴玉苹 周勇 蒲娟 李会 章金刚,4 朱艳平
(1. 新乡学院生命科学与基础医学学院,新乡 453003 ;2. 中国农业大学动物医学院,北京 100193 ;3. 北京市疾病预防控制中心食物中毒诊断溯源北京市重点实验室,北京 100013 ;4. 军事医学科学院野战输血研究所,北京 100850)
代谢(metabolize)是生物体所有生物化学反应的总称,代谢活动是生物体维持生命的物质基础。代谢组学(metabolomics)是指将某一生物体系(如细胞)受刺激或扰动前后(如疾病、药物、基因变异或者环境改变)所有代谢产物图谱进行比对,筛选出生物体内小分子物质(molecular weight,M.W.<1 000)的差异及其动态变化从而研究生物体系的代谢网络技术[1-2]。代谢组学作为系统生物学的终端,研究系统生物学的终端表型呈现,具有比较明显的优势,不但容易检测、分析和鉴定,而且易通过结合生物样本代谢物和代谢通路分析,系统地揭示机体生理病理状态。
肿瘤(tumor)是一种多因素参与造成机体各系统功能平衡紊乱的复杂疾病,肿瘤组织不仅需要葡萄糖持续不断的供能,还需要氨基酸合成蛋白质。肿瘤代谢重编程是其重要特征之一[3],肿瘤细胞中能量调节机制及能量相关的氨基酸、核苷酸与脂类代谢都发生了变化,其代谢谱与正常组织细胞存在明显差异。运用研究“代谢指纹图谱”的代谢组学(metabolomics)技术,可以揭示肿瘤或药物引起的宿主内源性代谢物的变化,发现肿瘤感染发展进程中所需的最重要的代谢通路,为肿瘤药物靶点的筛选提供了可能。本文在简要介绍了代谢组学在筛选肿瘤药物靶点流程的基础上,重点论述了代谢组学在肿瘤药物靶点筛选各个领域中的应用。
1 代谢组学筛选肿瘤药物靶点的流程
代谢组学是20世纪90年代中期在多种物理化学和分析化学基础上发展起来的一门新学科,主要由数据采集平台和数据分析平台构成(图1)。数据采集的技术平台包括核磁共振(nuclear magnetic resonance,NMR)和质谱(mass spectrometry,MS),近年来超高液相色谱-飞行时间质谱(ultra-high performance liquid chromatography coupled with a quadrupole time-of-flight mass spectrometry method,UHPLCQTOF/MS)联用技术由于具有高灵敏度、高分辨率、质量范围宽、更精确的分子质量信息等特点,现已在代谢组学研究中得到了广泛的应用[4]。代谢组学是一种相对快速、准确的技术用于揭示生物系统的新知识,因此在生命科学领域正成为一种越来越受欢迎的工具[5],在药物发现过程中代谢组学亦成为关键学科[6]。
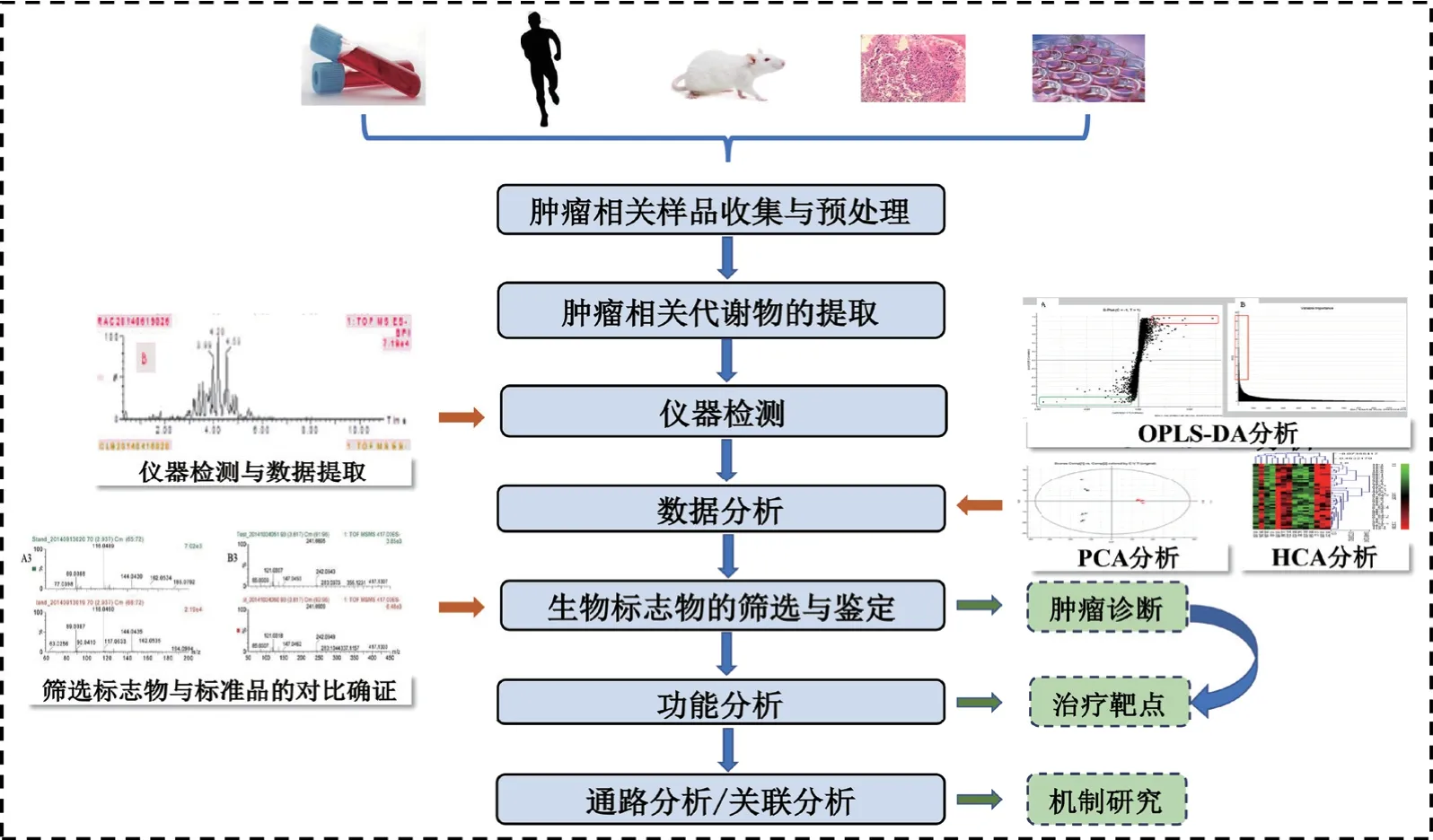
图1 代谢组学在肿瘤领域的应用Fig.1 Application of metabolomics in the field of oncology
代谢物作为基因和蛋白表达的下游产物,已证实在肿瘤或癌症发生时其水平发生变化[7]。代谢变化被公认为监测疾病进展和揭示有效治疗干预的新分子靶点的关键标志之一[8]。肿瘤是代谢性疾病的理念越来越被人们所接受[9]。肿瘤微环境(tumor microenvironment,TME)在肿瘤进展中扮演重要角色,很多关键的促肿瘤信号通路最终是通过适应肿瘤细胞的代谢而发挥作用,所以深入研究肿瘤代谢特点[10]、尤其是其能量代谢特点与代谢水平变化特点[11],不但对癌症的早诊断具有重要意义,还可进一步揭示相关调控机制,为肿瘤个体化治疗即精准医疗策略以及新的靶向药物研究提供理论依据和契机,尤其是为药物发现过程和个体化医学如何应用开辟了一个新的方向[12]。肿瘤中发生的代谢重编程可以通过代谢组学准确而迅速地检测出来,从而为开发针对代谢的肿瘤治疗提供重要的依据[13]。近年来,代谢组学在肿瘤领域应用广泛[14-15],其研究流程如图1所示,主要应用于筛选肿瘤生物标志物、肿瘤相关机制研究和靶向药物筛选等3个领域当中[14]。近年来在诸如肝癌、肺癌、胰腺癌、结直肠癌[16]、口腔癌[17]等癌症中广泛应用。鉴于肿瘤代谢重编程在肿瘤发展中的关键作用,靶向肿瘤细胞代谢已成为国际上抗肿瘤药物研发的热点之一。
2 代谢组学在能量代谢中筛选肿瘤药物靶点的应用
细胞癌变的本质是细胞信号转导通路的失调导致的细胞无限增殖,代谢重编程是其重要特征之一,肿瘤药物的研发焦点正从传统细胞毒药物到针对肿瘤细胞内异常信号的特异性新一代抗肿瘤药物的转变。特异性抗肿瘤药物的筛选是针对于正常细胞和肿瘤细胞之间的差异,重点表现在糖代谢、氨基酸代谢、脂代谢等能量相关的代谢重编程。能量代谢重新编程是肿瘤的重要特征之一,此过程涉及到葡萄糖、氨基酸、脂类以及各种酶类,涉及的代谢物量大而广,而代谢组学的高通量特性使其成为肿瘤药物筛选或跟踪药物疗效的理想选择[18](图2)。
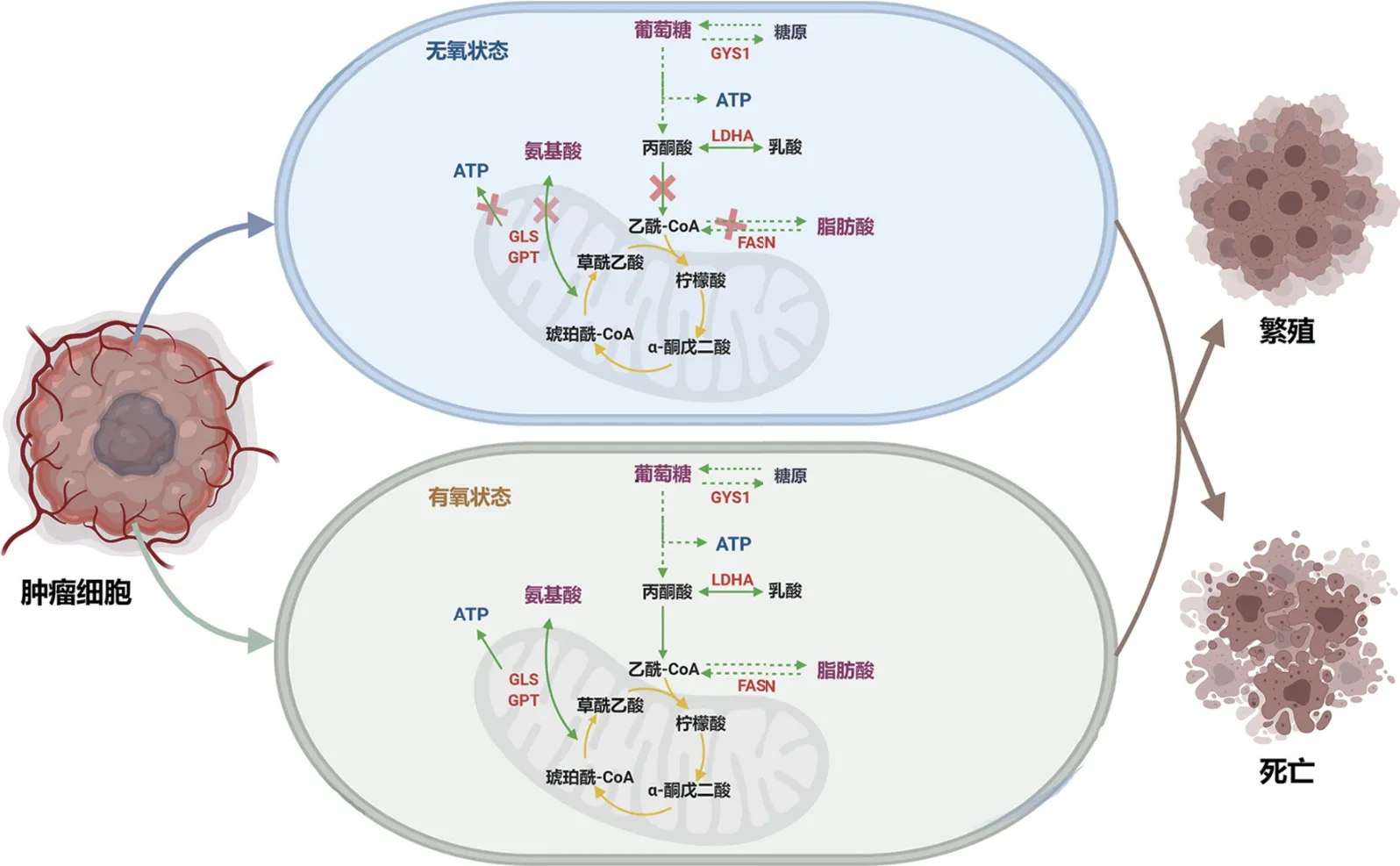
图2 肿瘤细胞的代谢Fig.2 Metabolism of tumor cells
2.1 代谢组学在糖代谢中筛选肿瘤药物靶点的应用
奥托·海因里希·瓦尔堡(Otto Heinrich Warburg)在20世纪50年代发表了一项重要假说,认为癌细胞依靠厌氧代谢作为能量来源,即使在生理氧存在下也是如此[19]。即肿瘤细胞在氧充足的条件下仍偏好于采用糖酵解方式进行葡萄糖代谢提供能量,该代谢方式称为有氧糖酵解,即为“瓦氏效应(Warburg effect)”,是肿瘤细胞特有的代谢方式[20]。一切细胞包括癌细胞的代谢都需要三磷酸腺苷(ATP)作为能量传递的“分子通货”。葡萄糖及氨基酸是细胞重要的能量来源,癌细胞在缺氧状态下,两者生成ATP均离不开乳酸脱氢酶A(lactate dehydrogenase A,LDHA)、谷氨酸转氨酶(glutamic transaminase,GPT)、 谷 氨 酰 胺 酶(Glutaminase,GLS)等酶的参与,癌细胞代谢途径中的各个关键点均可能成为新的治疗靶点。抑制糖原合成酶1(glycogen synthase1,GYS1)可通过降低糖酵解通量,从而使得肿瘤细胞生长受到抑制,故GYS1有望成为治疗肿瘤的新的治疗靶点[21]。
肿瘤代谢重编程特别是对有氧糖酵解的依赖性增加,使得能量代谢中的糖代谢一直是科研工作者的关注重点。Bhanot等[22]基于非靶向代谢组学技术,利用多种酪氨酸激酶抑制剂对白血病癌细胞株进行处理,发现癌变髓细胞内与糖酵解、三羧酸循环、糖原合成等能量代谢相关的内源代谢物显著改变,其中糖原合成前体UDP-D-葡萄糖水平在癌变细胞株内异常升高,进一步研究表明,肿瘤细胞代谢重编程依赖糖原合成途径,进行能量储备,这一研究为寻找白血病药物靶点提供了科学依据。肿瘤能量代谢中的独特的“Warburg effect”通过限制丙酮酸通量进入线粒体氧化代谢,使癌细胞避免线粒体呼吸产生过多的活性氧(reactive oxygen species,ROS),从而提高细胞死亡抗性和转移的能力,而线粒体氧化代谢是一种重要的转移抑制因子,该研究证明了代谢治疗对预防/干预肿瘤转移的潜在作用[8],可作为肿瘤药物的靶标。
2.2 代谢组学在氨基酸代谢中筛选肿瘤药物靶点的应用
肿瘤细胞氨基酸代谢途径的改变往往由多种信号通路和转录因子共同驱动,靶向肿瘤细胞代谢途径中的关键点如氨基酸、核苷酸等的代谢,可开发新型抗肿瘤药物。Gao等[23]利用非靶向代谢组学技术,对神经胶质瘤样本进行了研究,结果发现瘤组织中的亚牛磺酸含量显著高于癌旁对照组织。细胞内亚牛磺酸的含量升高可促进肿瘤的发生发展,由于细胞内亚牛磺酸的合成以胱氨酸为前体物质,而胱氨酸需通过胱氨酸/谷氨酸反向转运体的转运才能进入细胞,抑制该转运体可以阻断亚牛磺酸的生物合成,从而抑制肿瘤细胞的增殖和侵袭,因此,胱氨酸/谷氨酸反向转运体可能可以作为治疗神经胶质瘤的潜在靶点。Zhu等[24]建立的超高效液相色谱-串联质谱(ultra-high-performanceliquid chromatography-tandem mass spectrometry,UHPLCMS/MS)代谢组学方法同时快速定量分析了癌细胞的20种最具差异的内源性核苷和核苷酸,发现这些差异代谢物可作为癌症筛选药物靶点。限制蛋氨酸(methionine restriction,MR)是一种重要的氨基酸,可以通过控制和重复改变一种碳代谢来影响癌症的预后。膳食MR可与5-FU协同作用而抑制大肠癌肿瘤生长,破坏核苷酸代谢和氧化还原平衡[25]。Gao等[25]利用代谢组学检测了膳食MR在小鼠和人类中诱导的特异性代谢谱,发现肿瘤细胞通过单碳代谢影响氧化还原和核苷酸代谢的通量,从而揭示了MR与抗代谢药或辐射干预相互作用的治疗机制。这项研究进一步确立了饮食干预在更广泛的环境中如何影响癌症预后的原则。
如果一个代谢产物被鉴定为病因,且其生物合成通路是已知的,那么通常药物的靶标就是与其相关的某种酶。许多有效和市场较好的药物均是酶的抑制剂,并且大量代谢酶的抑制剂或抗代谢药物是已知的,如具有抗癌活性的ML-210物质是谷胱甘肽氧化酶4 抑制剂[26]。随着生物学和医学的发展,免疫疗法在癌症治疗领域接连取得重大突破,尤其是以PD-1/PD-L1免疫检查点抑制剂为代表的癌症免疫疗法的出现,可以说是彻底改变了癌症治疗格局,然而,如头颈部鳞状细胞癌等一些癌症的免疫疗法难以产生良好的反应,因此迫切需要更有效的治疗方法。2021年王存玉院士团队研究了一种能够在头颈癌中起关键作用的酶KDM4A特异性的酶抑制剂,可以通过改善小鼠模型中的免疫疗法并减缓肿瘤的生长,并增强PD-1抑制剂的免疫治疗效果,从而提高了头颈部鳞状细胞癌免疫疗法效果[27]。
2.3 代谢组学在脂质代谢中筛选肿瘤药物靶点的应用
肿瘤代谢重编程是肿瘤主要特征之一,其中脂代谢的解除管制是一个突出的领域,靶向异常脂质代谢是一种新兴的靶向肿瘤干细胞的治疗策略。针对涉及肿瘤干细胞脂质代谢的关键调节因子的治疗策略,证明了开发针对肿瘤细胞的脂质代谢的新的治疗方法的潜力[28]。流行病学研究表明,高脂肪饮食在前列腺癌(prostatic cancer,PCa)进展中起重要作用。肿瘤脂质是侵袭性PCa的潜在驱动因素,前列腺癌患者的脂质代谢在合成、摄取和氧化方面发生了改变,以支持生长和对内分泌疗法的抵抗。靶向脂质代谢使肿瘤对内分泌治疗重新敏感提供了新的机会[29]。Camarda等[30]利用靶向代谢组学方法发现,脂肪酸氧化(fatty acid oxidation,FAO)中间体在癌基因转录因子myc驱动的三阴性乳腺癌模型中显著上调。结果表明,myc过表达的显示对FAO的生物能量依赖增加,并确定抑制FAO作为对这一乳腺癌亚群的潜在治疗策略。
脂质代谢中代谢酶的抑制剂也是靶向药物开发的研究方向。前列腺癌进展的一个标志是脂肪酸合酶(fatty acid synthase,FASN)过表达导致脂质代谢失调,FASN是脂肪酸合成的关键酶,转移性去势抵抗性前列腺癌(metastatic castration resistant prostate cancer,mCRPC)的代谢特征是从头脂肪生成的上调,为转移性扩散提供底物和能量。mCRPC通过多种机制对雄激素受体信号传导抑制剂产生耐药性,Zadra等[31]利用非靶向代谢组学结合脂质组学与生物技术,使用FASN抑制剂(如IPI9119物质)通过代谢重编程拮抗mCRPC的生长,为mCRPC的耐药治疗提供了机会,并提供了一种克服雄激素受体抑制剂耐药性的思路。
肿瘤细胞通过调节多种代谢途径抑制自噬或凋亡促进自身的增殖和生存[32]。这些代谢途径与促癌激活因子和抑癌因子密切相关[33-34],也可作为筛选药物的重要参考因素。Lu等[35]基于UHPLC-QTOFMS的代谢组学方法以药物Natrin对人肝癌SMMC-7721细胞凋亡的诱导作用为研究对象,筛选出与Natrin诱导的SMMC-7721细胞凋亡相关的13种潜在生物标志物,经过代谢通路分析发现,鞘脂代谢、脂肪酸合成代谢受影响最大,表明Natrin通过升高线粒体通路中Bax/Bcl-2的比值诱导肝癌细胞凋亡,揭示了Natrin可以作为治疗肝癌的靶点药物。
3 代谢组学在揭示耐药性肿瘤的耐药机制及筛选药物靶点中的应用
肿瘤细胞对化学药物的耐药性增加了肿瘤治疗的难度,通过研究下游代谢产物的变化不但可以揭示肿瘤耐药机制[36],还可以将代谢治疗运用到预防或干预肿瘤转移。近年来代谢组学在耐药性癌症的药物筛选中的应用也日渐广泛。Wang等[37]通过对人类乳腺癌研究揭示了脂质代谢调控癌症干细胞和化疗药物耐药的机制。他们发现JAK/STAT3调控脂质代谢能够促进乳腺癌干细胞(Breast CSCs,BCSCs)增殖以及癌细胞耐药,抑制JAK/STAT3能够阻断BCSC的自我更新以及抑制许多脂质代谢基因如CPT1B的表达,而CPT1B是负责编码脂肪酸β氧化(FAO)重要酶的基因。乳腺脂肪细胞来源的瘦素能够上调STAT3诱导的CPT1B的表达以及FAO在BCSCs中的活性,确定了BCSC通过STAT3-CPT1B-FAO信号通路从而耐药。Sun等[38]利用代谢组学研究了木兰花碱对前列腺癌细胞22RV1的增殖有明显抑制作用,并筛选出12个细胞代谢生物标志物分别可以抑制前列腺癌细胞的增殖,木兰碱可以显著影响这些代谢生物标志物,干扰前列腺癌细胞22RV1的生长和增殖。这些生物标志物与肿瘤细胞的能量代谢、氨基酸代谢和脂肪酸代谢等多种代谢途径密切相关,其中大部分与营养和能量代谢有关,最终运用细胞代谢组学确定了木兰碱对前列腺癌的调控途径和靶点。2018年,Ma等[39]基于超流动液相色谱联用四极飞行时间质谱(ultra flow liquid chromatography coupled with quadrupole time of flight mass spectrometry,UFLC-QTOF-MS) 代 谢 组学方法研究了番荔枝内酯类化合物(annonaceous acetogenins,ACGs)对多重耐药乳腺腺癌细胞潜在作用,发现通过影响精氨酸和脯氨酸、甘油磷脂、牛磺酸和次牛磺酸、丙氨酸、天冬氨酸、谷氨酸、D-谷氨酰胺等ACGs的代谢可调控乳腺癌的发展,揭示了ACGs可以作为治疗乳腺癌的靶点药物。
不同于传统细胞毒性药物选择性差、毒副作用强、易产生耐药性等特点,靶向代谢组学的肿瘤药物可达到高选择性、低毒性的治疗效果,对肿瘤的治疗尤其是克服其耐药性具有重大意义。系统生物学中的组学方法不但对肿瘤靶向药物的筛选发挥举足轻重的作用,在筛选病毒性疾病如新冠肺炎靶点药物中也发挥着重要作用[40]。
4 挑战与展望
代谢组学作为筛选肿瘤药物的手段虽具有高灵敏度、高分辨率、质量范围宽、更精确的分子质量信息等优点,但现有技术在样品前期处理、数据采集质量和数据解析方面仍存在很大瓶颈。采集数据前期首先都需要提取代谢物,期间很多代谢物会损失掉,即代谢物的覆盖度有限;其次代谢组的数据分析作为代谢组学中非常重要的部分,需要调整很多参数,再用统计学分析来确定到底哪些代谢物发生了变化,这需要有经验的分析员才可以做,限制了其推广;再者非靶向代谢组学筛选到大量的未知结构代谢物,在现有的数据库中难以匹配,对其结构的解析和鉴定是一个漫长的过程,极大地阻碍了其应用与发展;代谢组学分析技术与操作条件的多样性,也使得大量产生的数据无法共享,随着科学技术的发展,有望完善并标准化代谢组数据,并建立公共数据库实现数据共享。同时,代谢组学为系统生物学所提供的信息仅限于代谢物,还不足以解决全面复杂的生物学问题,需结合多组学的全面研究,整合各种高通量的组学数据,构建代谢网络,与动物模型相结合收集数据,在生物学水平上进行分子功能学验证,才能最终在阐明生命活动及生理病理机制、发现前景良好的药物靶点等方面发挥重大作用[41]。
肿瘤代谢重编程是20世纪80年代后感染生物学领域研究的热点与难点。随着肿瘤生物学及相关学科的飞速发展,人们逐渐认识到细胞癌变的本质是细胞信号转导通路的失调导致的细胞无限增殖,肿瘤药物的研发焦点正在从传统细胞毒药物转移到针对肿瘤细胞内异常信号的特异性新一代抗肿瘤药物。肿瘤代谢重编程部分取决于TME[42]。免疫治疗药物是当今抗肿瘤药物研究中最热门的领域,特别是小分子激酶抑制剂和单克隆抗体的成功引进为肿瘤患者尤其是癌症患者带来了福音。但由于免疫抑制TME整体代谢状况对肿瘤进展和治疗耐药有重大影响[43-44],如TME重新编程不足,从而限制了抗肿瘤免疫的恢复。肿瘤浸润的免疫细胞通常会由于肿瘤细胞代谢活动紊乱而经历代谢应激,从而导致抗肿瘤免疫反应受损。因此,重新定位靶向癌症代谢的药物可能通过TME的代谢重编程协同增强免疫治疗[45],这些是开发新型抗癌药物的有希望靶点。

