农药残留检测关键用酶固定化研究进展
朱永安 王淼 曹静 喻鹤 曹振 金茂俊 王静 佘永新
(中国农业科学院农业质量标准与检测技术研究所 农业农村部农产品质量安全重点实验室,北京 100081)
在农药的使用保障了我国粮食稳定生产的同时,不合理和过量的施用也引起了农药残留超标的问题,残留的农药及其代谢物可以通过富集作用在食物链中不断传递、迁移,从而对农产品质量安全、生态环境造成不良的影响,进而危害人类健康[1]。
为了对农产品中农药残留进行检测,常规的仪器检测方法往往检测时间较长,且成本较高,并不适用于实际生产经营过程中农产品的快速检测。酶抑制法作为一类快速筛查方法,可以对农药残留进行快速检测,其中最关键的步骤是农药残留对酶的抑制效果的分析,但是游离酶由于稳定性差且在有机溶剂环境下不耐受,而固定化酶可以改善游离酶的缺陷,将酶固定于载体上,同时保留一定的催化活性。本文重点论述了固定化技术、载体及产品在农药残留检测中的应用,为今后农药残留检测固定化酶研究提供一定思路和方法。
1 酶的固定化技术分类
1.1 吸附法
吸附法是利用物理方法,将酶固定于载体上,可分为离子吸附、亲和吸附及物理吸附。物理吸附是最常用的,通过氢键、范德华力、疏水相互作用将酶吸附在载体的表面[2]。例如Tallita等[3]将碱性磷酸酶(ALP)以物理吸附的方式固定在聚合物改性电极上制成的电化学传感器可以用于检测4-硝基酚(4-NP)。
1.2 包埋法
包埋法是将酶固定在聚合物材料的网格结构或微囊结构等多空隙载体中。用于包埋的载体一般是壳聚糖、聚丙烯酰胺、琼脂、海藻酸钙等。该方法可以降低酶的渗出,同时酶与载体之间无化学键连接,保持了酶构象的稳定。然而,底物与酶反应时,会因为包埋结构的特殊性导致底物无法通过保护层而与酶进行反应,这是目前包埋法固定酶的主要缺点之一。同时,仅以物理方法包覆酶可能导致酶的负载效率低[4]。
应用较为广泛的包埋法是溶胶-凝胶法,Du等[5]用正硅酸乙酯和纳米金颗粒(GNPs)制成了用于包埋酶的溶胶-凝胶复合材料,将乙酰胆碱酯酶(AChE)包埋其中制成生物传感器,对有机磷农药进行检测。在抑制率10%时久效磷的检出限为0.6 ng/mL,且具有良好的重现性和稳定性。
但由于溶胶-凝胶法包埋过程中酶容易失活[6],因此一些新的包埋技术也被逐渐研究,江南大学孔军等[7]在研究酶的固定化时发明了一种新的包埋技术,以缺陷型酿酒酵母孢子微胶囊将酶固定化。该方法利用基因工程技术将酶以包埋法形式固定,对比溶胶-凝胶法,可以减少因包埋过程中引入有机溶剂对酶活性造成的损失。
1.3 共价结合法
由于酶的表面存在很多游离基团,如羧基、氨基、巯基等可以与载体表面基团发生化学反应生成共价键,以此原理固定化酶的方法为共价结合法。AChE上含有氨基,因此Khaldi等[8]将单晶硅表面羧基化后,通过酰胺键将AChE共价连接至羧基端。Tallita等[3]同样将电极上的羧基活化后,与碱性磷酸酶(ALP)以形成酰胺键的方式进行固定化,制成的电化学传感器可对有机磷农药进行灵敏检测。
另外还有研究者利用酶表面的羧基进行固定化,Jiang等[9]将胶体金纳米颗粒和重氮树脂固定于对氨基苯磺酸修饰后的玻碳电极表面,形成基质复合膜,用于乙酰胆碱酯酶的固定。类似的基于形成化学共价键的方式固定化可以使酶与载体结合紧密,不易从载体表面脱落。但是由于酶与载体以共价键结合后可能会导致酶的空间构象发生变化,对酶活会造成不同程度的损失。因此以共价结合法固定酶时应该考虑到该缺陷。
1.4 交联法
交联法是利用交联剂与酶蛋白进行交联,通过形成稳定的三维交联网架结构将酶固定。如果交联的是相同的官能团,则被称为同双功能交联剂,例如戊二醛。若交联剂连接的是不同的基团则该种交联剂被称为异双功能试剂[10]。
交联法固定化酶中,戊二醛试剂[11]被广泛使用。毛罕平等[12]使用戊二醛将AChE交联在纸制微流控系统中用于检测对硫磷,检测线性范围在1.0×10-7-1.0×10-5g/mL内,检出限为3.3×10-8g/mL。与其它固定化酶方法相比,戊二醛在交联酶时用量较大,当用量大于一定阈值后会使酶失活。Sun等[13]用戊二醛作为交联剂,采用交联法和溶胶-凝胶包埋法两种不同的固定化方法将AChE固定在壳聚糖膜上,结果表明用戊二醛作为交联剂固定化酶的活性明显低于溶胶-凝胶包埋法。所以采用交联法固定化酶时需要优先考虑交联剂的类型是否会对酶造成毒害作用。
1.5 氨基酸置换法
利用对蛋白质进行定点诱变的基因工程技术可以直接改变酶的性质,这种蛋白质性质的变化还可以用于酶的固定化,提高酶的催化性能[14]。即在酶蛋白上合适位点,置换某个氨基酸,突变后的酶蛋白通过该突变氨基酸特殊的侧链基团控制固定酶的方向。Li等[4]通过迭代饱和诱变(ISM)方法筛选得到催化活性最高的甲基对硫磷水解酶(MPH)突变产物,实验证明突变酶可以对甲基对硫磷进行高效地水解,以诱变方法得到突变酶的思路可以借鉴到对农药残留检测当中。但关于这方面的报道还较少,需要进一步研究其实用性。
1.6 生物素-亲和素亲和法
生物素-亲和素亲和法基于生物素与亲和素高效专一性、极强的亲和力可以把酶蛋白与生物素结合成融合蛋白以后,再将融合蛋白固定在亲和素包被的材料中。Zhang等[15]制备了一种基于生物素-链霉亲和素耦联合成方法的免疫传感器用于检测细胞因子IL-6的浓度变化,与共价结合方法相比,该方法可以增加固定在载体表面的抗体数量,使免疫传感器的检测灵敏度达到0.1 pg/mL,检测的线性范围在0.4-400 pg/mL间。
2 酶的固定化载体
2.1 无机载体
无机载体主要是指利用二氧化硅、黏土材料等作为基质复合形成的固定化材料,这类材料具有孔隙率大、无毒、绿色等特点,但缺点在于作为单一基质其稳定性不高,需要和有机材料复合形成更稳定的载体。
2.1.1 二氧化硅 由于硅材料具有良好的生物相容性,毒性小,化学性质较为稳定,被广泛用于酶的催化和制造传感器。Yang等[16]采用SiO2作为纳米片(SNS)再结合全氟磺酸(NF)用于修饰玻碳电极(GCE),通过壳聚糖固定AChE,制成了检测有机磷农药的生物传感器,对甲基对硫磷、毒死蜱、克百威具有很低的检出限。然而,以二氧化硅作为载体的固定材料缺点在于在固定过程中酶的定向性较差,在包覆酶的过程中还容易使酶发生变性进而影响传感器的性能[17]。
2.1.2 黏土材料 黏土材料基于其结构和功能特性,可以作为吸附剂用于生物催化过程中。在酶的固定化中常用到的生物纳米复合材料可以由不同的黏土矿物和生物高分子组装形成。研究发现第一种有机-无机混合纳米结构材料便是基于天然硅酸盐合成的,即黏土材料[18]。黏土材料的特定晶体结构与传统的混合材料相比具有一定优势。
2.2 有机高分子载体
有机高分子载体主要分为天然高分子载体和合成高分子载体。天然高分子载体例如壳聚糖、纤维素等具有无毒环保、良好的生物相容性等优点。合成高分子载体则以树脂材料和聚酯型复合材料居多,其优点是机械强度高且物理化学性质稳定[19]。但是合成高分子材料对生物相容性较差,且具有一定的细胞毒性。
2.2.1 天然高分子载体
2.2.1.1 壳聚糖 壳聚糖是一种具有生物相容性、无毒的固定化酶的基质,可以对其进行化学改性,并且壳聚糖易于修饰。将其用作固定化载体,可稳定AChE活性。Patel等[20]将壳聚糖固定的AChE用于食品中残留的有机磷农药检测,在反应前后酶活仍旧维持稳定。此外,壳聚糖通常也与其他固定材料复合以改善壳聚糖对反应环境耐受性较差的缺点。例如Bayramoğlua[21]提出了使用甲基丙烯酸壳聚糖复合材料作为固定化酶的载体,增强了酶的反应环境耐受性,与游离酶(50℃)相比,固定化酶反应温度可以提高至62℃,同时游离酶在反应15 d内全部失活,而采用甲基丙烯酸壳聚糖复合载体的固定化酶在循环使用8次后仍然保留了40%以上的相对活性,可见壳聚糖复合型材料作为固定化酶的基质具有稳定酶反应条件的特点。
2.2.1.2 纤维素 纤维素和壳聚糖同属于多糖类,也具有良好的生物相容性、无毒等特点。伍周玲等[22]采用微晶纤维素为原料制备了双醛纤维素,该材料用作生物传感器中AChE的固定,对敌敌畏的检出限为6.99 ng/mL。以纤维素作为固定化载体成本较低且固定化酶的性质较为稳定,可以提高对酶的负载量,间接提高酶与底物的反应速率[23]。
2.2.2 合成高分子载体
2.2.2.1 树脂材料 溶胶-凝胶法在酶的固定化中应用较为广泛,而树脂材料是溶胶-凝胶合成固定化酶的常用载体。有报道使用了低聚硅氧烷树脂材料结合非水解溶胶-凝胶法将AChE共价固定化,该树脂材料可以使AChE的固定化率达到80%以上,且在一定的pH(5.5、5.8)和相对较高的温度(40℃以上)中,树脂材料固定的AChE活性高于游离酶,固定化酶还增强了的贮存稳定性以及对某些金属阳离子的抑制作用[24]。Li等[25]通过戊二醛将酶固定在NKA-9树脂上,在NKA-9树脂上的负载量为34.4 mg/100 mg,因此树脂材料还可提高酶的负载量。
2.2.2.2 聚酯材料 聚酯材料是用化学方法将有机二元酸和二元醇缩聚合成的纤维,属于高分子化合物。聚酯材料制备的固定化酶载体,由于其化学性能稳定且具有一定的强度,可以使酶的稳定性增强。Gao等[26]通过共价结合的方法将有机磷降解酶A(OpdA)固定在高孔洞的非织造聚酯织物:聚对苯二甲酸乙二醇酯(PET)表面,用于对有机磷农药的降解。固定化酶在酸性环境中仍保持较高的活性,在4℃磷酸盐缓冲液中还可保存至少4周以上。Han等[27]将一种由聚甲基丙烯酸甲酯(PMMA)的单体材料作为固定化辣根过氧化物酶(HRP)的载体。固定化酶在60℃时表现出较强的稳定性,在循环使用6次后,HRP仍然可以保持52%的原活性。虽然聚酯材料的优良物理化学特性可以为酶的催化反应和保存提供稳定的环境,但还要考虑酶在聚酯材料上的兼容性,且目前国内外将酶固定在聚酯材料上进行农药残留检测的相关研究报道较少,须进一步考究其适用性。
2.3 磁性材料
磁性材料作为固定化酶的基质具有更好的稳定酶活的作用,如目前应用较为广泛的基于生物炭或二氧化硅基质包覆的磁性材料,具有低毒、易于回收、清洁高效等特点。在适宜条件下利用二氧化硅包覆的磁性纳米材料在满足核壳均一的前提下,还应尽可能提高纳米颗粒的比表面积,同时制备的磁性材料可以对不同基质进行修饰。Won等[17]报道了一类由Fe3O4磁性无机核、介孔二氧化硅和AChE制成的磁性生物复合材料。该磁性材料用于修饰SPE电极,将对氧磷的检测转化为电信号。用磁性材料制成的传感器具有良好的操作稳定性、重现性和酶活性,对氧磷的检测限在纳摩尔范围。
此外Li等[28]通过Fe3O4@SiO2复合材料包覆AgNPs,成功合成了Fe3O4@SiO2@Ag,该材料具有较大的表面拉曼增强效应(SERS),对福美双的拉曼信号进行检测,其检测限为0.24 ppm。像这样含有两种或者两种以上不同材料包覆的磁性载体具有多种性能,可以对检测信号起到放大作用,将金属纳米粒子包覆在磁性载体上还展现出一定的SERS性能,对于解决检测灵敏度低的问题,提供了良好的借鉴方法。
2.4 介孔材料
介孔材料是一种孔径在2-50 nm的多孔材料,因为其孔径分布较窄,比表面积极高,同时该类材料的间隙结构分布优越,被逐渐用于对各种蛋白质和酶的固定化[29]。最早发现的介孔材料是由氧化硅组成的孔状三维结构物质。之后的研究中也出现了许多非硅系介孔材料。硅系介孔材料如Ji等[30]利用介孔二氧化硅(MSN)为载体制备了酶-抗体结合型免疫传感器,利用硅烷化试剂(GPTMS)将MSN表面功能化后用酶和第二抗体(Ab2)对其进行标记(制备过程见图1),检测时再将信号放大成比色信号。
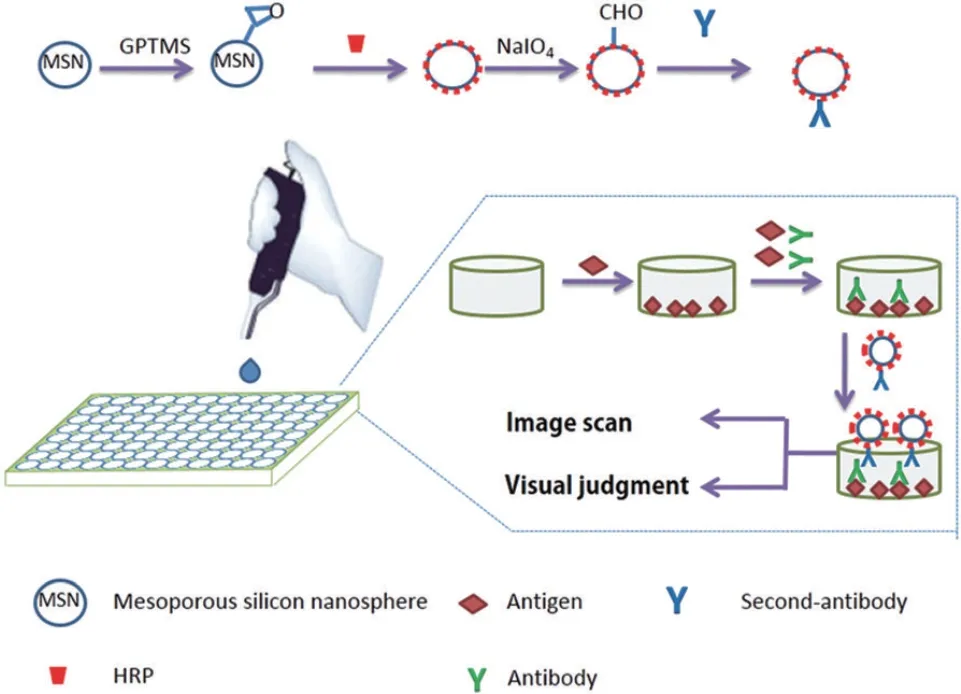
图1 基于MSN载体免疫传感器制备流程Fig. 1 Preparation process of MSN carrier immunosensor
非硅系载体则主要包括磷酸盐、金属氧化物和介孔碳等,与介孔二氧化硅类似,具有高比表面积和纳米孔道结构。Wu等[31]利用非硅系介孔材料——介孔碳(BCs)制备了电化学发光(ECL)传感器用于检测农药阿特拉津(ATZ),对阿特拉津的检出限为0.08 ng/L。
介孔材料虽然都具有高比表面积的特性,可以将固定化酶的负载量提高,但是不同的介孔材料由于其表面化学性质不同,因此对酶固定化过程的影响也大相径庭。而MSN作为固定化酶的载体具有效益高的优点,表面功能化的MSN是介孔材料的首选。
2.5 纳米材料
纳米材料是一类尺寸介于1-100 nm的材料,具有优越的导电性、良好的催化活性及无毒清洁等特点被用于制备生物传感器的重要材料[32]。Quan等[33]采用酶法合成、自由基聚合以及静电纺丝相结合的方法制备了含多碳纳米管(MWCNTs)的丙烯腈共聚物纳米纤维,将多碳纳米管加入后可以增强载体的多孔性,为酶的固定提供了更多结合位点。
纳米材料制备的固定化酶载体除了可以增加材料的比表面积外,将纳米材料表面功能化后还可以控制蛋白质的吸附和定向,增强酶与载体之间的亲和力[34-35]。Yu等[34]通过制备氨基化的多碳纳米管CNT-NH2和羟基化的多碳纳米管CNT-OH,将AChE固定在不同的纳米管上。结果显示更多的AChE吸附在CNT-NH2上,且两种不同带电性的材料都比原始碳纳米管固定的AChE更多。还有研究人员对其他纳米材料进行表面功能化,Mahmoudifard等[36]制备了一种基于表面化学修饰的聚醚砜(PES)纳米纤维膜,用EDC/NHS耦联策略将抗体固定在该纳米纤维膜上。另外无机材料同样可以作为固定化酶的载体,如Mei等[37]用硅酸盐(CuSiO3)制备的载体对酶的负载量为140 mg/g。因此纳米材料由于具有优良的物理性能(高比表面积)及表面功能化后的化学性能(亲和性),使其成为了固定化酶载体的又一选择。
2.6 金属有机框架(MOFs)
金属有机框架(MOFs)作为固定化酶的材料,具有提高酶稳定性和活性,可调节孔径大小以及选择性等特点。以MOFs材料为载体可以通过物理吸附、共价结合、分子自组装等方式将酶固定在其多孔结构中从而赋予了MOFs材料催化性能。合成后的MOFs材料具有选择性和催化活性高的特点[38]。这种基于晶体纳米材料的结构,只需利用特定的固定方法将酶引入MOFs结构中即可[39]。同时,由于金属和配体形成的结构具有拓扑学性质,可以根据需要对载体材料进行设计[40]。因而MOFs作为固定化酶的载体具有很好的前景。
Cai等[41]提出了基于金属有机框架和大孔树脂将酶固定化的一种方法,将酶封装到沸石咪唑骨架-8(ZIF-8)中,然后通过物理吸附进一步与大孔树脂D101结合形成金属有机框架复合材料CAL-BZIF-8@D101,经过10次循环使用后相对酶活仍保留了84.20%。
但以MOFs材料作为固定化酶的载体还存在不足之处,在固定化时酶容易渗漏,且底物与酶的作用不紧密,在MOFs材料中酶和底物的接触因为框架结构的大小而被限制。而利用微流控技术合成的缺陷型MOFs,可以使底物与酶的接触面积增大,从而提高了酶的活性[42],其原理如图2所示。
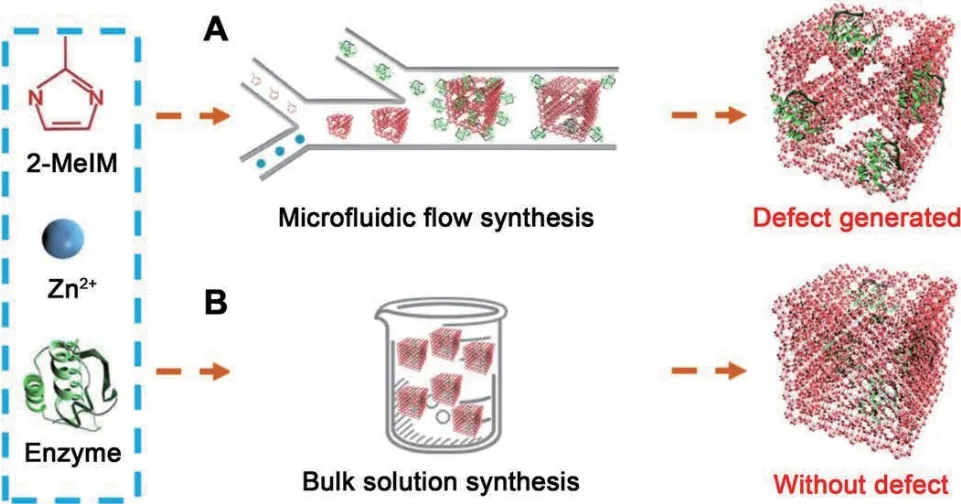
图2 缺陷型MOFs合成过程Fig. 2 Synthesis process of defective MOFs
除了使用缺陷型MOFs材料以外,南开大学陈瑶研究员团队对MOFs材料固定化酶则采取了一种新的思路来解决因为MOFs材料狭窄孔道造成的酶催化效率低的问题。该方法将酶用一锅法固定于MOFs材料中后再包覆COFs外壳,最后在温和的条件下将MOFs降解[43],依靠COFs宽阔的孔径使底物与酶充分接触,该方法见图3。

图3 三步法制备COF胶囊结构Fig. 3 Preparation of COF capsule structure by three-step method
MOFs载体具有较大比表面积和孔隙率可以为酶的固定提供更多结合位点,含有的金属离子还可以提高电子转移性能而增强检测时的电信号,其在农药残留检测中的案例见表1所示。
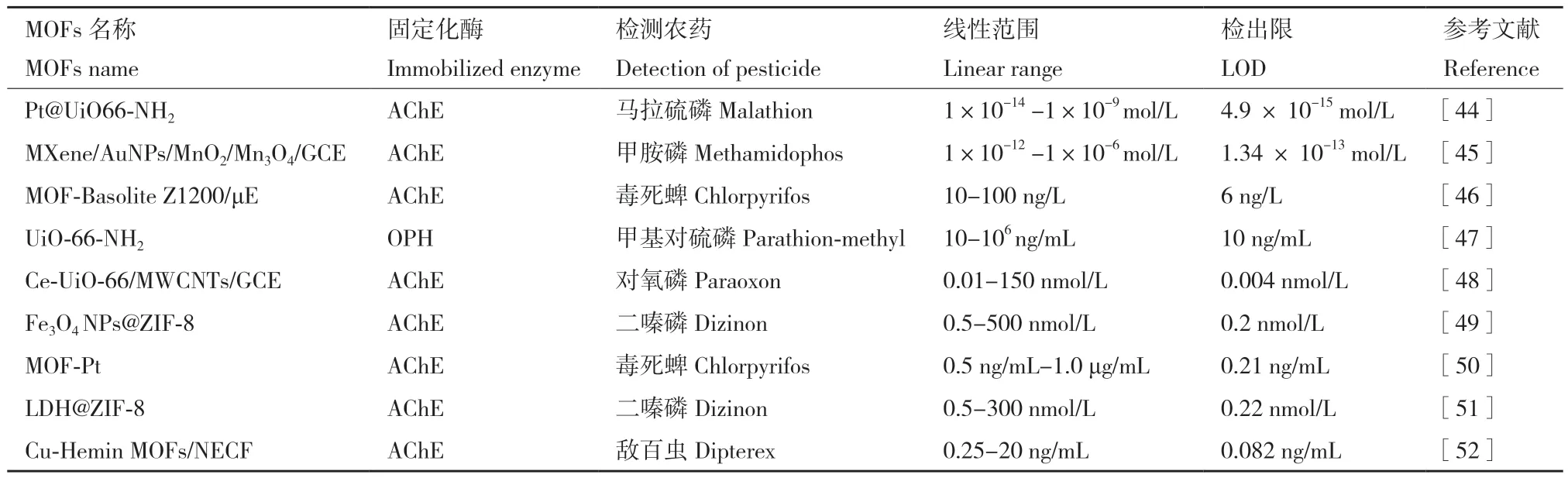
表1 不同类型MOFs载体检测性能比较Table 1 Comparison of detection performance of different types of MOFs carriers
3 固定化酶产品在农药残留检测中应用
固定化酶技术的实际应用除了常见的试纸条和速测卡,还有微流控系统和生物传感器等,由这几类检测技术开发的产品在快速农药残留检测中发挥了重要作用,是农产品农药残留筛查、监管和防控的科学工具,为消费者食用安全提供了一定保障。
3.1 试纸条
农药残留检测试纸条是常见的一种快速检测产品。试纸条制备的常见方法是将酶固定在载体膜片上,然后固定于底板中。将样品滴在膜片上后加入底物进行显色,由于存在一定的农药残留会使酶活受到抑制,底物不能完全水解,因而显色程度浅。根据此原理,广州绿洲生化科技有限公司基于国标方法[53]生产的天福牌农药速测卡可以在15 min内对果蔬中有机磷农药和氨基甲酸酯类农药残留进行快速检测,对呋喃丹、敌敌畏等农药的最低检出限小于0.5 mg/kg。
3.2 微流控系统
由微型制造分析设备与集成组件构成的全微型分析系统又称为微流控系统。微流控系统由于可移植性,样本、试剂消耗低,废弃物生成少,低运营成本和高效率等优点,逐渐引起了人们的关注。由微流控系统制成的产品可以对现场进行快速、准确的农药残留检测,杭州霆科生物科技有限公司生产的微流控农药残留快速检测系统只需将样品滴入14通道微流控芯片后,结合便携式分析仪便可以在10 min内同时检测多种基质的农药残留[54],对目标农药的检测具有较高的特异性和可靠性。
3.3 生物传感器
生物传感器是一类将生物信号转为电信号的高灵敏度传感器,主要包括比色生物传感器、电化学生物传感器、荧光生物传感器和基于拉曼光谱的生物传感器等[32],生物传感器具有更简便的操作方法和更高灵敏度的检测效果,被运用至众多食品和农产品检测中。常见的生物传感器如电化学生物传感器,通过固定在电极上的酶和底物反应前后产生的电流信号变化得出酶被抑制的程度,抑制程度和农药浓度在一定浓度范围内呈线性相关,因此可以检测出农药残留[55]。电化学生物传感器与传统的仪器检测相比具有快速响应、低检出限和良好的选择性等特点[56]。
瑞士IST AG公司生产的生物传感器采用酶法安培测量原理,依靠固定化酶对目标物进行检测和分析,此外IST AG旗下Jobst Technologies GmbH开发的固定化系统还可以调节敏感度和测量范围等参数,满足了对不同目标物的检测需求。除一些传统的用于检测农药残留的电化学生物传感器外,El-Moghazy等[57]制备的电化学免疫传感器通过检测3-苯氧基苯甲酸(3-PBA)的含量可以间接测定拟除虫菊酯对人体的暴露量。Liu等[58]制备的电化学荧光传感器对草甘膦的检测线性范围为0.001-1.0 μmol/L,检出限为0.5 nmol/L。
目前越来越多的农药残留检测在向生物传感器、免疫传感器和微流控芯片等方向发展,这些快速检测技术具有媲美传统检测技术的同时又耗时短、成本低,而固定化酶又是农药快速检测的主要研究内容,本文将参考的由固定化酶原理制备的农药残留检测传感器进行了列举,详细结果见表2。
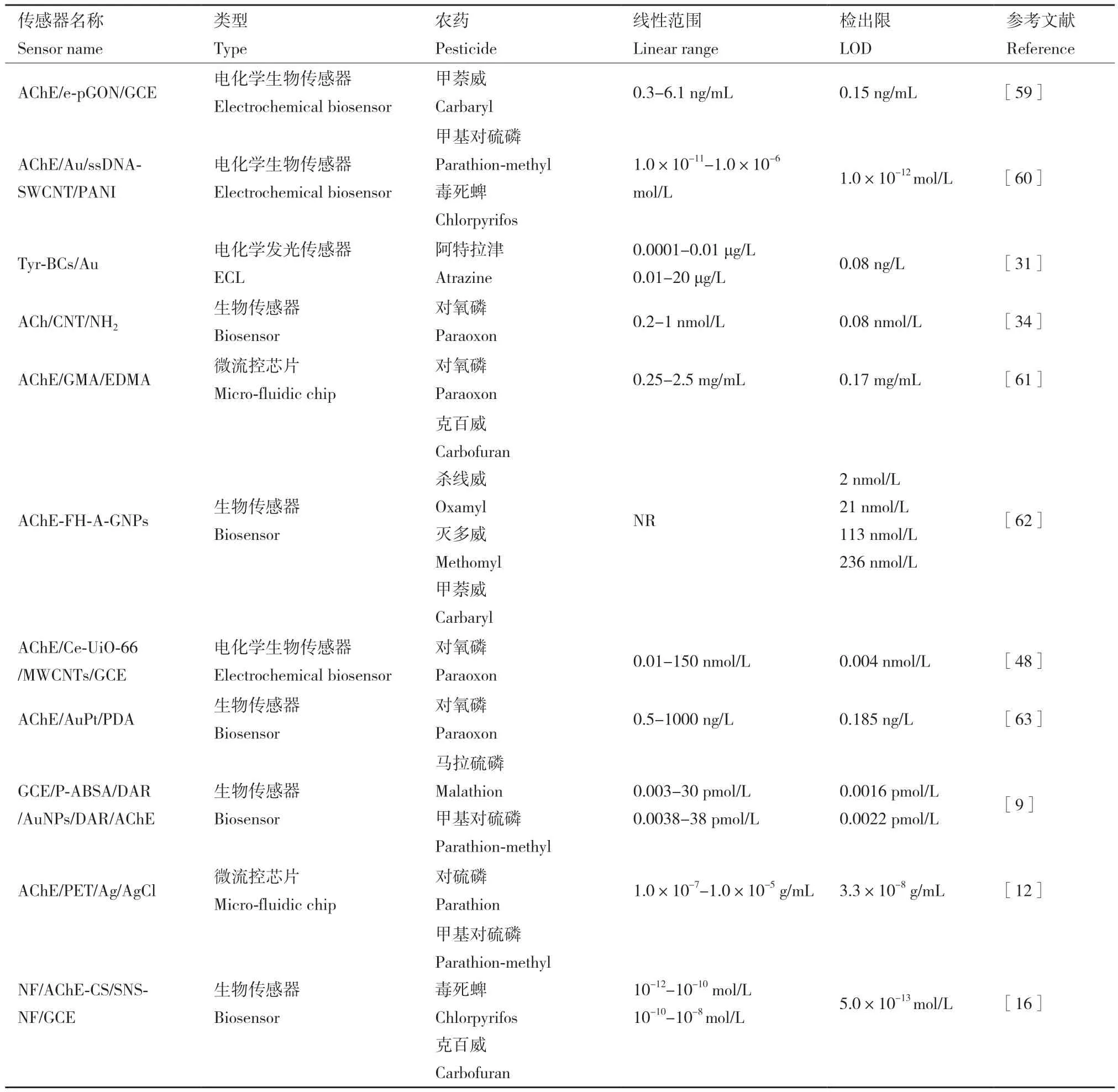
表2 不同类型传感器比较Table 2 Comparison of different types of sensors
4 结论
基于酶抑制法原理制备的固定化酶产品在农药残留检测中的应用使检测速度提高,且检测能力可以与传统的仪器检测性能相当。不同的固定方法可以一定程度实现对酶的固定化。但目前存在的问题是,农药残留检测用酶大部分都局限于一种或者一类酶,即广泛地使用AChE作为固定化酶源,对于其他酶源的固定化研究还较少。因此对于农药残留检测用酶的固定化研究应重点对不同方法、载体和酶源进行探讨,而固定化酶产品运用至农药残留检测中还需要进一步研究和发展。

