ZmJAZ与ZmMYC2的BiFC互作研究
吕迪 陈茹梅 周晓今
(中国农业科学院生物技术研究所,北京 100081)
茉莉酸(jasmonic acid,JA)是一类重要的植物激素,调节植物生长发育、生物胁迫及非生物胁迫的防御应答反应,包括根的伸长、病原菌侵染、叶片衰老和冷胁迫等[1-5]。JAZ蛋白是JA信号通路中的重要组成部分,当植物处于正常生长状态时,体内的JA含量较低,大量积累的JAZ蛋白与下游转录因子MYC2结合并抑制其转录调控活性,从而调控JA信号通路下游基因的表达。当植物受到外界胁迫或接收到特定的生长发育信号时,体内的JA含量迅速升高,SCFCOI1复合体中的COI1蛋白与活性JA分子结合,从而促进该复合体与底物JAZ蛋白相互作用并将其泛素化降解。JAZ蛋白的泛素化降解解除了其对下游转录因子MYC2的抑制,从而激活下游JA信号通路基因的表达[6-9]。JAZ蛋白含有ZIM和Jas两个保守结构域。ZIM结构域包含TIFY基序,其通过与其他蛋白形成二聚体发挥阻遏作用;Jas结构域位于JAZ蛋白的C端,与JAZ蛋白的泛素化降解相关[6,10]。目前玉米中已报道23个JAZ家族基因,它们的表达具有组织特异性。有研究表明,干旱胁迫会诱导ZmJAZ2、ZmJAZ4、ZmJAZ19和ZmJAZ21等基因的表达[11],说明JAZ基因在非生物胁迫中发挥重要作用。
MYC2属于bHLH转录因子家族,其C端具有保守的bHLH结构域,是响应JA信号的核心转录因子。在许多生物途径中,bHLH转录因子都是转录调控网络的重要组成部分,而MYC2作为正调控因子在JA信号通路中发挥重要作用。MYC2能激活受JA诱导的抗虫基因表达,增强植物的抗虫能力[5,12]。Chen等[13]的 研 究 表 明 JA 以 MYC2依赖的方式抑制拟南芥初级根分生组织细胞的分裂;MYC2还是JAZ介导的黄酮类生物合成的正调控因子,过表达MYC2的拟南芥植株表现出更多的花青素积累[5]。JAZ还可以通过与其他信号通路调控因子的相互作用,调节MYC2的活性从而介导JA信号与其他的激素信号途径产生交叉互话。例如,拟南芥中的赤霉素信号通路负调控因子RGA(repressor of ga1-3)通过与MYC2竞争结合JAZ1,从而抑制JAZ蛋白对MYC2的调控作用[14]。此外,最近的研究通过DAP-Seq分析发现ZmMYC2可结合许多植物激素生物合成和信号转导因子编码基因的启动子[15],提示MYC2可作为枢纽整合多种植物内源生长发育和外源性环境信号[16-18]。
虽然JAZ蛋白对MYC2的调控作用在拟南芥和水稻中都有较为深入的研究[19-20],但是仍未见关于玉米中JAZ蛋白和MYC2在体内互作的报道。本研究筛选了玉米中不同表达模式的JAZ基因ZmJAZ4、ZmJAZ8和ZmJAZ12,通过玉米叶肉细胞原生质体瞬时转化和BiFC技术研究ZmJAZ4、ZmJAZ8和ZmJAZ12与ZmMYC2的相互作用,探究这些JAZ蛋白是否都具有结合ZmMYC2的特征,为深入研究玉米JAZ蛋白的生理功能提供依据。
1 材料与方法
1.1 材料
温室培养的玉米Z58自交系黄化苗,于三叶期分离叶片原生质体。
分析ZmJAZs基因相对表达量的植物材料为大田生长的玉米Z58自交系,分别取其根、茎、叶、雄穗和未授粉的雌穗,以及授粉后12 d、21 d和28 d的胚和胚乳保存至-80℃冰箱备用。
大肠杆菌菌株DH5α感受态和反转录试剂盒购自北京全式金公司;pRTL2-GFP、pRTL2-YFPN、pRTL2-YFPC(以下简称为pYFPC和pYFPN)载体由本实验室构建并保存;核定位Marker载体pNLSDsRed由本实验室保存;KOD one Mix为TOYOBO公司产品;限制性内切酶、Infusion克隆试剂盒为Fermentas公司产品;SYBR Green Mix为TaKaRa公司产品。
1.2 方法
1.2.1 ZmJAZs基因实时荧光定量表达分析 使用Primer Premier 6.0软件设计ZmActin(内参)与ZmJAZs基因的特异性引物(表1),以1.1中植物材料提取的RNA反转录的cDNA为模板,参照SYBR Green Mix说明书进行实时荧光定量分析。荧光定量反应体系(20 μL):2 × SYBR Green Mix 10 μL、cDNA 1 μL、ddH2O 8 μL、 上 下 游 引 物 各 0.4 μL、ROX Ⅱ 0.2 μL。反应条件为 94℃预变性 30 s;94℃变性15 s,60℃退火及延伸34 s,循环40次。每个处理重复3次。采用Ct值法(2-ΔΔCt法)分析ZmJAZs基因在不同组织部位的相对表达水平。

表1 实时荧光定量PCR所用引物Table 1 Primers used in qRT-PCR
1.2.2 含有同源重组末端序列的ZmMYC2、ZmJAZ4、ZmJAZ8和 ZmJAZ12基 因 克 隆 根 据文献中报道的ZmMYC2基因,以及MaizeGDB玉米基因组数据库(www.maizegdb.org)中ZmJAZ4(GRMZM2G024680)、ZmJAZ8(GRMZM2G086920)和ZmJAZ12(GRMZM2G101769)基因的全长CDS序列,设计扩增ORF的引物。利用Z58的cDNA做 模 板, 通 过 ZmMYC2、ZmJAZ4、ZmJAZ8和ZmJAZ12基因的特异上游引物和下游引物(表2)扩增得到目的基因的ORF序列。然后,设计Infusion克隆用的引物并以各基因的ORF序列回收产物为模板扩增获得用于构建亚细胞定位和BiFC载体的Infusion插入片段。PCR程序为:94℃ 预变性 5 min;98℃ 变性 10 s,55℃ 退火 15 s,68℃延伸30 s,32个循环;68℃ 终延伸10 min。其中ZmMYC2基因扩增时延伸时间为90 s。

表2 PCR扩增所用引物Table 2 Primers used for gene cloning
1.2.3 亚细胞定位载体的构建 通过Xho I和Xba I双酶切pRTL2-GFP载体,电泳并回收线性载体片段。之后用Infusion克隆试剂盒将片段ZmMYC2-GFP、ZmJAZ4-GFP、ZmJAZ8-GFP、ZmJAZ12-GFP和回收的载体片段相连接。将连接产物转化大肠杆菌DH5α感受态细胞,在含有Amp抗性的LB培养基中37℃培养16 h,挑取单克隆摇菌,双酶切鉴定后,将菌液送北京奥科鼎盛生物科技有限公司进行测序。构建成功的载体分别命名为pZmMYC2-GFP、pZmJAZ4-GFP、pZmJAZ8-GFP 和 pZmJAZ12-GFP。将上述载体大提质粒并定量至1 100 ng/μL待用。
1.2.4 BiFC载体的构建 通过Xho I和Xba I双酶切pYFPN和pYFPC载体,电泳并回收线性载体片段。然后用Infusion克隆试剂盒将载体片段与带有同源重组末端的目的基因序列连接。将连接产物转化大肠杆菌DH5α感受态细胞,在含有Amp抗性的LB培养基中37℃培养16 h,挑取单克隆摇菌,双酶切鉴定后,将菌液送北京奥科鼎盛生物科技有限公司进行测序。构建成功的载体分别命名为pZmMYC2-YFPN、pZmMYC2-YFPC、pZmJAZ4-YFPN、pZmJAZ4-YFPC、pZmJAZ8-YFPN、pZmJAZ8-YFPC、pZmJAZ12-YFPN和pZmJAZ12-YFPC。将上述载体大提质粒并定量至1 100 ng/μL待用。
1.2.5 载体转化玉米叶肉细胞原生质体 首先配制转化玉米叶肉细胞原生质体所需的试剂,酶解液(0.4 mol/L甘露醇、0.02 mol/L KCl、0.02 mol/L MES 调节pH 至 5.7、1.5% CelluLase R10、0.4% Macerozyme R10、0.01 mol/L CaCl2和 0.1% BSA)、W5缓 冲 液(0.002 mol/L MES 调节pH至 5.7、0.154 mol/L NaCl、0.125 mol/L CaCl2、0.005 mol/L KCl)、MMg 缓 冲 液(0.004 mol/L MES 调 节 pH至 5.7、0.4 mol/L甘 露醇、0.015 mol/L MgCl2)和40% PEG-Ca2+溶液(40%PEG4000、0.2 mol/L 甘露醇、0.1 mol/L CaCl2)。
取玉米黄化苗第二片真叶的中间5-7 cm部分,将其切成0.5-1 mm的细丝,转移至含有酶解液的平皿中,在28℃ 摇床上以35 r/min的转速于黑暗条件下酶解4 h。然后使用350目的过滤网将酶解液过滤至50 mL离心管中,加入等体积的W5缓冲液,混匀后在4℃、100×g转速条件下离心2 min,沉淀原生质体,之后弃去上清液。再加入3 mL冷的W5缓冲液冰上孵育30 min。弃上清后加入3 mL的MMg缓冲液重悬细胞,此时即收集到了玉米叶肉细胞的原生质体,镜检观察细胞数目和形态,冰上静置待用。
亚细胞定位实验中,在2 mL的离心管中分别加入细胞核定位的红色荧光蛋白表达载体pNLS-DsRed和目标蛋白亚细胞定位载体各10 μL。BiFC实验中,在2 mL的离心管中分别加入pNLSDsRed、融合表达YFPN和YFPC的载体各7 μL。混匀各载体后加入200 μL的原生质体。然后加入220 μL的40% PEGCa2+溶液,混匀,并于室温静置30 min。随后加入880 μL W5缓冲液,100×g转速室温离心2 min,弃上清;加入1 mL的W5缓冲液,黑暗常温培养12-16 h后用激光共聚焦显微镜观察并拍照。
2 结果
2.1 玉米ZmJAZ4、ZmJAZ8和ZmJAZ12基因的表达分析
利用qRT-PCR的方法分析ZmJAZ4、ZmJAZ8和ZmJAZ12在玉米Z58自交系各个组织部位的相对表达量。结果如图1所示,ZmJAZ4主要在胚乳中高表达,在根、茎、叶、雄穗和未授粉的雌穗中表达量相对较低;ZmJAZ8主要在雄花和雌穗这类生殖器官中高表达;ZmJAZ12在植株的绝大多数组织均有表达,且表达量相对稳定,在胚乳中表达量相对较低。

图1 ZmJAZ4、ZmJAZ8和ZmJAZ12基因的相对表达量Fig.1 Relative expressions of ZmJAZ4,ZmJAZ8,and ZmJAZ12
2.2 亚细胞定位载体的构建及验证
利用反转录玉米cDNA为模板用基因特异引物扩 增 ZmMYC2、ZmJAZ4、ZmJAZ8和 ZmJAZ12的ORF序列。通过Infusion方法将各基因的ORF与亚细胞定位载体骨架连接,最后构建成功的载体分别命 名 为 pZmMYC2-GFP、pZmJAZ4-GFP、pZmJAZ8-GFP和pZmJAZ12-GFP(图2-A)。双酶切鉴定分别获得 1 460 bp 和 650 bp(ZmMYC2)、651 bp(ZmJAZ4)、651 bp(ZmJAZ8)、714 bp(ZmJAZ12)的特异条带(图2-B)。因为ZmMYC2的CDS在651 bp处存在一个Xho I的酶切位点,所以酶切检测获得了1 460 bp和650 bp两个片段。同时对构建完成的载体进行了测序,结果通过DNAMAN比对与MaizeGDB数据库中的序列一致,结合酶切检测和测序结果表明亚细胞定位载体构建正确。

图2 亚细胞定位载体和酶切鉴定电泳图Fig.2 Vectors for subcellular localization and enzyme digestion identification
2.3 BiFC融合载体的构建及验证
利用反转录玉米的cDNA为模板用上述引物扩 增 ZmMYC2、ZmJAZ4、ZmJAZ8和 ZmJAZ12的ORF序列。通过Infusion方法将各基因的ORF与BiFC载体连接,形成ZmMYC2、ZmJAZ4、ZmJAZ8和ZmJAZ12分别与YFPN和YFPC融合表达的载体(图3-A)。双酶切鉴定分别获得1 460 bp和650 bp(ZmMYC2)、651 bp(ZmJAZ4)、651 bp(ZmJAZ8)、714 bp(ZmJAZ12)的特异条带(图3-B)。同时对构建完成的载体进行了测序,结果通过DNAMAN比对与MaizeGDB数据库中的序列一致,结合酶切检测和测序结果表明BiFC融合表达载体构建正确。
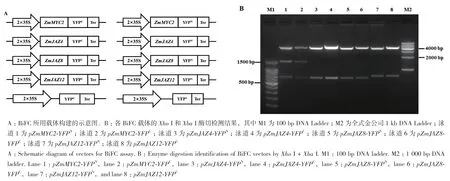
图3 BiFC载体构建示意图和酶切鉴定电泳图Fig.3 Vectors for BiFC assay and enzyme digestion identification
2.4 亚细胞定位结果
取培养好的原生质体细胞进行激光共聚焦显微观察GFP荧光信号。结果显示,在激光共聚焦显微镜下 pZmMYC2-GFP、pZmJAZ4-GFP、pZmJAZ8-GFP和ZmJAZ12-GFP均在细胞核中检测到GFP荧光信号,同时该荧光信号与细胞核的红色荧光信号重合(图4)。亚细胞定位实验设置pRTL-GFP转化的空载GFP为对照,GFP在细胞质与细胞核中均有分布。亚细胞定位的结果表明ZmMYC2、ZmJAZ4、ZmJAZ8和ZmJAZ12均定位于细胞核中。

图4 ZmJAZ4、ZmJAZ8、ZmJAZ12和ZmMYC2的亚细胞定位Fig. 4 Subcellular localization of ZmJAZ4,ZmJAZ8,ZmJAZ12 and ZmMYC2
2.5 BiFC检测蛋白互作
取培养好的原生质体细胞进行激光共聚焦显微观察YFP荧光信号,设置pYFPC和pZmMYC2-YFPN、pYFPN和pZmMYC2-YFPC为阴性对照。结果显示,在激光共聚焦显微镜下阴性对照无荧光信号,仅有核荧光信号;而pZmMYC2-YFPN和pZmJAZ4-YFPC、pZmMYC2-YFPN和 pZmJAZ8-YFPC、pZmMYC2-YFPN和 pZmJAZ12-YFPC、pZmMYC2-YFPC和pZmJAZ4-YFPN、pZmMYC2-YFPC和 pZmJAZ8-YFPN、pZmMYC2-YFPC和pZmJAZ12-YFPN均在细胞核中检测到YFP荧光信号,同时该荧光信号与核荧光信号重合(图5)。BiFC结果表明ZmMYC2和ZmJAZ4、ZmJAZ8、ZmJAZ12在植物体内存在蛋白互作,且相互作用发生在细胞核中。

图5 ZmMYC2与ZmJAZ4、ZmJAZ8和ZmJAZ12的BiFC互作验证Fig. 5 BiFC assay to verify interactions between ZmJAZs with ZmMYC2
3 讨论
多种植物激素中,普遍认为赤霉素、生长素、脱落酸和细胞分裂素是调节植物生长发育的重要激素,茉莉酸和水杨酸在植物应对生物和非生物胁迫中发挥主要作用。但是近些年随着对JA信号通路的研究越来越多,发现JA不仅在植物抵抗生物胁迫过程中发挥作用,而且在植物的性别决定以及生长发育中也发挥重要作用。在玉米ts1(tasselseed1)突变体的研究中克隆得到的ts1基因,其编码产物具有13-脂氧合酶(13-lipoxygenase,13-LOX)的特征,13-LOX酶类是茉莉酸合成途径重要的酶类。ts1突变体未成熟雄花序中脂氧合酶的活性消失,且内源茉莉酸浓度降低至野生型玉米的十分之一,对突变体未成熟雄花序外施JA可恢复雄花的正常发育[21],说明JA的缺乏是造成突变体表型的原因,也说明JA是玉米雄花性别决定中的一种重要的信号物质。另外有研究表明JA对拟南芥叶肉细胞中的叶绿素有明显的降解作用,进而使植物叶片生长受到抑制,表现出黄化衰老的特征[22]。JA通过COI1可抑制光合作用过程中的关键酶1,5-二磷酸核酮糖羧化酶的表达,干扰光合作用进程,进而抑制幼苗的生长[23]。拟南芥中的JA不敏感突变体coi1中的F-box蛋白突变使其不能参与形成SCF(Skp1/Cullin/F-box)复合体,导致JAZs蛋白降解调控失效,突变体表现为对JA激素不敏感且雄性不育[24]。与此不同的是,番茄中对应的jai1(jasmonic acid-insensitive1)突变体也是JA不敏感的突变体,突变位点同样位于F-box蛋白,但是突变体表现为雌性不育[25]。由此可见,不同植物的JA信号调控机制既有保守性又存在差异性。
另有研究表明,ZmJAZ4在非生物胁迫处理(盐、干旱、ABA等)时被诱导表达,推测ZmJAZ4蛋白可能作为转录调节因子在逆境胁迫信号通路中发挥一定的调控作用[26]。和ZmJAZ4相反,ZmJAZ12在干旱胁迫下被抑制表达[27];ZmJAZ4主要在籽粒中高表达,而ZmJAZ12在各个组织均有表达,提示玉米在应对环境胁迫时,不同的JAZ蛋白在各自表达的组织部位可能发挥不同的作用。在黑粉菌(Sphacelotheca reiliana)侵染后ZmJAZ4和ZmJAZ8被诱导表达,茎腐病菌(F.moniliforme)侵染后ZmJAZ12也被上调表达[27],提示ZmJAZ4、ZmJAZ8和ZmJAZ12在抵抗病原菌侵染的过程中发挥作用。
玉米的生殖发育过程和拟南芥以及水稻不同,玉米的生殖发育过程中还涉及雌雄花的性别决定,因此JA信号通路在玉米中的作用可能更为复杂。MYC2和JAZ蛋白的互作是JA信号通路传导中的重要环节,同时MYC2还是JA和其他激素信号途径交叉互话的核心转录因子,更深入细致地探究JA信号通路在玉米中的转导机制就显得很有必要。JAZ蛋白和MYC2作为JA信号通路中的重要组分,明确两者之间的相互作用关系对后续研究将提供重要的基础。同时,为后续通过Pull-down和Co-IP等实验进一步验证ZmJAZ和ZmMYC2的相互作用,探寻其互作位点提供了参考依据。
4 结论
本研究在玉米叶肉细胞原生质体中对JA信号通路中3个不同的JAZ家族蛋白ZmJAZ4、ZmJAZ8和ZmJAZ12与ZmMYC2的互作关系进行了BiFC验证。结果显示,3个不同的ZmJAZ蛋白均可与ZmMYC2在细胞核中互作。

